
Type hier je voorbeelden.
- 9.1 Signaalmoleculen en cellulaire receptoren
- 9.2 Voortplanting van het signaal
- 9.3 Reactie op het signaal
Stel je eens voor hoe het leven eruit zou zien als jij en de mensen om je heen niet met elkaar zouden kunnen communiceren. U zou uw wensen niet aan anderen kenbaar kunnen maken, noch zou u vragen kunnen stellen om meer over uw omgeving te weten te komen. Sociale organisatie is afhankelijk van communicatie tussen de individuen waaruit die samenleving bestaat.
Net als bij mensen is het voor individuele cellen van vitaal belang om met hun omgeving en met elkaar te kunnen communiceren. Dit geldt ongeacht of een cel alleen in een vijver groeit of een van de vele cellen is die een groter organisme vormen. Om goed te kunnen reageren op prikkels van buitenaf, hebben cellen complexe communicatiemechanismen ontwikkeld, zodat ze een boodschap kunnen ontvangen, de informatie over het plasmamembraan kunnen overdragen, en vervolgens veranderingen in de cel kunnen produceren als reactie op de boodschap.
In meercellige organismen zenden en ontvangen cellen voortdurend chemische boodschappen om de acties van andere organen, weefsels, en cellen te coördineren. De mogelijkheid om snel en efficiënt berichten te verzenden stelt cellen in staat hun functies te coördineren en nauwkeurig af te stemmen. Hoewel de noodzaak van cellulaire communicatie in grotere organismen voor de hand lijkt te liggen, communiceren zelfs eencellige organismen met elkaar. Gistcellen geven elkaar signalen om de paring te bevorderen. Sommige vormen van bacteriën coördineren hun acties om grote complexen te vormen die biofilms worden genoemd of om de productie van toxines te organiseren om concurrerende organismen te verwijderen. Het vermogen van cellen om te communiceren door middel van chemische signalen is ontstaan in eencelligen en was essentieel voor de evolutie van meercellige organismen. Efficiënte, foutloze communicatie is van vitaal belang voor al het leven.
- 9.1 Signaalmoleculen en cellulaire receptoren
- 9.1.1 Vormen van signalering
- Paracriene signalering
- Autocriene signalering
- Endocriene signalering
- Directe signalering
- 9.1.2 Soorten receptoren
- Interne receptoren
- Cell-Surface Receptors
- 9.1.3 Signaalmoleculen
- Kleine hydrofobe liganden
- Wateroplosbare liganden
- 9.2 | Voortplanting van het signaal
- 9.2.1 Signaalwegen en signaalversterking
- 9.2.2 Methoden voor intracellulaire signalering
- Fosforylering
- Secondemessengers
- 9.3 | Reactie op het signaal
- 9.3.1 Reacties op de signaaltransductieroute
- Gene Expressie
- Toename van het celmetabolisme
- Celgroei
- Celdood
- 9.3.2 Beëindiging van signaalwegen
9.1 Signaalmoleculen en cellulaire receptoren
Aan het eind van dit hoofdstuk zult u in staat zijn:
- Vier soorten signalering te beschrijven die in meercellige organismen worden aangetroffen.
- Inwendige receptoren kunnen vergelijken met receptoren op het celoppervlak.
- Herkennen wat het verband is tussen de chemie van een ligand en zijn werkingsmechanisme.
Er zijn twee soorten communicatie in de wereld van levende cellen. Communicatie tussen cellen wordt intercellulaire signalering genoemd, en communicatie binnen een cel wordt intracellulaire signalering genoemd. Een gemakkelijke manier om dit onderscheid te onthouden is door te begrijpen dat het voorvoegsel inter- “tussen” betekent (een snelweg doorkruist staten) en intra- “binnen” (een infuus betekent intraveneus of “in de ader”).
Chemische signalen worden afgegeven door een signaalcel en ontvangen door een doelcel. Doelcellen hebben eiwitten, receptoren genaamd, die zich binden aan signaalmoleculen en een reactie veroorzaken. Signaalmoleculen die zich binden aan receptoren worden liganden genoemd. Liganden en receptoren zijn specifiek voor elkaar; een receptor bindt zich doorgaans alleen aan zijn specifieke ligand. Er zijn echter verschillende soorten signalering.
9.1.1 Vormen van signalering
Er zijn vier categorieën van chemische signalering die in meercellige organismen worden aangetroffen: autocriene signalering, paracriene signalering, endocriene signalering, en directe signalering over gap junctions (figuur 9.2). Het belangrijkste verschil tussen de verschillende signaalcategorieën is de afstand die het signaal aflegt om de doelcel te bereiken.
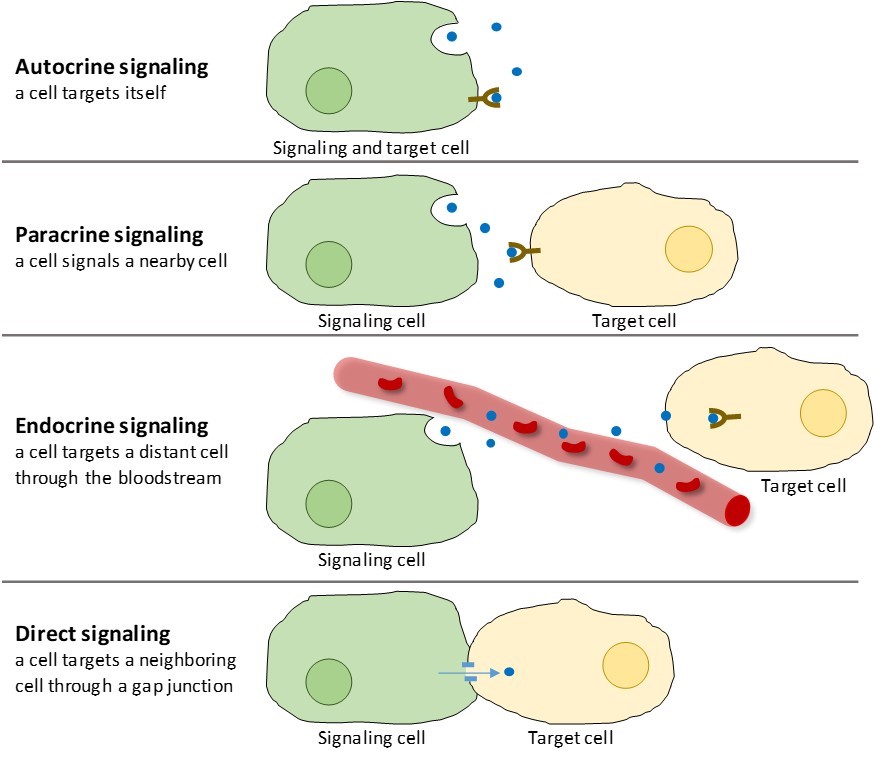
Paracriene signalering
Signalen die lokaal werken tussen cellen die dicht bij elkaar liggen, worden paracriene signalen genoemd. Paracriene signalen verplaatsen zich door diffusie door de extracellulaire matrix (figuur 9.2). Dit soort signalen lokt gewoonlijk snelle reacties uit die slechts korte tijd duren. Om de respons gelokaliseerd te houden, worden paracriene liganden gewoonlijk snel afgebroken door enzymen of verwijderd door naburige cellen. Het verwijderen van de signalen herstelt de concentratiegradiënt voor het signaalmolecuul, waardoor ze snel door de intracellulaire ruimte kunnen diffunderen als ze weer vrijkomen.
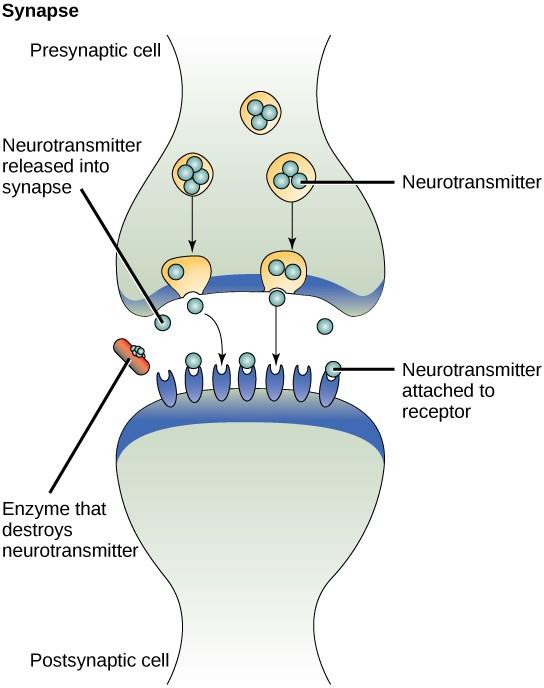
Een voorbeeld van paracriene signalering is de overdracht van signalen tussen zenuwcellen. De kleine ruimte tussen zenuwcellen waar de signaaloverdracht plaatsvindt, wordt een synaps genoemd. Signalen worden langs zenuwcellen geleid door snel bewegende elektrische impulsen. Wanneer deze impulsen het einde van een zenuwcel bereiken, worden door de presynaptische cel (de cel die het signaal uitzendt) chemische liganden, neurotransmitters genaamd, in de synaps vrijgegeven. De neurotransmitters verspreiden zich over de synaps (figuur 9.3). Door de kleine afstand tussen zenuwcellen kan het signaal zich snel verplaatsen, waardoor een onmiddellijke reactie mogelijk is, zoals: “haal je hand van het fornuis!” Wanneer de neurotransmitter de receptor op het oppervlak van de postsynaptische cel bindt, wordt de volgende elektrische impuls gelanceerd. De neurotransmitters worden snel afgebroken of door de presynaptische cel weer opgenomen, zodat de ontvangende zenuwcel zich snel kan herstellen en voorbereid is om snel op het volgende synaptische signaal te reageren.
Autocriene signalering
Wanneer een cel reageert op zijn eigen signaleringsmolecuul, wordt dit autocriene signalering genoemd (auto = “zelf”). Autocriene signalering komt vaak voor in combinatie met andere soorten signalering. Wanneer bijvoorbeeld een paracrien signaal vrijkomt, kan de signalerende cel samen met zijn buren op het signaal reageren (figuur 9.2).
Autocriene signalering komt vaak voor tijdens de vroege ontwikkeling van een organisme om ervoor te zorgen dat cellen zich tot de juiste weefsels ontwikkelen. Autocriene signalering regelt ook de pijngewaarwording en ontstekingsreacties. Als een cel met een virus is geïnfecteerd, kan de cel zichzelf het signaal geven dat hij een geprogrammeerde celdood moet ondergaan, waarbij het virus wordt gedood.
Endocriene signalering
Signalen van cellen op afstand worden endocriene signalen genoemd, en ze zijn afkomstig van endocriene cellen. (In het lichaam bevinden veel endocriene cellen zich in endocriene klieren, zoals de schildklier, de hypothalamus en de hypofyse). Dit soort signalen geeft gewoonlijk een tragere reactie, maar heeft een langduriger effect. De liganden die vrijkomen bij endocriene signalering worden hormonen genoemd, signaalmoleculen die in een deel van het lichaam worden geproduceerd, maar op enige afstand andere lichaamsgebieden beïnvloeden (figuur 9.2).
Hormonen leggen de grote afstanden tussen endocriene cellen en hun doelcellen af via de bloedbaan, wat een relatief langzame manier is om zich door het lichaam te verplaatsen. Door hun vorm van transport worden hormonen verdund en zijn zij in lage concentraties aanwezig wanneer zij op hun doelcellen inwerken. Dit is anders dan bij paracriene signalering, waarbij lokale concentraties van signaalmoleculen zeer hoog kunnen zijn.
Directe signalering
Gap junctions bij dieren en plasmodesmata bij planten zijn verbindingen tussen de plasmamembranen van naburige cellen. Deze met water gevulde kanalen laten kleine signaalmoleculen tussen de twee cellen diffunderen. Kleine moleculen, zoals calciumionen (Ca2+), kunnen zich tussen cellen verplaatsen, maar grote moleculen zoals eiwitten en DNA passen niet door de kanalen. De specificiteit van de kanalen zorgt ervoor dat de cellen onafhankelijk blijven, maar wel snel en gemakkelijk signalen kunnen doorgeven. Directe signalering stelt een groep cellen in staat hun reactie op een signaal te coördineren dat slechts één van hen heeft ontvangen. In planten zijn plasmodesmata alomtegenwoordig, waardoor de hele plant een reusachtig communicatienetwerk is geworden.
9.1.2 Soorten receptoren
Receptoren zijn eiwitmoleculen in de doelcel of op zijn oppervlak die zich binden aan liganden. Er zijn twee soorten receptoren, interne receptoren en receptoren op het celoppervlak.
Interne receptoren
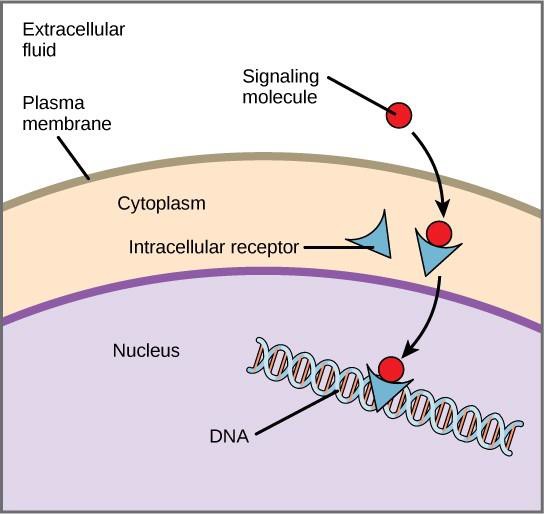
Interne receptoren, ook wel intracellulaire of cytoplasmatische receptoren genoemd, bevinden zich in het cytoplasma van doelcellen en reageren op hydrofobe ligandmoleculen die in staat zijn zich over het plasmamembraan te verplaatsen. Eenmaal in de cel binden veel van deze moleculen zich aan eiwitten die fungeren als regulatoren van de mRNA-synthese (transcriptie) om de genexpressie te mediëren.
Genexpressie is het cellulaire proces waarbij de informatie in het DNA van een cel wordt omgezet in een reeks aminozuren, die uiteindelijk een eiwit vormt. Wanneer het ligand bindt aan de interne receptor, wordt een conformatieverandering teweeggebracht die een DNA-bindende plaats op het receptoreiwit blootlegt. Het ligand-receptorcomplex beweegt zich naar de kern, bindt zich vervolgens aan specifieke regulerende regio’s van het chromosomale DNA en bevordert de initiatie van transcriptie (figuur 9.4). Transcriptie is het proces waarbij de informatie in het DNA van een cel wordt gekopieerd naar een speciale vorm van RNA die boodschapper-RNA (mRNA) wordt genoemd; de cel gebruikt de informatie in het mRNA om specifieke aminozuren in de juiste volgorde aan elkaar te koppelen, waardoor een eiwit wordt geproduceerd. Wanneer een ligand zich dus aan een interne receptor bindt, kan het de genexpressie in de doelcel rechtstreeks beïnvloeden.
Cell-Surface Receptors
Cell-surface receptoren, ook bekend als transmembraanreceptoren, zijn integrale eiwitten die zich aan externe signaalmoleculen binden. Deze receptoren omspannen het plasmamembraan en voeren signaaltransductie uit, waarbij een extracellulair signaal wordt omgezet in een intercellulair signaal. (Figuur 9.5). Omdat receptoreiwitten op het celoppervlak van fundamenteel belang zijn voor het normaal functioneren van cellen, hoeft het niet te verbazen dat een storing in een van deze eiwitten ernstige gevolgen kan hebben. Fouten in de eiwitstructuren van bepaalde receptormoleculen blijken een rol te spelen bij hypertensie (hoge bloeddruk), astma, hartziekten en kanker.
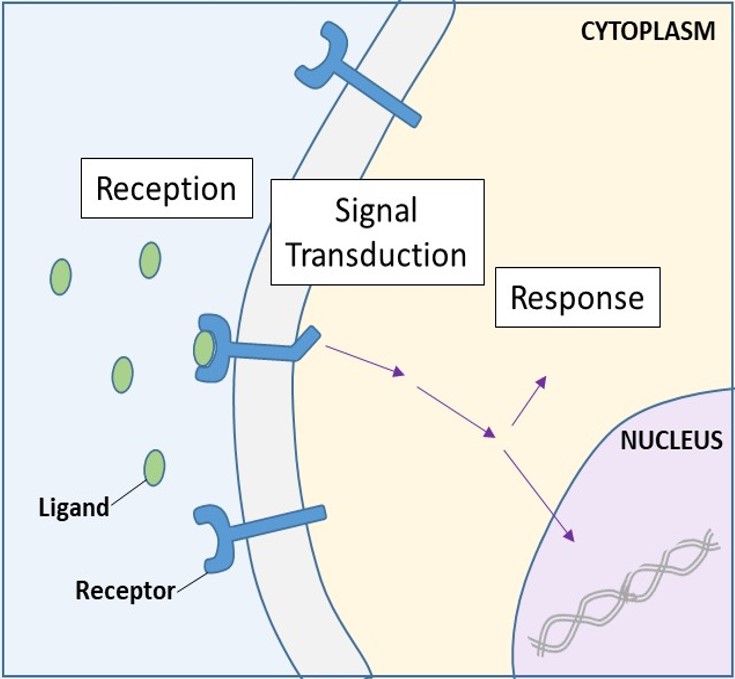
Elke celoppervlaktereceptor heeft drie hoofdcomponenten: een extern ligandbindend domein, of extracellulair domein; een hydrofoob membraanoverspannend gebied; en een intracellulair domein. Receptoren op celoppervlakken zijn betrokken bij de meeste signaleringen in meercellige organismen. Er zijn drie algemene categorieën van cel-oppervlakte receptoren: enzym-gebonden receptoren, ion-kanaal-gebonden receptoren, en G-eiwit-gebonden receptoren.
Enzym-gebonden receptoren zijn cel-oppervlakte receptoren met intracellulaire domeinen die geassocieerd zijn met een enzym. In sommige gevallen is het intracellulaire domein van de receptor zelf een enzym. Andere enzymgekoppelde receptoren hebben een klein intracellulair domein dat rechtstreeks met een enzym interageert. Enzyme-linked receptoren hebben normaliter grote extracellulaire en intracellulaire domeinen, maar het membraan-overspannende gebied bestaat uit een enkele alfa-helix in de peptidestreng.
Wanneer een ligand bindt aan het extracellulaire domein van een enzyme-linked receptor, wordt een signaal door het membraan overgedragen, waardoor het enzym wordt geactiveerd. Activering van het enzym zet een keten van gebeurtenissen in de cel in gang die uiteindelijk tot een reactie leidt.
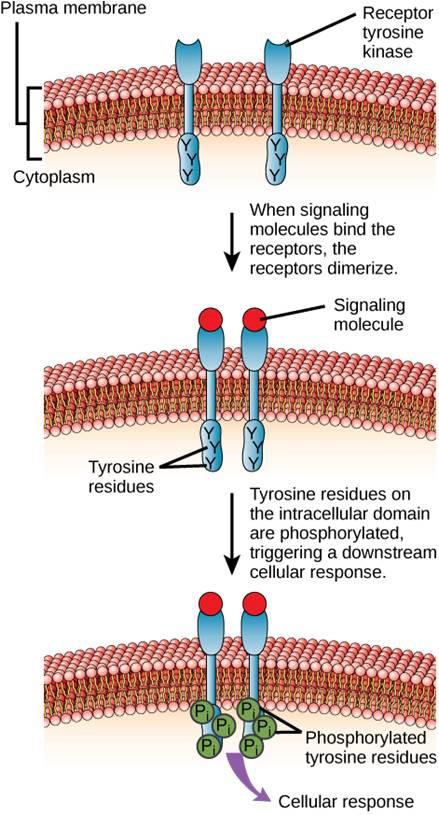
Een voorbeeld van een enzymgekoppelde receptor is de tyrosinekinase-receptor (figuur 9.6). Een kinase is een enzym dat fosfaatgroepen van ATP overbrengt naar een ander eiwit. De tyrosinekinase-receptor brengt fosfaatgroepen over op tyrosinemoleculen. Eerst binden signaalmoleculen zich aan het extracellulaire domein van twee naburige tyrosinekinase-receptoren. De twee naburige receptoren binden zich vervolgens aan elkaar, of dimeren. Fosfaten worden dan toegevoegd aan tyrosineresiduen op het intracellulaire domein van de receptoren (fosforylering). De gefosforyleerde residuen kunnen dan het signaal doorgeven aan de volgende boodschapper in het cytoplasma.
Epidermale groeifactor receptoren zijn een voorbeeld van receptor tyrosine kinasen die deze wijze van signalering volgen. Defecten in de ErbB-signalering in deze familie kunnen leiden tot neuromusculaire ziekten zoals multiple sclerose en de ziekte van Alzheimer.
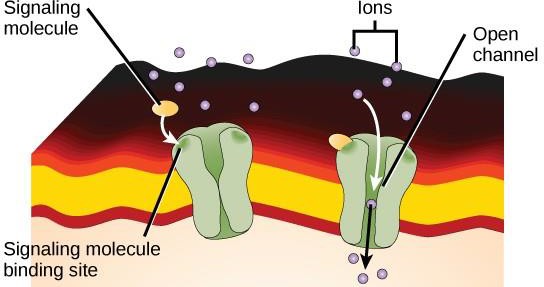
Ionkanaalgekoppelde receptoren binden zich aan een ligand en openen een kanaal door het membraan dat specifieke ionen doorlaat. Dit type receptor op het celoppervlak heeft een uitgebreid membraanoverspannend gebied met hydrofobe aminozuren. Omgekeerd zijn de aminozuren aan de binnenzijde van het kanaal hydrofiel om de doorgang van ionen mogelijk te maken. Wanneer een ligand zich bindt aan de extracellulaire regio van het kanaal, vindt er een conformatieverandering plaats in de structuur van het eiwit, waardoor ionen zoals natrium, calcium, magnesium of waterstof kunnen passeren (figuur 9.7).
G-eiwitgekoppelde receptoren binden zich aan een ligand en activeren een geassocieerd G-eiwit. Het geactiveerde G-eiwit gaat vervolgens een interactie aan met een nabijgelegen membraaneiwit, dat een ionkanaal of een enzym kan zijn (figuur 9.8). Alle G-eiwitgebonden receptoren hebben zeven transmembraandomeinen, maar elke receptor heeft een specifiek extracellulair domein en een G-eiwitbindingsplaats.
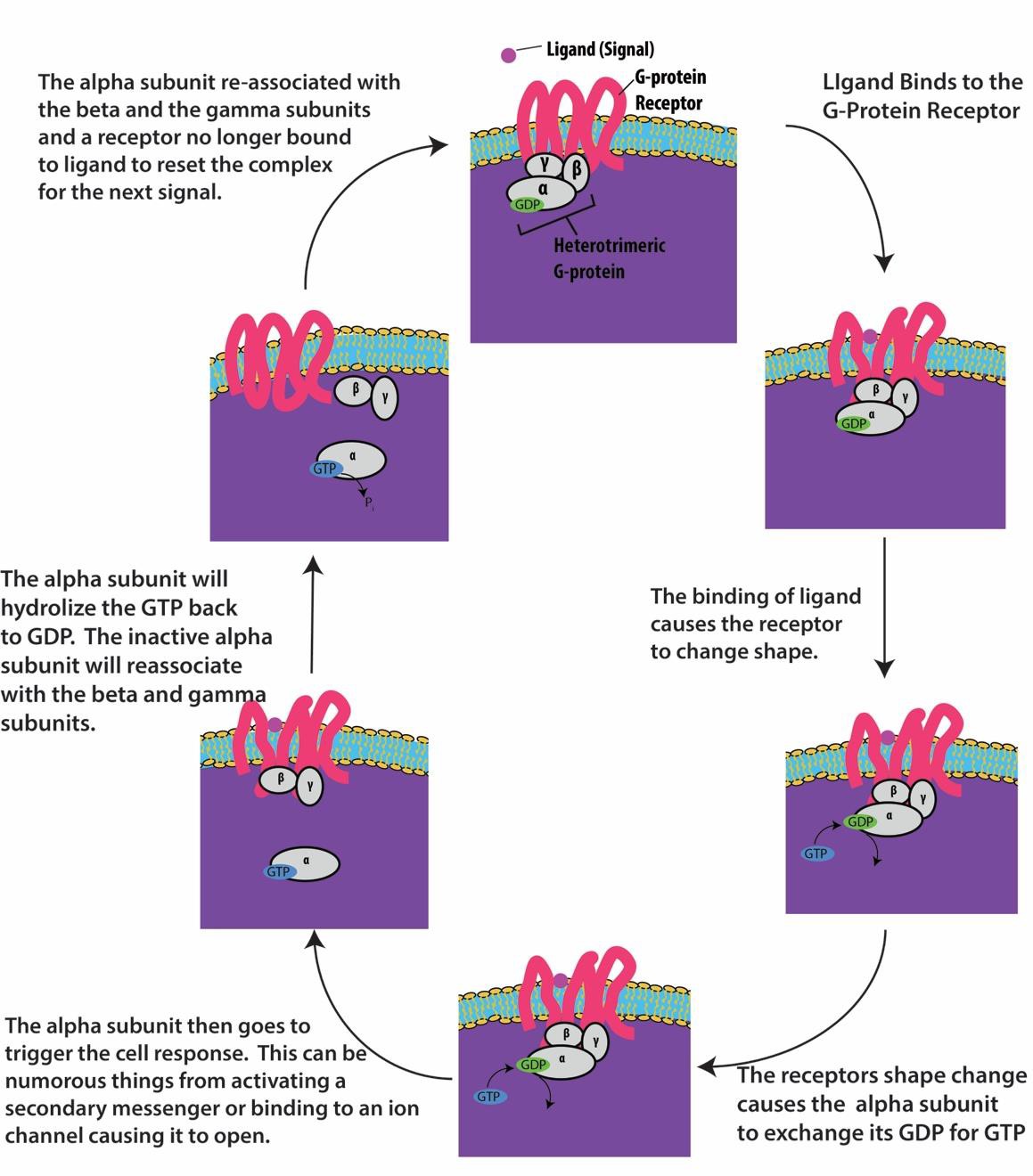
Celsignalering met behulp van aan G-eiwitten gekoppelde receptoren verloopt in een cyclus. Zodra het ligand bindt aan de receptor, activeert de resulterende vormverandering het G-eiwit, dat het GDP vrijgeeft en GTP oppikt. De subeenheden van het G-eiwit splitsen zich vervolgens in α- en βγ-subeenheden. Een of beide van deze G-eiwitfragmenten kunnen andere eiwitten in de cel activeren. Na enige tijd wordt het GTP op de actieve α-subeenheid van het G-eiwit gehydrolyseerd tot GDP en wordt de βγ-subeenheid gedeactiveerd. De subeenheden associëren opnieuw tot het inactieve G-eiwit en de cyclus begint opnieuw (figuur 9.8).
G-eiwit gekoppelde receptoren worden gebruikt in vele fysiologische processen, waaronder die voor visie-transductie, smaak, en regulering van het immuunsysteem en ontsteking.

HER2 is een receptor tyrosinekinase. In 30 procent van de borstkankers bij de mens is HER2 permanent geactiveerd, wat leidt tot ongereguleerde celdeling. Lapatinib, een geneesmiddel dat wordt gebruikt om borstkanker te behandelen, remt het proces waarbij de receptor zichzelf fosforyleert, waardoor de tumorgroei met 50 procent afneemt. Welke van de volgende stappen zou door Lapatinib worden geremd?
- Binding van signaalmoleculen, dimerisatie, en de downstream cellulaire respons
- Dimerisatie, en de downstream cellulaire respons
- De downstream cellulaire respons
- Fosfatase-activiteit, dimerisatie, en de downstream cellulaire respons
9.1.3 Signaalmoleculen
Liganden, die door signaalcellen worden geproduceerd, zijn chemische signalen die naar doelcellen gaan en een reactie veroorzaken. De soorten moleculen die als liganden dienen zijn ongelooflijk gevarieerd en gaan van kleine proteïnen tot kleine ionen. Liganden worden gecategoriseerd als kleine hydrofobe liganden, die plasmamembranen kunnen passeren, of in water oplosbare liganden, die dat niet kunnen.
Kleine hydrofobe liganden
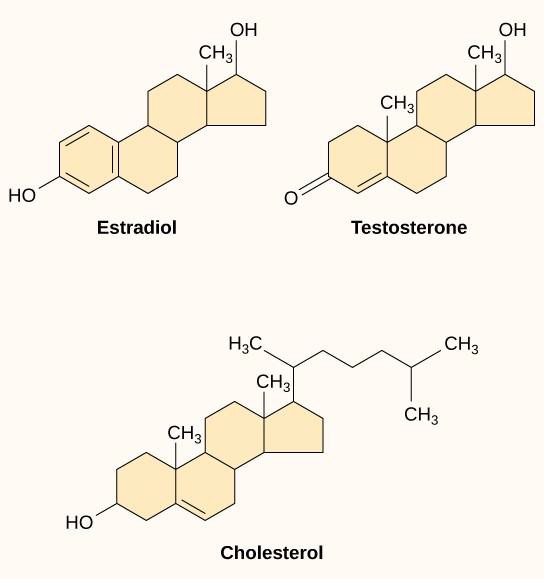
Kleine hydrofobe liganden, ook wel lipide-oplosbare liganden genoemd, kunnen direct door het plasmamembraan diffunderen en een interactie aangaan met interne receptoren. Belangrijke leden van deze klasse liganden zijn de steroïdhormonen. Steroïden zijn lipiden met een koolwaterstofskelet met vier gefuseerde ringen; verschillende steroïden hebben verschillende functionele groepen aan het koolstofskelet. Tot de steroïdhormonen behoren het vrouwelijke geslachtshormoon estradiol, dat een soort oestrogeen is; het mannelijke geslachtshormoon testosteron; en cholesterol, dat een belangrijk structureel bestanddeel van biologische membranen en een precursor van steroïdhormonen is (figuur 9.10). Andere hydrofobe hormonen zijn onder meer schildklierhormonen en vitamine D. Om oplosbaar te zijn in het bloed moeten hydrofobe liganden zich binden aan dragereiwitten terwijl ze door de bloedbaan worden getransporteerd.
Wateroplosbare liganden
Omdat wateroplosbare liganden polair zijn, kunnen ze het plasmamembraan niet zonder hulp passeren. Soms zijn ze te groot om überhaupt het membraan te passeren. In plaats daarvan binden de meeste in water oplosbare liganden zich aan het extracellulaire domein van receptoren op het celoppervlak (zie figuur 9.5). Deze groep liganden is zeer divers en omvat kleine moleculen, peptiden en eiwitten.
9.2 | Voortplanting van het signaal
Aan het eind van dit hoofdstuk zult u in staat zijn:
- Uit te leggen hoe de binding van een ligand signaaltransductie in gang zet in een cel.
- Herkennen dat intracellulaire signalen worden doorgegeven door de rol van fosforylering of tweede boodschappers.
Als een in water oplosbaar ligand eenmaal aan zijn receptor bindt, wordt het signaal door het membraan en in het cytoplasma doorgegeven. Het op deze wijze voortzetten van een signaal wordt signaaltransductie genoemd (figuur 9.5). Signaaltransductie vindt alleen plaats met receptoren op het celoppervlak, aangezien interne receptoren de cel kunnen binnendringen.
Wanneer een ligand aan zijn receptor bindt, treden conformatieveranderingen op die het intracellulaire domein van de receptor beïnvloeden. Deze conformatieveranderingen leiden tot activering van het intracellulaire domein of de daarmee geassocieerde eiwitten. In sommige gevallen veroorzaakt binding van het ligand dimerisatie van de receptor, wat betekent dat twee receptoren zich aan elkaar binden om een stabiel complex te vormen dat een dimeer wordt genoemd. Een dimeer is een chemische verbinding die wordt gevormd wanneer twee (vaak identieke) moleculen zich met elkaar verbinden. Door de binding van de receptoren op deze wijze kunnen hun intracellulaire domeinen met elkaar in contact komen en elkaar activeren.
9.2.1 Signaalwegen en signaalversterking
Hoewel signaalmoleculen vaak in zeer lage concentraties voorkomen, kunnen zij diepgaande effecten teweegbrengen. Nadat het ligand aan de cel-oppervlakte receptor bindt, zet de activering van de intracellulaire componenten van de receptor een keten van gebeurtenissen in gang die een signaaltransductieroute of een signaalcascade wordt genoemd. In een signaalroute activeren tweede boodschappers, enzymen en/of geactiveerde eiwitten andere eiwitten of boodschappers (figuur 9.11). Elk lid van de route kan duizenden van de volgende leden van de route activeren in een proces dat signaalversterking wordt genoemd. Aangezien het signaal bij elke stap wordt versterkt, kan een zeer grote respons worden opgewekt door een enkele receptor die een ligand bindt.
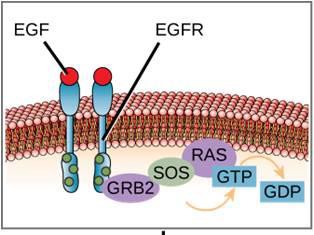
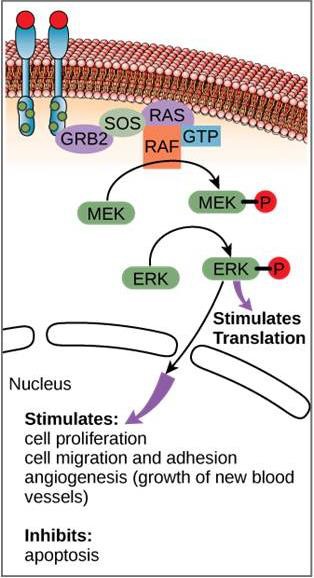
Een voorbeeld van een signaaltransductieroute is te zien in figuur 9.11. Epidermale groeifactor (EGF) is een signaalmolecuul dat betrokken is bij de regulering van celgroei, wondgenezing en weefselherstel. De receptor voor EGF (EGFR) is een tyrosinekinase. Een geactiveerd kinase fosforyleert en activeert vele stroomafwaartse moleculen. Wanneer EGF zich aan EGFR bindt, geeft een cascade van downstream fosforyleringsevents de cel het signaal om te groeien en zich te delen. Als EGFR op ongeschikte momenten wordt geactiveerd, kan ongecontroleerde celgroei (kanker) optreden.
In bepaalde kankersoorten is de GTPase-activiteit van het RAS G-eiwit geremd. Dit betekent dat het RAS-eiwit niet langer GTP kan hydrolyseren in GDP. Welk effect zou dit hebben op downstream cellulaire gebeurtenissen?
9.2.2 Methoden voor intracellulaire signalering
De inductie van een signaleringsroute is afhankelijk van de modificatie van een cellulaire component door een enzym. Er zijn talrijke enzymatische modificaties die kunnen optreden om de volgende component van de weg te activeren. Hieronder volgen enkele van de meest voorkomende gebeurtenissen in intracellulaire signalering.
Fosforylering
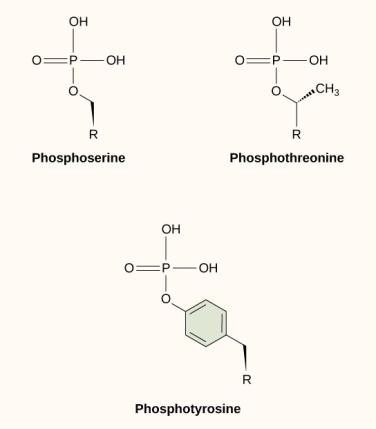
Een van de meest voorkomende chemische modificaties die optreedt in signaleringsroutes is de toevoeging van een fosfaatgroep aan een molecuul in een proces dat fosforylering wordt genoemd. Het fosfaat kan worden toegevoegd aan een nucleotide zoals GMP om GDP of GTP te vormen. Fosfaten worden ook vaak toegevoegd aan serine-, threonine- en tyrosineresiduen van eiwitten, waar ze de hydroxylgroep van het aminozuur vervangen (figuur 9.12). De overdracht van het fosfaat wordt gekatalyseerd door een enzym dat een kinase wordt genoemd. Fosforylering kan enzymen activeren of inactiveren, en het omkeren van fosforylering, defosforylering, zal het effect omkeren.
Secondemessengers
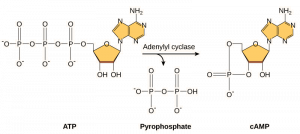
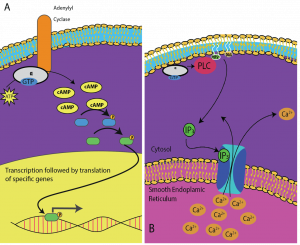
Secondemessengers zijn kleine moleculen die een signaal verspreiden nadat het in gang is gezet door de binding van de signaalmolecule aan de receptor. Deze moleculen helpen een signaal door het cytoplasma te verspreiden door het gedrag van bepaalde cellulaire eiwitten te veranderen. Een tweede boodschapper die door veel verschillende celtypes wordt gebruikt, is cyclisch AMP (cAMP). Cyclisch AMP wordt door het enzym adenylyl cyclase gesynthetiseerd uit ATP (figuur 9.13). De belangrijkste rol van cAMP in cellen is het binden aan en activeren van een enzym dat cAMP-afhankelijk kinase (A-kinase) wordt genoemd. A-kinase reguleert vele vitale metabolische routes: Het fosforyleert serine- en threonineresiduen van zijn doeleiwitten en activeert deze tijdens het proces. A-kinase wordt in veel verschillende celtypes aangetroffen, en de doeleiwitten in elk celtype zijn verschillend. Een andere secundaire boodschapper is Ca2+, dat kan vrijkomen om de cel te overspoelen.
Verschillende cellen reageren verschillend op cAMP. In afbeelding 9.14 is te zien hoe de alfa-subeenheid van een G-eiwitreceptor twee verschillende soorten signalen activeert. In de eerste afbeelding wordt cAMP geproduceerd door het enzym adenylaat cyclase wanneer dit geactiveerd wordt door de alfa-subeenheid. cAMP activeert vervolgens andere eiwitten die de gentranscriptie beïnvloeden. In de tweede afbeelding brengt de alfa-subeenheid van het G-eiwit een cascade op gang waarbij Ca2+ vrijkomt uit het gladde endoplasmatisch reticulum. In dit geval is Ca2+ de secundaire boodschapper die de cellulaire respons veroorzaakt.
9.3 | Reactie op het signaal
Aan het eind van dit hoofdstuk zult u in staat zijn:
- Herkennen dat signaaltransductieroutes eiwitexpressie, cellulair metabolisme en celgroei sturen.
- De rol van apoptose bij de ontwikkeling en instandhouding van een gezond organisme kunnen herkennen.
Met behulp van signaaltransductieroutes veroorzaken receptoren in het plasmamembraan een verscheidenheid aan effecten op de cel. Binnen de cel binden liganden aan hun interne receptoren, waardoor zij rechtstreeks invloed kunnen uitoefenen op het DNA en de eiwitproducerende machinerie van de cel. De resultaten van signaaltransductieroutes zijn zeer gevarieerd en hangen af van het betrokken celtype en de externe en interne omstandigheden. Een kleine greep uit de reacties wordt hieronder beschreven.
9.3.1 Reacties op de signaaltransductieroute
Gene Expressie
Sommige signaaltransductieroutes reguleren de transcriptie van RNA. Andere reguleren de translatie van eiwitten.
Toename van het celmetabolisme
De activering van β-adrenerge receptoren in spiercellen door adrenaline leidt tot een toename van cyclisch AMP in de cel. Adrenaline is een hormoon dat door de bijnier wordt geproduceerd en dat het lichaam voorbereidt op noodsituaties op korte termijn.
Celgroei
Celsignaleringswegen spelen ook een belangrijke rol bij de celdeling. Cellen delen zich normaal gesproken niet, tenzij ze worden gestimuleerd door signalen van andere cellen. De liganden die de celgroei bevorderen worden groeifactoren genoemd. De meeste groeifactoren binden zich aan receptoren op het celoppervlak die zijn gekoppeld aan tyrosinekinasen.
Celdood
Wanneer een cel beschadigd, overbodig of potentieel gevaarlijk is voor een organisme, kan een cel een mechanisme in gang zetten om geprogrammeerde celdood, of apoptose, in gang te zetten. Apoptose maakt het mogelijk een cel op een gecontroleerde manier te laten sterven, waarbij wordt voorkomen dat potentieel schadelijke moleculen uit het binnenste van de cel vrijkomen. In sommige gevallen, zoals bij een virale infectie of ongecontroleerde celdeling ten gevolge van kanker, falen de normale controles en tegenwichten van de cel. Signalen van buitenaf kunnen ook apoptose in gang zetten. De meeste normale dierlijke cellen hebben bijvoorbeeld receptoren die in wisselwerking staan met de extracellulaire matrix, een netwerk van glycoproteïnen dat een structurele steun biedt aan dierlijke cellen. De binding van cellulaire receptoren aan de extracellulaire matrix initieert een signaalcascade binnen de cel. Als de cel zich echter verwijdert van de extracellulaire matrix, houdt de signalering op en ondergaat de cel apoptose. Dit systeem helpt voorkomen dat cellen zich door het lichaam verplaatsen en zich ongecontroleerd gaan vermenigvuldigen, zoals gebeurt bij tumorcellen die uitzaaien.
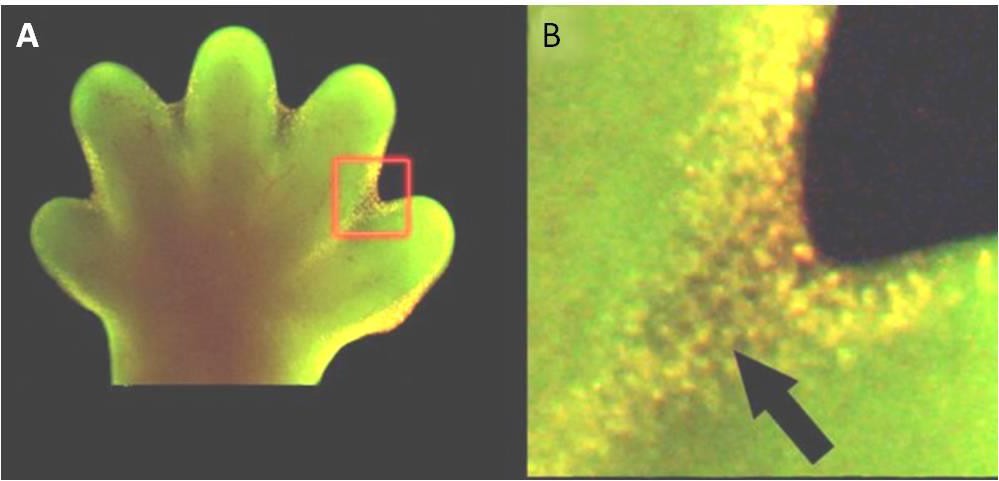
Apoptose is ook essentieel voor een normale embryologische ontwikkeling. Bij gewervelde dieren bijvoorbeeld wordt in een vroeg stadium van de ontwikkeling webachtig weefsel gevormd tussen de afzonderlijke vingers en tenen (figuur 9.15). In de loop van de normale ontwikkeling moeten deze onnodige cellen worden geëlimineerd, zodat zich volledig gescheiden vingers en tenen kunnen vormen. Een celsignaleringsmechanisme brengt apoptose op gang, waardoor de cellen tussen de zich ontwikkelende vingers en tenen worden vernietigd.
9.3.2 Beëindiging van signaalwegen
De afwijkende signalering die vaak in tumorcellen wordt gezien, bewijst dat de beëindiging van een signaal op het juiste moment net zo belangrijk kan zijn als de initiëring van een signaal. Eén methode om een specifiek signaal te stoppen is het ligand af te breken of te verwijderen, zodat het geen toegang meer heeft tot zijn receptor. Een van de redenen waarom hydrofobe hormonen zoals oestrogeen en testosteron langdurige gebeurtenissen teweegbrengen, is dat zij zich binden aan dragereiwitten. Deze eiwitten zorgen ervoor dat de onoplosbare moleculen oplosbaar zijn in het bloed, maar zij beschermen de hormonen ook tegen afbraak door circulerende enzymen.
In de cel keren veel verschillende enzymen de cellulaire modificaties om die het gevolg zijn van signaleringscascades. Zo zijn fosfatasen enzymen die de fosfaatgroep verwijderen die door kinasen aan eiwitten is bevestigd, in een proces dat defosforylering wordt genoemd. cAMP wordt door fosfodiësterase afgebroken tot AMP, waardoor het signaal ervan wordt beëindigd. Evenzo wordt het vrijkomen van calciumvoorraden ongedaan gemaakt door Ca2+-pompen die zich in celmembranen bevinden.