Guanosinetrifosfaat (Guanosine-5′-trifosfaat om precies te zijn of voor de eenvoud ook wel afgekort als GTP) is een hoogenergetisch nucleotide (niet te verwarren met nucleoside) dat in het cytoplasma wordt aangetroffen of wordt gepolymeriseerd tot de guaninebase.
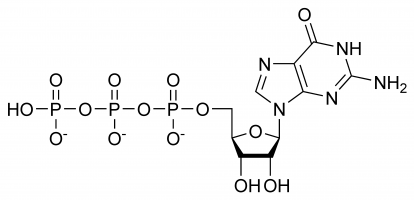
GTP speelt een selectieve rol bij de vorming van RNA-strengen, functioneert als energiedrager-molecuul voor eiwitsynthese, als co-enzym, als voorloper van cGMP – een secundair boodschapper-molecuul of als effector-molecuul. De laatste twee worden gewoonlijk aangetoond door modulatie van G-eiwitten. Dit alles is het resultaat van zijn complexe driedimensionale structuur en de verscheidenheid van verschillende chemische groepen waaruit het bestaat. Gemakshalve kan het daarom worden beschouwd als een mengsel van verschillende functionele groepen die elk afzonderlijk praktisch verschillende functies vervullen (hoewel de structuur er soms bij betrokken is, b.v. wanneer er een wisselwerking is met een enzym en een ander substraat) b.v. alleen het trifosfaat is betrokken bij het vrijmaken van energie voor polymerisatie, terwijl alleen de guanine-basis betrokken is bij de deaminatie ervan. Het is belangrijk op te merken dat de lijst die aan het begin is gegeven niet een exhuose geeft van de chemische interacties, maar slechts een demonstratie is van de verschillende mogelijkheden.
In GTP staat de ribose suiker centraal in de driedimensionale rangschikking van de covalent gebonden guanine en trifosfaat moleculen. Deze monosacharide levert hydroxylgroepen voor condensatiereacties en nucleofiele aanvallen, waarvan de laatste belangrijk is voor de vernietiging van RNA-moleculen en dus voor de regulering van de genexpressie. Het guaninemolecuul en het trifosfaat vormen covalente bindingen bij respectievelijk de atomen C’1 en C’5, maar het is ook mogelijk dat zij andere hydroxylgroepen gebruiken, zolang de resulterende structuur maar geen botsingen veroorzaakt. Vanuit het perspectief van het purine is het gebonden als gevolg van een condensatiereactie aan zijn 9’N, dat eerder covalent gebonden was aan een waterstofatoom. Aangezien guanine een purine base is, wordt het geclassificeerd als een purine trifosfaat samen met adenine trifosfaat (ATP) en wordt het gevormd door modificatie van inosine monofosfaat.
Inhoud
- 1 Misvatting: GTP, een basisbouwsteen
- 2 Een van de vele voorgangers van RNA-basen
- 3 GTP; een neef van het universele ATP
- 4 Een hulpbron voor signalering
- 5 Referenties
Misvatting: GTP, een basisbouwsteen
De lever is het belangrijkste orgaan voor de synthese van purine- en pyramidine-nucleotiden. Purinenucleotiden (GTP en ATP) worden gesynthetiseerd door eerst inosinemonofosfaat te maken uit ATP, glutamine, glycine, CO2, aspartaat en formiaat. IMP
kan vervolgens worden gewijzigd om een van de moleculen te verkrijgen.
In het geval van de vorming van GTP wordt IMP eerst door IMP-dehydrogenase omgezet in XMP. De resulterende chemische en structurele verandering maakt de werking van GTP-synthase mogelijk, dat XMP snel in GMP omzet. GMP is echter geen energierijke molecule omdat het geen trifosfaat bevat, zodat het vervolgens wordt gefosforyleerd door nucleosidefosfaatkinasen om eerst een difosfaat en uiteindelijk een trifosfaat te verkrijgen.
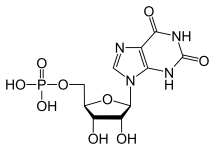
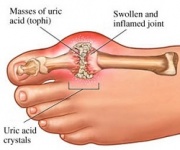
GTP wordt normaal gesproken gekataboliseerd tot onoplosbaar urinezuur dat vervolgens in de urine kan ontstaan als natriumuraatkristallen. Dit proces wordt als abnormaal beschouwd als het plaatsvindt in de synoviale gewrichten, waarbij urinezuur ontstaat dat vervolgens wordt omgezet in schadelijk mononatriumuraat of calciumpyrofosfaatdihydraat. De aanwezigheid van dergelijke chemische stoffen maakt de ontwikkeling van ontstekingen en artritis mogelijk en de gecombineerde symptomen leiden tot de classificatie van de ziekte als jicht. Een ander voorbeeld van het belang van een goed katabolisme van purinenucleotiden is de ernstige gecombineerde immunodeficiëntieziekte, die resulteert in de vernietiging van essentiële B- en T-lymfocyten
One Of Many RNA Base Predecesors
Er zijn verschillende verschillen tussen RNA en DNA, maar het primaire onderscheid zit in de structuur van de nucleobasen die elk polymeer opbouwen. RNA nucleobasen bevatten een 2’OH groep op hun ribose suiker, waardoor zij aanzienlijk chemisch reactiever, katalyserender en instabieler zijn. Het is belangrijk op te merken dat Guanosine trifosfaat alleen betrokken is bij de vorming van de guanine base in RNA. Het analoog van GTP voor de vorming van een guanine base in DNA is desoxyguanosine trifosfaat. Dit trifosfaat bevat een deoxyribose suiker zonder een
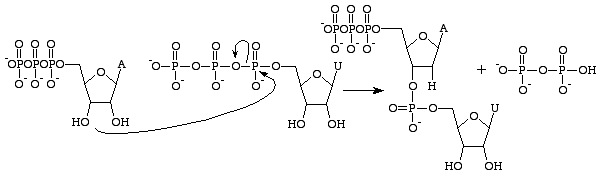
2’OH groep waardoor het aanzienlijk stabieler is – het voorkomt nucleofiele aanvallen die de fosfodiester bindingen tussen nucleobasen zouden kunnen splitsen. Dit is ideaal omdat RNA moet worden afgebroken nadat het in een eiwit is vertaald, terwijl DNA intact moet blijven voor de overdracht van genetische informatie naar de dochtercel.
Guanosinetrifosfaat zal resulteren in de vorming van een guaninebase als gevolg van de splitsing van een anhydridebinding en het vrijkomen van alfa- en gammafosfaten als vrije fosfaten. GMP zal dan een fosfodiesterbinding vormen met de nabije 3’OH-groep bevattende base, en een 3’OH-groep leveren voor de volgende RNA base. Deze reactie vindt alleen plaats als de tegenoverliggende base van GMP cytosine is, waarmee het waterstofbruggen kan vormen, en de snelheid ervan wordt verhoogd door RNA polymerase. RNA polymerase lijnt de trifosfaten niet uit. Het katalyseert slechts de reactie die daarna onafhankelijk plaatsvindt. Na de katalyse maakt het molecuul deel uit van een polynucleotideketen en wordt het niet langer GTP genoemd, maar de base guanine.
GTP; een neef van het universele ATP
Het onderliggende mechanisme van energieopwekking door splitsing van de anhydride-binding is in alle trifosfaten hetzelfde. De hoge energiestatus van trifosfaten wordt bereikt door drie verschillende mechanismen. Het eerste is te wijten aan de afstotende krachten
op elk van de fosfaatgroepen. Dit draagt bij tot een grote instabiliteit van de gebonden trifosfaten en een grote “wens” om een lagere energietoestand te bereiken. De tweede is te wijten aan resonantiestabilisatie. Wanneer GTP wordt
omgezet in GDP neemt het aantal mogelijke posities voor de bestaande elektronenparen toe, waardoor een grotere stabiliteit ontstaat. Dit argument wordt ook bevestigd bij omzetting van GDP in GMP. De derde reden is het ongunstige entropische effect dat een groter aantal fosfaten heeft op de conformatie van de watermoleculen die het molecuul omgeven.
Omdat de GTP-concentratie in het cytoplasma aanzienlijk lager is dan die van ATP, wordt het gebruikt voor specifieke functies in de celstofwisselingsprocessen.
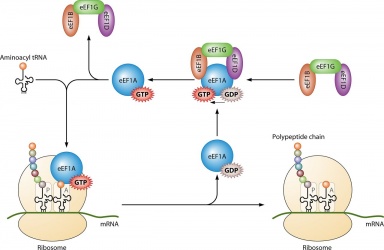
Het wordt voornamelijk gebruikt bij de eiwitsynthese wanneer het gekoppeld is aan IF2 tijdens ribosomale initiatie, Ef-Tu en Ef-G tijdenselongatie en ;RF3 tijdens terminatie. Alle GTP-moleculen die zich binden met de genoemde eiwitten worden gedefosforyleerd, wat resulteert in GDP en een vrij fosfaat
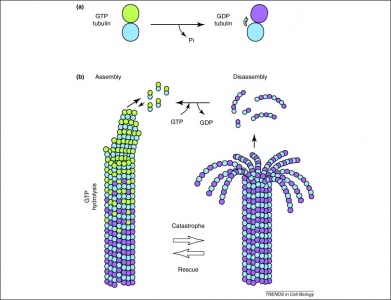
Bovendien wordt GTP ook gebruikt door tubulinedimeren bij hun vorming van microtubuli. Tubuline-dimeren bestaan uit alfa- en betatubuline, die elk GTP-bindingsplaatsen bezitten. Aangezien beta-tubuline zich aan het plus-einde van de vezel bevindt, wordt GTP hier altijd gehydrolyseerd wanneer een ander dimeer aan het polymeer wordt toegevoegd. Belangrijk is dat de hydrolyse van GTP de niet-covalente interacties tussen tubulinedimeren verzwakt, waardoor de microtubuli gemakkelijker kunnen worden opgelost als dat nodig is. Merk op dat het alfa-tubuline-eiwit GTP niet wordt gedefosforyleerd, zodat het kan worden beschouwd als consistent door de microtubulusstructuur.
Een hulpbron voor signalering
Het gebruik van de specifieke chemie en ruimtelijke conformatie van GTP wordt doeltreffend aangetoond door het gebruik ervan bij het overbrengen van signalen. Het is in de eerste plaats in staat om zich te binden en de activiteit te reguleren van verschillende eiwitten uit de signaleringsroute, die in twee verschillende groepen worden ingedeeld. De eerste groep zijn heterotrimere GTP-bindende proteïnen (ook bekend als heterotrimere G-proteïnen) die GTP gebruiken bij de activering van G-proteïne gekoppelde receptoren om de activiteit van andere proteïnen in de signaalroute te wijzigen. De tweede groep zijn monomere GTP-bindende proteïnen (ook wel monomere G-proteïnen genoemd). Deze reageren op andere receptoren dan G-eiwit gekoppelde receptoren. Een typisch voorbeeld dat tijdens hun uitleg werd aangehaald is het Ras-eiwit. Merk op dat zij in staat zijn GTP selectief te binden, niet alleen door de specifieke chemie ervan, maar ook door het geïnduceerde fit-fenomeen. Het gebonden GTP zal dan na een bepaalde tijd worden gehydrolyseerd en aldus resulteren in een auto-inactivatie van het eiwit en het voorkomen van overmatige stimulatie van een signaaltransductieroute. Nadat GTP is gehydrolyseerd zal het GDP gebonden blijven omdat de conformatieverandering zal resulteren in een verschuiving van de affiniteit naar het GTP-molecuul en het GDP-molecuul. Dit is echter een impernamentele verandering en kan worden omgekeerd door latere activering door de G-eiwit gekoppelde receptor.
GTP kan ook worden gebruikt als reactant om cGMP te produceren, wat een relatief vaak voorkomende secundaire signaalmolecule is. De katalyse wordt op gang gebracht door het vrijkomen van NO, dat guanylaatcyclase activeert, een enzym dat cGMP produceert uit GTP. cGMP kan vervolgens fungeren als een effector voor proteïnekinasen die de werking van specifieke proteïnen fosforyleren en wijzigen.
- J Koolman en KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell and P A Weil. Harper’s Illustrated Biochemie. 28e editie. Beijing, China. 2009.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1e Editie. Wokingham, Engeland. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1e Editie. Wokingham, Engeland. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1e Editie. Wokingham, Engeland. Addison-Wesley. 1996.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Duitsland. Thieme 2013.
- M W King. De Medische Biochemie Pagina. September 2016. Aangehaald: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell and P A Weil. Harper’s Illustrated Biochemie. 28e editie. Beijing, China. 2009.
- M W King. De Medische Biochemie Pagina. September 2016. Aangehaald: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. De Medische Biochemie Pagina. September 2016. Aangehaald: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. De Medische Biochemie Pagina. September 2016. Aangehaald: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. De Medische Biochemie Pagina. September 2016. Aangehaald: 11:31. 03.12.2016. Available from: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1e Editie. Wokingham, Engeland. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1e Editie. Wokingham, Engeland. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1e Editie. Wokingham, Engeland. Addison-Wesley. 1996.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemie. Achtste editie. Stad en Land Ongeïdentificeerd. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Achtste Editie. Stad en Land Ongeïdentificeerd. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Achtste Editie. Stad en Land Ongeïdentificeerd. Freeman and Co. 2015.
- T E Dever and R Green. De Elongatie, Terminatie en Recycling fasen in Eukaryoten. CSHPB. Juli 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. 6e editie. New York, VS. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6e Editie. New York, USA. Garland Science. 2015.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Duitsland. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Germany. Thieme 2013.