Introduction: Migraine Clinic
Migraine bestaat uit unilaterale hoofdpijn die gepaard gaat met een cluster van andere sensorische, autonome en cognitieve symptomen en het is geïdentificeerd door de global burden of disease (GBD) studie 2016 als de zesde meest voorkomende aandoening en een van de belangrijkste oorzaken van invaliditeit over de hele wereld, vaak voorkomend in de werkende leeftijd en bij jongvolwassen en vrouwen van middelbare leeftijd (Collaborators, 2018). Vandaar dat migraine een zeer ernstig maatschappelijk probleem vertegenwoordigt in termen van levensjaren die worden geleefd met een handicap (YLD’s) en de belangrijkste oorzaak van YLD’s binnen 15 tot 49 jaar (zie Steiner et al., 2018). De last van deze ziekte is tot voor kort niet in kaart gebracht omdat: migraine geen oorzaak is van blijvende invaliditeit of overlijden; hoofdpijn af en toe voorkomt in de algemene bevolking (Collaborators, 2018). Hoewel een definitieve pathogenese voor migraine niet bekend is, is de extracraniële circulatie betrokken (Drummond en Lance, 1983). Het klinisch beloop van migraine wordt verwoord in verschillende opeenvolgende of gelijktijdige stadia: premonitory, aura, hoofdpijn, en postdroom (vergelijkbaar met de premonitory fase) (Goadsby et al., 2017a). De premonitorische fase omvat prikkelbaarheid, verlangen naar voedsel, stijve nek en kan optreden van 2 tot 72 uur voorafgaand aan de aanval en loopt door over de andere fasen. Volgens de definities van de International Classification of Headache Disorders third edition (ICHD-3):
– aura wordt gekenmerkt door een of meer voorbijgaande, reversibele neurologische stoornissen, waarvan er ten minste één een unilaterale lokalisatie moet hebben, die zich gedurende 5 min of meer ontwikkelen en waarvan elke stoornis tussen 5 en 60 min duurt;
– migraine bestaat uit hoofdpijnaanvallen die 4-72 h duren en gepaard gaan met misselijkheid, fotofobie en fonofobie, of beide (zie Goadsby et al., 2017a).
Cutane allodynie, gedefinieerd als de perceptie van pijn na niet-pijnlijke stimuli, komt voor bij meer dan de 70% van de patiënten (Lambru et al., 2018). Ernstige hoofdpijn zwakt af tot stopt tijdens de postdroomfase, terwijl andere symptomen zoals asthenie, somnolentie en fotofobie de patiënt blijven beïnvloeden, waardoor de complexe neurale basis die ten grondslag ligt aan migraine wordt weergegeven (Lambru et al., 2018). Afhankelijk van de getroffen dagen per maand wordt migraine geclassificeerd als episodisch (minder dan 15 migraine- of hoofdpijndagen) of chronisch (ten minste 15 dagen, waaronder 8 of meer migrainedagen) (zie Goadsby et al., 2017b). Dit aspect beïnvloedt opmerkelijk de impact van de ziekte en de therapeutische opties (Giamberardino et al., 2017). Bij 1 tot 3 aanvallen per maand is het mogelijk om alleen abortieve symptomatische geneesmiddelen te gebruiken, terwijl bij 4 tot 14 aanvallen per maand het verplicht is om preventieve behandelingen toe te voegen; deze laatste behandelingen zijn nodig om chronificatie van de ziekte te voorkomen (Giamberardino en Martelletti, 2015; Giamberardino et al., 2017) en om het risico op medicatie-overgebruikshoofdpijn en refractaire migraine te verminderen (Martelletti, 2017).
Pathofysiologie van migraine en Calcitonine Gen-Related Peptide (CGRP)
De exacte oorzaak van migraineaanvallen is nog niet goed bekend, maar het huidige onderzoek heeft het belang van sensitisatieprocessen binnen het trigeminovasculaire systeem en de gehele hersenstam benadrukt, evenals de waarneming van verminderde grijze stof in pijnverwerkingsgebieden (zie Goadsby et al, 2017a). Vanuit het trigeminale ganglion met daarin het cellichaam synapteren pseudo-unipolaire primaire afferenten op de bloedvaten en op het trigeminocervicale complex van waaruit tweede-orde vezels synapteren op derde-orde thalamocorticale neuronen en op locus coeruleus, periaqueductaal grijs en hypothalamus (Goadsby et al., 2017a). De nociceptieve vezels van het trigeminus ganglion en de cervicale dorsale wortel ganglia innerveren de dura mater vaten en hun terminals geven vasoactieve neuropeptiden af zoals calcitonine gen-gerelateerd peptide (CGRP) die vasodilatatie induceren. Expressie van CGRP, CLR, en RAMP1 in menselijke dura vaten wordt getoond in Figuren 1A-C. Inderdaad, de autonome zenuwvezels die extracerebrale vasculatuur innerveren bevatten verschillende neurotransmitter vasoactieve moleculen: noradrenaline, serotonine, acetylcholine, neuropeptide Y (NPY), vasoactief intestinaal polypeptide (VIP), substance P (SP), neurokinine A (NU), en CGRP (Goadsby et al., 1990). De CGRP-receptorantagonisten blokkeren de nociceptieve informatie van de dura mater: zij wordt verwerkt in de thalamische kernen van waaruit zij de hogere corticale gebieden bereikt. Deze input van het trigeminovasculaire systeem wordt gemoduleerd door de descending pathway van de hersenstam: de 5-hydroxytryptamine (5HT)1B/1D receptor agonisten, d.w.z. triptanen, zouden via dit systeem werken en de opgetreden vasodilatatie tegengaan. Terwijl propranolol en topiramaat als preventieve behandeling dienen, worden deze laatste middelen gebruikt bij acute episoden van migraine. Naast hun vasoconstrictor werking remmen triptanen, die rechtstreeks inwerken op 5HT1B/D presynaptische receptoren, het vrijkomen van mediatoren zoals CGRP die betrokken zijn bij nociceptie. Bovendien is experimenteel aangetoond dat sumatriptan de inwaartse stroom remt die wordt gemedieerd door transient receptor potential vanilloid 1 (TRPV1) in de trigeminus ganglia (Evans et al., 2012). CGRP komt vrij tijdens migraineaanvallen en het vertoont verschillende rollen als het meest vasoactieve neuropeptide waarvan de craniovasculaire niveaus toenemen in het verloop van de aandoening (Goadsby et al., 1990). Er is aangetoond dat CGRP ook veranderingen ondergaat in cerebrospinale vloeistof (van Dongen et al., 2017). De triggers tot veranderde centrale exciteerbaarheid en de daaropvolgende doorbraak van migraine pijnepisoden zijn al lang onderzocht. De stimulatie van zenuwvezels kan zowel orthodromische als antidromische actiepotentialen bevorderen en in het bijzonder kan de activering van dural peptidergische primaire sensorische afferenten die het transient receptor potential (TRP) tot expressie brengen, het vrijkomen van verschillende moleculen induceren, waaronder CGRP die ontstekingsreacties in het weefsel teweegbrengen die bekend staan als neurogene ontsteking (Xanthos en Sandkuhler, 2014). In het bijzonder is CGRP betrokken bij craniale nociceptie en bij het epifenomeen van vasodilatatie die zijn receptoren op meningeale en cerebrale bloedvaten bindt (Deen et al., 2017). Deze processen bevorderen de sensibilisatie van de trigeminusvezels van de tweede orde die versterkte pijnprikkels naar hogere regio’s brengen, zoals de thalamus, de hypothalamus en de cortex, waardoor migraine ontstaat (Dussor et al., 2014). TRPs worden geactiveerd als reactie op verschillende irriterende omgevingsprikkels zoals temperatuur- en pH-schommelingen, die bij individuen met aanleg migrainepijn kunnen uitlokken. CGRP wordt geproduceerd door weefselspecifieke alternatieve splicing van het calcitoninegen CALC I op chromosoom 11, dat ook codeert voor calcitonine. β CGRP daarentegen wordt geproduceerd door het CALC II-gen, dat zich op een andere plaats van chromosoom 11 bevindt. α CGRP neuropeptide is in het centrale zenuwstelsel aanwezig als α-isovorm van 37 aminozuren en zijn signaaltransductie wordt door twee receptoren bemiddeld.
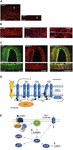
Figuur 1. Het voorkomen van CGRP en het pad bij migraine. Expressie van CGRP, CLR, en RAMP1 in menselijke duravaten: (A) CGRP-immunoreactiviteit wordt aangetroffen in dunne vezels in de adventitia; (B) dwars- en lengtedoorsneden tonen RAMP1-expressie in het cytoplasma van gladde spiercellen; (C) coexpressie van CLR en RAMP1 in de gladde spiercellaag. (D) CGRP receptor componenten en belangrijke residuen voor receptor signalering en internalisatie. De CGRP receptor wordt gevormd door CLR (blauw), RAMP1 (geel), en RCP (oranje). Functioneel belangrijke residuen worden weergegeven als afkortingen met één letter. Aminozuurresiduen zijn genummerd vanaf het begin van het voorspelde N-terminale signaalpeptide (Swiss-Prot Q16602). Verschillende aminozuren binnen de CLR C-terminus (∼N400-C436) en I312 bij de ICL3/TM5 junctie zijn nodig voor effectieve CGRP-gemedieerde internalisatie. Belangrijke kenmerken van de CGRP-receptor, waaronder de TM6 “knik” (P343) en de vermoedelijke achtste helix (∼G388-W399) in CLR zijn geïllustreerd. C′, C-terminaal; ECL, extracellulaire lus; ICL, intracellulaire lus; N′, N-terminaal; TM, transmembraan. (E) CGRP receptor-gemedieerde intracellulaire signalering: Gαs signalering verhoogt AC (groen) activiteit, verhoogt intracellulaire cAMP, activeert PKA en vervolgens vele potentiële downstream-effectoren. Panelen (A-C) zijn respectievelijk aangepast van Eftekhari et al. (2013) en paneel (D,E) van Walker et al. (2010), met toestemming.
De eerste is bekend als canonieke CGRP-receptor en is een Gαs-eiwit gekoppelde receptor die het receptor-activiteit-modificerende eiwit (RAMP) 1 nodig heeft om functioneel te zijn (Goadsby et al., 2017a). De tweede is de humane amyline subtype 1 receptor (AMY1): amyline behoort tot de calcitonine gen familie en het heeft hormonale activiteit. Wanneer CGRP aan zijn receptor bindt, ondergaat het een dynamin/clathrine-afhankelijke internalisatie nadat het met β-arrestine is gecomplexeerd (zie Walker et al., 2010). Er treden conformatieveranderingen op die leiden tot activering van adenylaatcyclase (AC), toename van cAMP en activering van proteïne kinase A (PKA) die vaatverwijding kan bevorderen door directe activering van endotheliaal stikstofoxide synthase en pijnreacties. Deze laatste receptor kan worden gekoppeld aan Gαq/11 met de activering van fosfolipase C (PLC), aan mitogeen-geactiveerd proteïne kinase (MAPK) en aan het vrijkomen van NO (zie Walker et al., 2010) (zie Figuren 1D,E voor schematische voorstelling van CGRP receptor-gemedieerde intracellulaire signalering). De toediening van CGRP aan migrainepatiënten lokt aanvallen uit en dit bewijs ondersteunt de centrale rol ervan in de pathogenese van migraine (Lassen et al., 2002). Een signaal-beëindigingssysteem is nog niet geïdentificeerd: CGRP wordt gemetaboliseerd door neprilysine, insuline-afbrekend enzym en endotheline-converterend enzym-1 en er is een heropname-actief transportsysteem gehypotheseerd (zie Russell et al., 2014). Bovendien wordt de receptor, wanneer hij tijdelijk geactiveerd wordt door CGRP, geïnternaliseerd in endosomen en snel terug gerecycleerd naar de celmembraan, terwijl chronische stimulatie van de receptor desensibilisatie en lysosomale degradatie induceert (zie Russell et al, 2014).
Pharmacologische interventies op de CGRP Pathway
Migraine is een veelzijdige invaliderende neurovasculaire aandoening en de huidige therapie met orale triptanen is effectief bij acute aanvallen, hoewel zo’n 40% van de patiënten resistent is tegen behandeling (Ferrari et al., 2001; Edvinsson, 2015). Deze selectieve 5-HT1B/1D agonisten, waarvan sumatriptan de meest gebruikte is, meestal werkzaam voor subcutane route, oefenen hun therapeutische werking uit door vasoconstrictie van de craniale vaten, en remming van het trigeminale en trigeminocervicale systeem (zie Ferrari et al., 2001). De vasoconstrictie vormt echter een grens voor de cardiovasculaire bijwerkingen van deze geneesmiddelen. Bovendien kan de behandeling met triptanen niet langer dan 9 dagen per maand duren wegens het risico van door het geneesmiddel veroorzaakte hoofdpijn. In 2010 werd botulinum toxine type A (BoNT-A) door de Food and Drug Administration (FDA) goedgekeurd voor de preventie van migraine bij niet-reagerende chronische migrainepatiënten en de complexe toediening ervan (het vereist injectie op 31 plaatsen) beperkt de therapietrouw van de patiënten. Gezien de cruciale rol van CGRP in de pathofysiologie van migraine, zijn antagonisten van zijn receptor ontwikkeld. Deze geneesmiddelen behoren tot de klasse van de gepantserde middelen. Telgecepant, het eerste orale gepant, werd goed verdragen door migrainepatiënten met coronaire hartziekte (ClinicalTrials.gov NCT00662818, Ho et al., 2012), maar het middel vertoonde hepatotoxiciteit. Ondanks voortdurend onderzoek naar deze kleine moleculen werd daarom een nieuwe aanpak voorgesteld, namelijk de ontwikkeling van monoklonale antilichamen (mAbs) tegen CGRP (nezumabs) of CGRP-receptor (numabs). Aangenomen wordt dat deze geneesmiddelen de werking van de circulerende CGRP-moleculen remmen om migraineaanvallen te voorkomen en aangezien zij door hun omvang de bloed-hersenbarrière (BBB) niet passeren, zouden de werkingsplaatsen zich in het trigeminale systeem moeten bevinden (Edvinsson, 2015). Met name de durale vaten vallen niet onder de BBB. Bovendien steekt CGRP waarschijnlijk de BBB niet over en werkt het als een paracriene modulator, aangezien het tot expressie wordt gebracht door de helft van de neuronen van het trigeminus ganglion die de CGRP-receptor niet presenteren, tot expressie gebracht door satelliet gliacellen en de 30% van de neuronale soma van het trigeminus ganglion (zie Yuan et al., 2017). Momenteel zijn er vier mAbs, eptinezumab, fremanezumab, galcanezumab en erenumab onderzocht in klinische studies voor episodische en chronische migraine. De eerste drie mAbs zijn gehumaniseerde antilichamen gericht tegen CGRP, terwijl erenumab een menselijk antilichaam is tegen de canonieke receptor. De halfwaardetijd van deze geneesmiddelen is vrij lang, zodat niet meer dan één toediening per maand mogelijk is en dit is van belang omdat mAbs intraveneus of subcutaan moeten worden toegediend. In het bijzonder wordt eptinezumab alleen intraveneus toegediend (Israel et al., 2018). De fase III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) trial (ClinicalTrials.gov NCT02559895) beoordeelde de effectiviteit van eptinezumab op preventie van frequente episodische migraine. De resultaten toonden een significante vermindering van het primaire eindpunt bestaande uit afname van maandelijkse migrainedagen (MMD’s) van een gemiddelde uitgangswaarde van 8,5 dagen over de weken 1-12 tot 4,3 MMD’s met de dosis van 300 mg, 3,9 met 100 mg, en 4,0 met 30 mg ten opzichte van 3,2 dagen placebo (Saper et al., 2018). Voor de evaluatie van eptinezumab in de preventie van chronische migraine zijn 1121 deelnemers ingeschreven in de PROMISE 2 (ClinicalTrials.gov NCT02974153). Galcanezumab werd beoordeeld op werkzaamheid bij de preventie van episodische migraine in de EVOLVE-1 fase 3 dubbelblinde, gerandomiseerde, placebogecontroleerde studie (ClinicalTrials.gov NCT02614183) ontleed in 4 perioden en in de EVOLVE-2 fase 3 gerandomiseerde, gecontroleerde, dubbelblinde klinische studie van 6 maanden (ClinicalTrials.gov NCT02614196). In de EVOLVE-1 voldeden beide doses galcanezumab (120 en 240 mg) aan de primaire uitkomst van significante vermindering van maandelijkse migraine-hoofdpijndagen van respectievelijk 4,7 dagen en 4,6 dagen, in vergelijking met de 2,8 dagen van de placebo (Stauffer et al., 2018). In de EVOLVE-2 kregen patiënten maandelijks een injectie van 120 of 240 mg galcanezumab. De gemiddelde maandelijkse migrainehoofdpijndagen werden verminderd met respectievelijk 4,3 en 4,2 dagen, vergeleken met 2,3 dagen vermindering verkregen met placebo (p < 0,001) (Skljarevski et al., 2018). Ook aan de secundaire eindpunten van vermindering van functionele beperkingen beoordeeld via de Role Function-Restrictive (R-FR) domeinscore van de Migraine-Specific Quality of Life Questionnaire (MSQ) en verbetering van de score van de Patient Global Impression of Severity (PGI-S) en van de Migraine Disability Assessment (MIDAS; tijdpunt = maand 6) werd voldaan (Skljarevski et al., 2018). 147 (65,0%) en 163 (71,5%) van de patiënten behandeld met galcanezumab, 120 en 240 mg, respectievelijk, en 287 (62,3%) met placebo presenteerden adverse events, waaronder acuut myocardinfarct en transient ischemic attack binnen een groep van zeven patiënten onder behandeling met galcanezumab 240 mg (Skljarevski et al., 2018). Er waren geen statistisch significante verschillen in gemiddelde verandering ten opzichte van de uitgangswaarde voor systolische/diastolische bloeddruk. De 19 (8,6%), 11 (5,1%), en 2 (0,5%) patiënten in respectievelijk de galcanezumab 120 mg, galcanezumab 240 mg, en placebogroep vertoonden behandelings-emergente antilichamen tegen geneesmiddelen (ADA). In de REGAIN fase III-studie waarin galcanezumab tegen chronische migraine werd geëvalueerd, werden MMD’s verminderd van 4,8 dagen met een dosis van 120 mg en van 4,6 dagen met een dosis van 240 mg, vergeleken met 2,7 van placebo (zie Yuan et al., 2017). Bovendien werd aangetoond dat de behandeling met galcanezumab werd begiftigd met statistisch significante persistentie van het effect (Forderreuther et al., 2018). Fremanezumab werd onderzocht in de fase III HALO-studie voor de preventieve behandeling van migraine (ClinicalTrials.gov NCT02638103). Het verminderde MMD’s van episodische migraine op 12 weken van 3,7 dagen bij 225 mg maandelijks gedurende 3 maanden en van 3,4 dagen bij 675 mg eenmaal per kwartaal doseringsschema, in vergelijking met de 2,2 dagen afname van placebo (zie Yuan et al., 2017). De effectiviteit van erenumab bij de preventie van episodische migraine werd onderzocht in de fase 3, gerandomiseerde, dubbelblinde, placebogecontroleerde studie ARISE (ClinicalTrials.gov NCT02483585). MMD’s werden verminderd met 70 mg maandelijks subcutaan erenumab van 2,9 dagen in vergelijking met 1,8 dagen placebo (p < 0,001) en het was effectief in de secundaire eindpunten van ten minste 50% vermindering van MMD’s en verandering in maandelijkse migraine-specifieke medicatiebehandelingsdagen (MSMD) (Dodick et al., 2018). Het aandeel patiënten dat bijwerkingen presenteerde was vergelijkbaar tussen de groep die werd behandeld met het mAb en de placebo; 4,3% testte positief voor anti-erenumab-bindende antilichamen tot en met week 12, van wie één tijdelijk positief was voor neutraliserende antilichamen, maar pas in week 4 (Dodick et al., 2018). Ook de fase III STRIVE klinische studie (ClinicalTrials.gov NCT02456740) beoordeelde de effectiviteit van erenumab voor de preventie van episodische migraine. Erenumab werd toegediend in een dosis van 70 of 140 mg per maand gedurende 6 maanden (Goadsby et al., 2017b). Het baseline gemiddelde aantal MMD’s was 8,3 en de 70 mg en 140 mg doses verminderden het van respectievelijk 3,2 en 3,7, vergeleken met 1,8 dagen placebo (met p < 0,001 voor elke dosis versus placebo) (Goadsby et al., 2017b). Ook gedurende de laatste 3 maanden van de behandeling voldeed elke dosis erenumab aan de secundaire eindpunten van ten minste 50% vermindering ten opzichte van de uitgangswaarde in het gemiddelde aantal migrainedagen per maand en vermindering ten opzichte van de uitgangswaarde in zowel de Migraine Physical Function Impact Diary (MPFID) everyday-activities (MPFID-EA) als physical-impairment (MPFID-PI) (Goadsby et al., 2017b). Bij de patiënten met anti-erenumab antilichamen testte er slechts één in de groep die behandeld werd met 70 mg positief voor neutraliserende antilichamen en het mAb werd over het algemeen goed verdragen in termen van creatininespiegels, levertoxiciteit, totaal aantal neutrofielen en elektrocardiografische functie (Goadsby et al., 2017b). Volgens de auteurs is een van de beperkingen van deze trial dat patiënten die geen therapeutische respons hadden laten zien op meer dan twee klassen migraine-preventieve geneesmiddelen werden uitgesloten (Goadsby et al., 2017b). Verder zijn er klinische studies die de effectiviteit van fremanezumab (NCT02945046 en NCT02964338) en galcanezumab (NCT 02397473 en NCT02438826) onderzoeken in de preventie van clusterhoofdpijn (zie Israel et al., 2018), dat is primaire hoofdpijn die wordt gekenmerkt door ernstige unilaterale pijn in het periorbitale gebied die gepaard gaat met tranen, conjunctivale roodheid, en rhinorroe (Vollesen et al., 2018). Inderdaad werd aangetoond dat continue intraveneuze infusie via een infuuspomp van 1,5 μg/min van CGRP gedurende 20 min (in 2 dagen gescheiden door ten minste 7 dagen) bij patiënten met episodische (actieve of remissiefase) of chronische clusterhoofdpijn clusterachtige aanvallen uitlokte bij patiënten in de actieve fase of met chronische clusterhoofdpijn, maar niet in de remissiefase (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). De belangrijkste PK-voordelen van mAbs worden vertegenwoordigd door een lange eliminatiehalfwaardetijd waardoor de noodzaak van dagelijkse dosering wordt beperkt en klaring door proteolyse. Vanwege de effecten van gepants op de lever en vanwege de vaatverwijdende eigenschappen van CGRP bestaan de meest gevreesde risico’s van de remming van CGRP-signalering uit de veronderstelde hepatotoxiciteit en cardiovasculaire theoretische risico’s (Yuan et al., 2017). De European Headache Federation (EHF) stelde richtlijnen op voor het gebruik van anti-CGRP mAbs waarbij de Grading of Recommendation, Assessment, Development and Evaluation (GRADE) methode werd toegepast en, wanneer dat niet mogelijk was, werd vertrouwd op het advies van een panel van deskundigen (Sacco et al., 2019).
Pharmacokinetics (PK)/Pharmacodynamics (PD) Relationship of Anti-Migraine mAbs
De ontwikkeling van mAbs vertegenwoordigde een volledig nieuwe benadering voor het remmen van de CGRP pathway. De belangrijkste PD-verbetering die wordt bereikt met mAbs in plaats van kleine moleculen, is dat het gemakkelijker is om de brede CGRP-receptor-ligand-bindingsplaats aan te pakken (Taylor, 2018). De belangrijkste PK-voordelen van mAbs worden vertegenwoordigd door een lange eliminatiehalfwaardetijd zonder noodzaak van dagelijkse dosering en klaring door proteolyse en de meest gevreesde risico’s van de remming van CGRP-signalering bestaan in de hypothesized hepato-toxiciteit, vanwege de effecten van gepants op de lever, en cardiovasculaire theoretische risico’s, vanwege de vaatverwijdende eigenschappen van CGRP. Na de reis van deze mAbs van hun productie tot het doelwit is de eerste hindernis die deze moleculen ontmoeten echter hun toediening, wegens hun geringe orale biologische beschikbaarheid. Daarom is een parenterale toedieningsroute vereist en, om de therapietrouw te bevorderen, moet de halfwaardetijd lang zijn (Taylor, 2018). Immunoglobulinen (Ig)G1, 2, of 4 zijn de mogelijkheden (Wang et al., 2008; Taylor, 2018). Afgezien van de oorsprong van het IgG kunnen eventuele kruisreactiviteit en individuele modificaties van het katabolisme de halfwaardetijd beïnvloeden (Bonilla, 2008; Taylor, 2018). De technologie die wordt gebruikt om mAbs te produceren, berust op het gebruik van hybridoma’s die bestaan uit cellen in continue deling die bepaalde klonen van één type antilichaam produceren, met geen of weinig variabiliteit (Taylor, 2018). Op basis van de oorsprong van de aminozuren waaruit het mAb is samengesteld, kan een onderscheid worden gemaakt tussen chimere (knaagdierimmunisatie; behoud van knaagdier Fragment antigeen-bindende regio Fab, maar introductie van menselijke Fragment kristalliseerbare regio Fc), gehumaniseerde (zumabs, met muis Complementariteit Bepalende Regio’s, CDR’s, geënt op menselijke Fab regio’s) en menselijke (introductie van de gehele sequentie van het menselijke antilichaamgen in de muis die gehumaniseerd wordt, zoals bijvoorbeeld de XenoMouse) mAbs (zie Taylor, 2018). De CDR’s beïnvloeden de passing op het doelwit. Van de 4 mAbs tegen migraine is alleen erenumab menselijk, terwijl de geënte CDR’s van muis zijn voor fremanezumab, konijn voor eptinezumab en waarschijnlijk muis voor galcanezumab (zie Taylor, 2018). In het bijzonder is het enige anti-CGRP-receptor mAb erenumab, dat een menselijke IgG2λ is, en de andere drie mAbs gericht tegen sites van CGRP zijn: eptinezumab, een genetisch gemanipuleerde gehumaniseerde IgG1k; fremanezumab, een gehumaniseerde IgG2k; galcanezumab, een gehumaniseerde IgG4 (Edvinsson et al., 2018). Erenumab (Tmax 3-14 dagen) vereist maandelijkse subcutane toediening, evenals fremanezumab (Tmax 3-20 dagen) en galcanezumab (Tmax 7-14 dagen) (Taylor, 2018). Daarentegen wordt eptinezumab (Tmax 4,8 h) eenmaal per 3 maanden intraveneus toegediend; het associeert sneller en dissocieert langzamer dan fremanezumab en galcanezumab. Aangezien mAbs eiwitten van grote omvang zijn, kunnen zij de BBB niet gemakkelijk passeren. Sommige CGRP-receptoren bevinden zich buiten de BBB, waardoor de werking van anti-CGRP mAbs mogelijk is (Edvinsson, 2018). Voor binding komt het antilichaam via pinocytose in vasculaire endotheelcellen terecht. Grote schijnbare distributievolumes zouden kunnen afhangen van het weefsel en de daarmee samenhangende capaciteit van binding van het mAb (Lobo et al., 2004; Taylor, 2018). Erenumab is de meest nieuwe benadering, aangezien het de enige is die zich richt op een fusie-eiwit van de extracellulaire domeinen van de menselijke G-eiwitgekoppelde receptor calcitoninereceptor-achtige receptor CALCRL (vereist in de receptoren voor CGRP en adrenomedulline) en RAMP1, met inbegrip van de CGRP-bindingszak (Edvinsson et al., 2018). Er is aangetoond dat het de binding van -CGRP aan de humane CGRP-receptor in humane neuroblastoomcellen (SK-N-MC) competitief remt met een Ki van 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab oefende een krachtig en volledig antagonisme uit van de door CGRP gestimuleerde cAMP-accumulatie met een IC50 van 2,3 ± 0,9 nM in functionele assays uitgevoerd in SK-N-MC (Shi et al., 2016). Bovendien resulteerde het 5000-voudig meer selectief voor CGRP-receptor waarbij geen agonist/antagonist effect op andere menselijke calcitonine familie receptoren waaronder adrenomedulline, calcitonine, en amyline receptoren tot de hoogste geteste concentratie van 10 μM (Shi et al., 2016). Fremanezumab zou zijn effect op verschillende vaten kunnen uitoefenen; het veroorzaakt namelijk concentratieafhankelijke remming van CGRP geïnduceerde vasodilatatie in voorgespannen humane cerebrale, meningeale en perifere abdominale slagaders (Ohlsson et al., 2018). Daarnaast kan CGRP ook inwerken op neuronen en gliacellen en op de glymfatische (lymfatische-achtige), waarbij de laatste betrokken is bij de expressie van aura (zie Messlinger, 2018). De waarschijnlijke afwezigheid van metabolisme door leverenzymen zou geneesmiddel-geneesmiddel interacties kunnen vermijden. Eliminatie vindt plaats door renale proteolyse van aminozuren. Hoewel klinische studies melden dat deze antilichamen over het algemeen goed worden verdragen, afgezien van de gemarkeerde pijn op de injectieplaats, is er bezorgdheid over hun immunogeniciteit door de productie van ADA (Taylor, 2018). Tijdens een dubbelblind, gerandomiseerd, placebogecontroleerd klinisch onderzoek (ClinicalTrials.gov NCT 01337596) waarin de behandeling met verschillende regimes van enkelvoudige en meervoudige doses galcanezumab werd geëvalueerd, presenteerden 11 van de behandelde patiënten (26%) lage titers (1:10 – 1:80) van behandelde emergente-ADA (bij 3 patiënten namen de reeds bestaande antilichamen in titer toe), zonder dosis-respons en gedetecteerde effecten op PK en PD (Monteith et al., 2017). De studie van immunogeniciteit is essentieel omdat de aanwezigheid van ADA de verwijdering van het geneesmiddel kan versnellen of, erger nog, eindorgaanschade kan bevorderen (Taylor, 2018). De belangrijkste kenmerken van anti-migraine mAbs zijn samengevat in tabel 1.

Tabel 1. Belangrijkste kenmerken van fremanezumab, eptinezumab, galcanezumab, en erenumab.
Conclusie
Migraine is een invaliderende en slopende neurovasculaire pijnlijke aandoening die meer dan 90% van de gevallen van terugkerende hoofdpijn vertegenwoordigt en waarnaar de neiging kan worden geërfd (MacGregor, 2017). Divalproex natrium, natriumvalproaat, topiramaat, metoprolol, propranolol en timolol hebben bewezen sterk, niveau A, bewijs voor preventie van migraine (American Academy of Neurology en American Headache Society, 2015). Echter, alle klassieke orale preventieve behandelingen waaronder tricyclische antidepressiva, bètablokkers, 5-HT2 antagonisten ergots en anti-epileptica zijn niet ontwikkeld voor migraine en leveren slechts tot de 45% van de migrainepatiënten 50% reductie in het aantal maandelijkse dagen met migrainepijn (D’Amico en Tepper, 2008), mede vanwege de lage therapietrouw vanwege de schaarse verdraagbaarheid. Medicatie persistentie en discontinuering werd onderzocht in een retrospectieve Amerikaanse claims analyse (Hepp et al., 2017) en de resultaten suggereren een lage persistentie aan het initieel gebruikte medicijn en een hoog bedrag aan discontinuering door 6 maanden onafhankelijk van de medicijnklasse. Vanwege de fundamentele rol van CGRP in het in stand houden van neuroinflammatie en centrale sensibilisatie in de route van het ganglion trigeminus en de hersenstam naar hogere regio’s die betrokken zijn bij de fysiopathologie van migraine, zijn er nieuwe mAbs tegen CGRP en zijn receptor ontwikkeld. De eerste kleine moleculen CGRP-antagonisten bleken levertoxiciteit te induceren, maar mAbs produceerden noch toxische metabolieten noch cardiovasculaire bijwerkingen vanwege de remming van vasodilatatie (zie Deen et al., 2017). Ook centrale bijwerkingen kwamen niet naar voren. De potentiële langetermijneffecten van het blokkeren van CGRP moeten nog worden bestudeerd, maar een fundamenteel voordeel van deze antilichamen vloeit voort uit hun lange halfwaardetijd die maandelijkse of minder frequente injecties mogelijk maakt, wat de therapietrouw en de daaropvolgende effectiviteit opmerkelijk kan verbeteren (Deen et al., 2017). Anti-CGRP mAbs zouden dus effectieve instrumenten kunnen zijn in het therapeutische arsenaal tegen niet-reagerende migraine; diepgaande monitoring van werkzaamheid en veiligheid (d.w.z. productie van toxische metabolieten, immunogeniciteit met ADA, neutraliserende antilichamen en weefselkruisreactiviteit en bijwerkingen) is echter verplicht (Taylor, 2018). In feite tonen bewijzen van oudere biotechproducten aan dat therapieën met anti-tumor necrose factor α (TNFα) mAbs onderhevig kunnen zijn aan secundair falen (in tegenstelling tot primaire non-responders) van de initiële therapeutische respons omdat deze geneesmiddelen de productie van antilichamen induceren die het mAb kunnen afbreken, maar ook de werking ervan kunnen neutraliseren voordat ze aan het doelwit binden (zie Prado et al., 2017). Immunogeniciteit kan worden beïnvloed door glycosylering, type mAb, aantal epitopen en onzuiverheden in de formulering (zie Prado et al., 2017). Bovendien zijn verschillende schijnbaar onverklaarbare ernstige bijwerkingen geassocieerd met immunogeniciteit van anti-TNFα. Er is gewezen op lokale en systemische overgevoeligheidsreacties, immunodeficiëntie met verhoogde gevoeligheid voor infecties, en immuuncomplexvorming die zelfs tot de dood kan leiden (zie Prado et al., 2017). Daarom kan het gebruik van therapeutische diagnostiek (theranostics) de kennis en het juiste beheer van deze farmacologische hulpmiddelen verbeteren (Bendtzen, 2013; Prado et al., 2017).
Author Contributions
MTC, LAM, PT, en GB bedachten de studie. DS verzamelde de proefresultaten, analyseerde de literatuur, en schreef het manuscript. AA, LR, en MN namen deel aan het literatuuronderzoek. Alle auteurs hebben het uiteindelijke manuscript gelezen en goedgekeurd.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
American Academy of Neurology and American Headache Society (2015). Bijlage a: samenvatting van evidence-based richtlijn voor clinici, update: farmacologische behandeling voor preventie van episodische migraine bij volwassenen. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Personalized medicine: theranostics (therapeutische diagnostiek) essentieel voor rationeel gebruik van tumor necrose factor-alfa antagonisten. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmacokinetiek van immunoglobuline toegediend via intraveneuze of subcutane weg. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Global, regional, and national burden of migraine and tension-type headache, 1990-2016: a systematic analysis for the global burden of disease study 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Profylaxe van migraine: algemene principes en acceptatie door patiënten. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Blokkeren van CGRP bij migrainepatiënten – een overzicht van voor- en nadelen. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: een fase 3 gerandomiseerde trial van erenumab voor episodische migraine. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Extracranial vascular changes and the source of pain in migraine headache. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., and Porreca, F. (2014). Targeting TRP channels for novel migraine therapeutics. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). CGRP receptor antagonisten en antilichamen tegen CGRP en zijn receptor bij de behandeling van migraine. Br. J. Clin. Farmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). De CGRP pathway in migraine als een levensvatbaar doelwit voor therapieën. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). CGRP als doelwit van nieuwe migraine therapieën – succesvolle vertaling van bench naar kliniek. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., and Edvinsson, L. (2013). Differentiatie van zenuwvezels die CGRP en CGRP-receptoren opslaan in het perifere trigeminovasculaire systeem. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., and Premkumar, L. S. (2012). Sumatriptan inhibeert TRPV1 kanalen in trigeminus neuronen. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., and Goadsby, P. J. (2001). Oral triptans (serotonine 5-HT(1B/1D) agonists) in acute migraine treatment: a meta-analysis of 53 trials. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Preventieve effecten van galcanezumab bij volwassen patiënten met episodische of chronische migraine zijn persistent: gegevens uit de fase 3, gerandomiseerde, dubbelblinde, placebogecontroleerde EVOLVE-1, EVOLVE-2, en REGAIN studies. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). Calcitonine gen-gerelateerde peptide receptor als een nieuw doelwit voor de behandeling van mensen met episodische migraine: huidig bewijs en veiligheidsprofiel van erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). Opkomende geneesmiddelen voor de behandeling van migraine. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). Pathofysiologie van migraine: een stoornis van de sensorische verwerking. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Een gecontroleerde trial van erenumab voor episodische migraine. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistentie en switchpatronen van orale migraine profylactische medicatie onder patiënten met chronische migraine: een retrospectieve claims analyse. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomized, controlled study of telcagepant in patients with migraine and coronary artery disease. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). CGRP monoklonale antilichamen voor de preventieve behandeling van migraine. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). Opkomende geneesmiddelen voor de behandeling van migraine: een update. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002). CGRP kan een oorzakelijke rol spelen bij migraine. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Antilichaam farmacokinetiek en farmacodynamiek. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migraine. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). De toepassing van CGRP(r) monoklonale antilichamen in het migrainespectrum: behoeften en prioriteiten. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). The big CGRP flood – sources, sinks and signalling sites in the trigeminovascular system. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Veiligheid, verdraagbaarheid, farmacokinetiek, en farmacodynamiek van het CGRP bindende monoklonale antilichaam LY2951742 (Galcanezumab) in gezonde vrijwilligers. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). Fremanezumab blokkeert CGRP geïnduceerde dilatatie in menselijke cerebrale, middelste meningeale en abdominale slagaders. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Biologische anti-TNF geneesmiddelen: immunogeniciteit onderliggend aan falen van behandeling en bijwerkingen. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Calcitonine gen-gerelateerd peptide: fysiologie en pathofysiologie. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primaire resultaten van PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) trial: een fase 3, gerandomiseerde, dubbelblinde, placebogecontroleerde studie om de werkzaamheid en veiligheid van eptinezumab te evalueren voor de preventie van frequente episodische migraine (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Farmacologische karakterisering van AMG 334, een krachtig en selectief humaan monoklonaal antilichaam tegen de calcitonine-gen-gerelateerde peptidereceptor. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). Werkzaamheid en veiligheid van galcanezumab voor de preventie van episodische migraine: resultaten van de EVOLVE-2 fase 3 gerandomiseerde gecontroleerde klinische studie. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). Evaluatie van galcanezumab voor de preventie van episodische migraine: de EVOLVE-1 gerandomiseerde klinische trial. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). Migraine is eerste oorzaak van arbeidsongeschiktheid bij jongeren onder de 50: gaan gezondheidspolitici nu opletten? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amyline, immunologie, en hoofdpijngeneeskunde. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migraine biomarkers in cerebrospinale vloeistof: een systematische review en meta-analyse. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Effect van infusie van calcitonine-gen-gerelateerd peptide op clusterhoofdpijnaanvallen: een gerandomiseerde klinische trial. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). Regulering van signaaltransductie door calcitonine gen-gerelateerde peptide receptoren. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Monoklonale antilichamen farmacokinetiek en farmacodynamiek. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogene neuroinflammatie: ontstekingsreacties in het CZS als reactie op neuronale activiteit. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). CGRP monoklonale antilichamen voor migraine: rationale en vooruitgang. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar