Mechanische complicaties van een acuut myocardinfarct (AMI) zijn ventrikelseptumdefect (VSD), papillaire spierruptuur of -dysfunctie, scheuren van de vrije hartwand, ventriculaire aneurysma’s, dynamische linker ventrikel (LV) outflow tract (OT) obstructie, en rechter ventrikel (RV) falen. Al deze aandoeningen kunnen mogelijk leiden tot LV-falen met cardiogene shock.
Een grondig begrip van de mechanische complicaties van AMI en hun risicofactoren kan clinici helpen een vroege diagnose te stellen. Voor gunstige uitkomsten voor de patiënt zijn een snelle diagnose met passende medische therapie en tijdige chirurgische interventie vereist. Belangrijke factoren voor sterfte in het ziekenhuis door mechanische complicaties van MI zijn hoge leeftijd, cardiogene shock, en cardiorespiratoir falen.
Ventriculaire vrije wand ruptuur
VFWR is de meest ernstige complicatie van AMI. VFWR wordt gewoonlijk geassocieerd met grote transmurale infarcten en antecedente infarctuitbreiding. Het is de meest voorkomende doodsoorzaak, de tweede na LV-falen, en is verantwoordelijk voor 15-30% van de sterfgevallen in verband met AMI. VFWR is ontegenzeggelijk de meest catastrofale van de mechanische complicaties en leidt tot acuut hemopericardium en dood door harttamponade.
De totale incidentie van VFWR varieert van 0,8-6,2%. De incidentie van deze complicatie is in de loop der jaren afgenomen door een betere 24-uurs controle van de systolische bloeddruk; een toegenomen gebruik van reperfusietherapie, bètablokkers en ACE-remmers; en een verminderd gebruik van heparine.
Gegevens van de National Registry of Myocardial Infarction (NRMI) toonden een hogere incidentie van sterfte in het ziekenhuis onder patiënten die een trombolytische therapie kregen (12,1%) dan onder patiënten die dat niet kregen (6,1%). In het TIMI II-onderzoek (Thrombolysis in Myocardial Infarction Phase II) overleed 16% van de patiënten binnen 18 uur na de behandeling aan een hartruptuur. Bij patiënten die percutane transluminale coronaire angioplastiek (PTCA) ondergingen, was de incidentie van scheuren in de vrije wand lager dan bij patiënten die trombolytische therapie kregen.
Risicofactoren voor VFWR zijn onder meer een hoge leeftijd van meer dan 70 jaar, vrouwelijk geslacht, geen eerdere MI’s, Q-golven op het ECG, hypertensie tijdens de initiële fase van STEMI, gebruik van corticosteroïden of NSAID’s, en fibrinolytische therapie meer dan 14 uur na het begin van STEMI. Patiënten met een voorgeschiedenis van angina pectoris, eerdere AMI, multivessel coronaire ziekte, en chronisch hartfalen hebben minder kans dan anderen om VFWR van de LV te ontwikkelen omdat zij collateralen en ischemische preconditionering ontwikkelen.
Clinische presentatie van VFWR
VFWRs zijn dramatisch; zij presenteren zich acuut of soms subacuut als pseudoaneurysma’s; en zij betreffen meestal de anterieure of laterale wand van de LV. De meeste VFWR’s treden op binnen de eerste week na AMI.
Becker et al classificeerden de volgende 3 types van VFWRs :
-
Type I – een abrupte spleetvormige scheur die vaak geassocieerd is met anterieure infarcten en die vroeg optreedt (binnen 24 uur)
-
Type II – een erosie van geïnfarcteerd myocard op de grens tussen geïnfarcteerd en levensvatbaar myocard
-
Type III – een vroege aneurysmavorming die gecorreleerd is met oudere en sterk uitgebreide infarcten
Type III treedt gewoonlijk later op dan scheuringen van type I of type II. Trombolytische therapie versnelt het optreden van een hartruptuur bij VFWR’s van Becker type I en type II. Bij ernstig uitgebreide infarcten (type III) vermindert trombolytische therapie de incidentie van hartruptuur.
Een pseudoaneurysma wordt gevormd wanneer aangrenzend pericardium en hematoom een myocardiale ruptuur of perforatie afsluiten. De wand van een pseudoaneurysma wordt meestal gevisualiseerd als een aneurysmatische uitstulping die via een smalle hals met de LV-holte in verbinding staat. Deze wand bestaat uit pericardium en georganiseerde trombus en/of hematoom. Hij is verstoken van myocardiale elementen, terwijl een echt aneurysma alle elementen van de oorspronkelijke myocardiale wand heeft en een relatief brede basis. Het pseudoaneurysma kan variëren in grootte en heeft een hoog risico op scheuren.
Clinische presentaties van VFWR variëren afhankelijk van de acuiteit, de plaats en de grootte van de ruptuur. Patiënten met acute VFWR presenteren zich met ernstige pijn op de borst, abrupte elektromechanische dissociatie of asystole, hemodynamische collaps en mogelijk overlijden. Bij ongeveer een derde van de patiënten is het verloop subacuut, en presenteren zij zich met symptomen zoals syncope, hypotensie, shock, aritmie, en langdurige en terugkerende pijn op de borst.
Diagnose van VFWR
Een vroege diagnose van VFWR’s en interventie zijn van cruciaal belang voor de overleving van de patiënt. Een hoge verdenkingsindex is vereist wanneer patiënten met AMI zich presenteren met ernstige pijn op de borst, shock of aritmieën, en abrupte ontwikkeling van elektromechanische dissociatie. ECG-tekenen van dreigende VFWR hebben een beperkte specificiteit, maar omvatten sinustachycardie, intraventriculaire geleidingsstoornissen en aanhoudende of terugkerende ST-segmentelevatie.
Echocardiografie is het diagnostische hulpmiddel bij uitstek. De belangrijkste diagnostische bevinding is een matig tot grote pericardiale effusie met klinische en echocardiografische tekenen van een dreigende pericardiale tamponade. Bij patiënten met harttamponade en elektromechanische dissociatie verhoogt een matige tot ernstige pericardiale effusie het mortaliteitsrisico. Patiënten zonder initiële cardiale tamponade hebben weliswaar een lager sterfterisico, maar moeten toch worden gevolgd, aangezien een late ruptuur nog steeds kan optreden. De afwezigheid van pericardiale effusie op echocardiografie heeft een hoge negatieve voorspellende waarde. Als de mogelijkheid om transthoracale echocardiogrammen te verkrijgen beperkt is bij patiënten die mechanische beademing krijgen, kan transesofageale echocardiografie helpen bij het bevestigen van VFWR.
MRI biedt een superieure beeldkwaliteit en maakt het mogelijk om de plaats en de anatomie van een ventriculair pseudoaneurysma te identificeren (d.w.z. een gescheurd LV dat door het pericard wordt tegengehouden met ingesloten stolsel). MRI is echter van beperkt nut in de acute setting vanwege de tijd die ermee gemoeid is en de niet-draagbaarheid van beeldvormingseenheden.
Behandeling van VFWR
De belangrijkste preventiestrategie is vroege reperfusietherapie, waarbij percutane coronaire interventie (PCI) de voorkeursmodaliteit is. Fibrinolytische therapie wordt geassocieerd met een algemeen verminderd risico van VFWR; het gebruik ervan meer dan 14 uur na het begin van STEMI kan echter het risico van vroegtijdige ruptuur verhogen.
De standaardbehandeling voor VFWR is chirurgische noodreparatie nadat hemodynamische stabiliteit is bereikt. Patiënten kunnen eerst intraveneuze vloeistoffen, inotrope middelen en noodpericardiocentese nodig hebben.
Pifarré en consorten bevelen de inzet van een intra-aortale ballonpomp aan om de systolische afterload te verminderen en de diastolische myocardiale perfusie te verbeteren.
Er zijn verschillende chirurgische technieken toegepast, waaronder infarctectomie, het hechten met biologische lijmpatches gemaakt van polyethyleentereftalaat polyestervezel (Dacron; DuPont, Wilmington, DE) of polytetrafluorethyleen fluorpolymeerhars (Teflon; DuPont); en het gebruik van pledgeted hechtingen zonder infarctectomie.
Het sterftecijfer is aanzienlijk hoog en hangt grotendeels af van de preoperatieve hemodynamische status van de patiënt. Vroege diagnose, snelle instelling van de hierboven beschreven maatregelen om hemodynamische stabiliteit te bereiken, en snelle chirurgische reparatie kunnen de overlevingskansen verbeteren. Een follow-up van het gerandomiseerde Acorn-onderzoek toonde aan dat de structuur en functie van de linkerventrikel na mitralisklepchirurgie op de lange termijn, tot wel 5 jaar lang, verbeterden. Deze gegevens leveren bewijs dat mitralisklepreparatie in combinatie met het Acorn CorCap-apparaat ondersteunt voor patiënten met niet-ischemisch hartfalen met ernstige linkerventrikeldisfunctie die medisch zijn geoptimaliseerd, maar symptomatisch blijven met aanzienlijke mitralisklepregurgitatie.
Ventriculaire septumruptuur
VSR is een infrequente maar levensbedreigende complicatie van AMI. Ondanks optimale medische en chirurgische behandeling hebben patiënten met VSR een hoog sterftecijfer in het ziekenhuis. In het pre-trombolytische tijdperk kwamen VSR’s voor bij 1-3% van de personen met een MI. De incidentie daalde met trombolytische therapie (tot 0,2-0,34%) als gevolg van verbeteringen in de reperfusie en myocardiale salvage. De bimodale verdeling van VSR wordt gekenmerkt door een hoge incidentie in de eerste 24 uur, met een andere piek op dagen 3-5 en zelden meer dan 2 weken na AMI.
Bij patiënten die trombolytica kregen, was de mediane tijd vanaf het begin van de symptomen van AMI tot septale breuk 1 dag in de Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) trial en 16 uur in de Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK) proef.
Risicofactoren voor septale breuk zijn hoge leeftijd (>65 jaar), vrouwelijk geslacht, single-vessel ziekte, uitgebreid MI, en slechte septale collaterale circulatie. Vóór de komst van trombolytica, waren hypertensie en afwezigheid van angina in de voorgeschiedenis risicofactoren voor VSR. De grootte van het infarct en de betrokkenheid van het RV zijn andere bekende risicofactoren voor scheuring van het septum.
Bij patiënten met AMI zonder reperfusie ontwikkelt zich binnen 3-5 dagen na het infarct stollingsnecrose. Neutrofielen migreren naar de necrotische zone en ondergaan apoptose, geven lytische enzymen af en versnellen de desintegratie van necrotisch myocardium. Sommige patiënten hebben infarcten met grote intramurale hematomen, die in het weefsel dissecteren en resulteren in een vroege septale breuk. De grootte van de septale breuk varieert van enkele millimeters tot enkele centimeters.
VSR wordt gecategoriseerd als eenvoudig of complex, afhankelijk van de lengte, het verloop en de plaats. Bij een eenvoudige septale breuk bevindt de perforatie zich aan beide zijden van het septum op hetzelfde niveau en is er een directe door-en-door communicatie over het septum. Een complexe septale breuk wordt gekenmerkt door een uitgebreide bloeding met onregelmatige, serpineuze kanalen in het necrotische weefsel.
Septale breuken komen het meest voor bij patiënten met grote anterieure MI’s als gevolg van occlusie van de LAD slagader die uitgebreide septale infarcten veroorzaakt. Deze infarcten worden geassocieerd met ST-segmentverhogingen en Q-golven in de inferieure afleidingen (II, III, aVF) en deze ECG-veranderingen worden daarom vaker gezien bij septale breuken. Deze rupturen zijn over het algemeen apicaal en eenvoudig.
Septale rupturen bij patiënten met inferieure MI komen relatief weinig voor. Deze scheuren betreffen het basale inferoposterior septum en zijn vaak complex.
Clinische presentatie van VSR
Symptomen van VSR die AMI compliceren zijn pijn op de borst, kortademigheid, hypotensie, biventriculair falen, en shock binnen enkele uren tot dagen. Patiënten presenteren zich vaak met een nieuw, luid en hard holosystolisch geruis. Dit geruis is het luidst langs de onderste linker sternale grens en gaat gepaard met een palpabele parasternale systolische sensatie. RV en LV S3 galoppades komen vaak voor.
In patienten met cardiogene shock als gevolg van een septale breuk, kunnen het murmur en de sensatie moeilijk te identificeren zijn. Daarentegen hebben patiënten met acute MR vaak een zacht systolisch geruis bij de apex zonder een sensatie.
Diagnose van VSR
Echocardiografie met kleuren flow Doppler beeldvorming is het diagnostische instrument bij uitstek voor het identificeren van een VSR. (Zie de afbeelding hieronder.) De gevoeligheid en specificiteit zijn gerapporteerd oplopend tot 100%. Bovendien kan het worden gebruikt voor het volgende:
-
de plaats en de grootte van de septale breuk bepalen
-
de LV en RV functie
-
Schatting van de RV systolische druk
-
Kwantificeer de links-rechts-links shunt
Een hartkatheterisatie is meestal nodig om de diagnose te bevestigen, de mate van shunt van links naar rechts te kwantificeren, VSR te onderscheiden van andere aandoeningen (bijv. mitralisklepinsufficiëntie), en de kransslagaders in beeld te brengen.
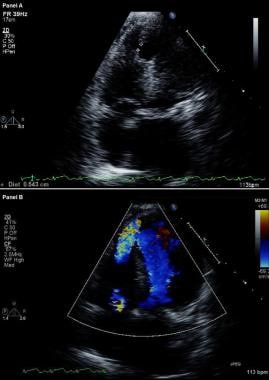 Complications of Myocardial Infarction. Gemodificeerd tweedimensionaal (boven) echocardiogram en kleuren-flow Doppler beeld (onder). Apicale vier-kamer-aanzichten tonen een breuk in het interventriculaire septum en vrije communicatie tussen de ventrikels door een groot apicaal septum ventriculair septaal defect bij een patiënt die onlangs een anterieur myocardinfarct had.
Complications of Myocardial Infarction. Gemodificeerd tweedimensionaal (boven) echocardiogram en kleuren-flow Doppler beeld (onder). Apicale vier-kamer-aanzichten tonen een breuk in het interventriculaire septum en vrije communicatie tussen de ventrikels door een groot apicaal septum ventriculair septaal defect bij een patiënt die onlangs een anterieur myocardinfarct had. Bij patiënten met VSR is bij rechterhartkatheterisatie een step-up in zuurstofverzadiging te zien van de rechterboezem naar de RV; bij patiënten met MR treedt daarentegen geen step-up in zuurstofverzadiging op. De aanwezigheid van grote V-golven in de pulmonale capillaire wig tracing ondersteunt de diagnose van ernstige acute MR.
Linker ventriculografie kan ook worden gebruikt om de plaats van de ventriculaire ruptuur vast te stellen (zie Hartkatheterisatie ). Dit onderzoek is echter meestal overbodig nadat een echocardiografisch en Doppler-onderzoek van goede kwaliteit is uitgevoerd.
Behandeling van VSR
De sleutel tot de behandeling van VSR is een snelle diagnose en een agressieve benadering van hemodynamische stabilisatie, angiografie en chirurgie. De optimale aanpak omvat hemodynamische stabilisatie met toediening van zuurstof en mechanische ondersteuning met gebruik van een intra-aortale ballonpomp, alsmede toediening van vaatverwijders (om de afterload en daarmee de LV-druk en de shunt van links naar rechts te verminderen), diuretica en inotrope middelen.
Cardiale katheterisatie is nodig om de coronaire anatomie te bepalen; dit wordt gevolgd door dringende chirurgische reparatie.
In een studie van 52 opeenvolgende patiënten met een ventrikelseptumruptuur na een infarct die chirurgisch werd gerepareerd, stelden onderzoekers vast dat het sterftecijfer na 30 dagen 36% bedroeg (n = 19). De meeste patiënten die minder dan 30 dagen overleefden, hadden een preoperatieve shockstatus. De onderzoekers concluderen dat voor patiënten met een ventrikelseptumruptuur preoperatieve verbetering van de shockstatus en agressieve coronaire revascularisatie noodzakelijk zijn.
Medische therapie is alleen bedoeld voor tijdelijke stabilisatie vóór de operatie, omdat de toestand van de meeste patiënten snel verslechtert en ze sterven als chirurgische interventie uitblijft. In het GUSTO-I-onderzoek was het sterftecijfer over 30 dagen lager bij patiënten met VSR die een chirurgische ingreep ondergingen dan bij patiënten die medisch werden behandeld (47% tegen 94%), evenals het sterftecijfer over 1 jaar (53% tegen 97%). Lemery et al meldden een 30-dagen overleving van 24% bij patiënten die medisch werden behandeld, vergeleken met 47% bij degenen die chirurgisch werden behandeld.
Richtlijnen van het American College of Cardiology/American Heart Association (ACC/AHA) voor de behandeling van patiënten met een septale breuk als complicatie van AMI benadrukken urgente chirurgische interventie, ongeacht hun klinische status. Chirurgisch beheer van septale ruptuur omvat de volgende elementen:
-
Prompt opzetten van hypothermische cardiopulmonaire bypass
-
Een benadering van de septale breuk door het infarctgebied en de excisie van alle necrotische, brokkelige randen van het septum en de ventrikelwanden om postoperatieve bloedingen, resterend septaal defect te vermijden, of beide
-
Reconstructie van het septum en de ventrikelwanden met behulp van prothetisch materiaal en behoud van de geometrische configuratie van de ventrikels en de hartfunctie
Percutane sluiting van een septumruptuur is een relatief nieuwe benadering, die wordt gebruikt bij geselecteerde patiënten als een alternatief voor chirurgische reparatie of voor de acute stabilisatie van ernstig zieke patiënten. Percutane sluiting is momenteel echter in veel instellingen niet beschikbaar, en er zijn geen gegevens beschikbaar over de resultaten op lange termijn.
Er zijn verschillende studies die geen verband aantoonden tussen perioperatieve mortaliteit en gelijktijdige coronaire revascularisatie (coronaire bypass grafting). Patiënten met cardiogene shock als gevolg van een septale breuk hebben de slechtste uitkomst. In de SHOCK-trial was het sterftecijfer in het ziekenhuis hoger bij patiënten met cardiogene shock ten gevolge van een scheur in het septum (87,3%) dan bij patiënten met cardiogene shock ten gevolge van alle andere oorzaken (59,2% met zuiver LV-falen en 55,1% met acute MR).
Bij patiënten die chirurgische reparatie overleven, is het percentage recidief of resterend septaal defect gemeld op ongeveer 28%, en het bijbehorende sterftecijfer is hoog.
Herhaalde chirurgische interventie is geïndiceerd bij patiënten met klinisch hartfalen of een pulmonaal-systemische fractie van meer dan 2.
Acute mitralis regurgitatie
MR is een veel voorkomende complicatie van AMI die het gevolg is van lokale en globale LV-remodellering en die een onafhankelijke voorspeller is van hartfalen en overlijden. MR treedt typisch op 7-10 dagen na een AMI, hoewel dit begin kan variëren naargelang het mechanisme van MR. Een ruptuur van de papillaire spier die tot MR leidt, treedt binnen 1-14 dagen op (mediaan, 1 d).
Milde tot matige MR is vaak klinisch geruisloos en wordt gedetecteerd op Doppler-echocardiografie die in de vroege fase van AMI wordt uitgevoerd. In dergelijke gevallen veroorzaakt MR zelden hemodynamische compromissen.
Speckle tracking en 3-dimensionale echocardiografie bleken belangrijke beeldvormingsinstrumenten te zijn bij de beoordeling van omgekeerde LV remodeling na degeneratieve mitralisklep regurgitatie chirurgie. Subtiele regionale preoperatieve veranderingen in de diastolische functie van de septale en laterale wand konden preoperatief worden geïdentificeerd, wat hielp bij het optimaliseren van de verwijzing timing en het herkennen van potentiële boosdoeners als indicatoren van ziekteherval na mitralisklep reparatie.
Een ernstige acute MR die het gevolg is van het scheuren van papillaire spieren of chordae tendineae resulteert in een abrupte hemodynamische verslechtering met cardiogene shock. Een snelle diagnose, hemodynamische stabilisatie en snelle chirurgische interventie zijn noodzakelijk omdat acute ernstige MR gepaard gaat met een hoog sterftecijfer.
De gerapporteerde incidentie van MR kan variëren vanwege verschillende factoren, waaronder de gebruikte diagnostische methoden, de aan- of afwezigheid van hartfalen, de mate van MR die wordt gerapporteerd, het type therapie dat wordt gegeven, en de tijd tussen het begin van het infarct en de test.
Tijdens het GUSTO-I-onderzoek was de incidentie van MR bij patiënten die trombolytische therapie kregen 1,73%. In het SHOCK-onderzoek, dat MI-patiënten omvatte die zich met cardiogene shock presenteerden, werd een incidentie van 39,1% matige tot ernstige MR vastgesteld. Kinn et al meldden dat reperfusie met angioplastie resulteerde in een daling van 82% van het percentage acute MR, vergeleken met trombolytische therapie (0,31% vs 1,73%).
Risicofactoren voor MR zijn gevorderde leeftijd, vrouwelijk geslacht, groot infarct, eerdere AMI, recidiverende ischemie, multivessel coronaire hartziekte, en hartfalen.
Verschillende mechanismen kunnen MR veroorzaken na AMI. Ruptuur van de papillaire spier is het meest gemelde mechanisme.
Een dergelijke ruptuur treedt op bij 1% van de patiënten met AMI en betreft vaak de posteromediale papillaire spier in plaats van de anterolaterale papillaire spier, aangezien de eerstgenoemde een enkele bloedtoevoer heeft in tegenstelling tot de dubbele toevoer van de laatstgenoemde. Een scheuring van de papillaire spier kan leiden tot een verslapping of prolaps van de folders, hetgeen ernstige MR tot gevolg heeft. Een disfunctie van de papillaire spier als gevolg van littekenvorming of recidiverende ischemie kan eveneens leiden tot MR in de subacute en chronische fasen na het MI; deze aandoening kan spontaan verdwijnen.
Grote posterieure infarcten veroorzaken acute MR als gevolg van asymmetrische annulaire dilatatie en veranderde functie en geometrie van de papillaire spier.
Clinische presentatie van MR
Patiënten met functionele milde of matige MR zijn vaak asymptomatisch. De ernst van de symptomen varieert afhankelijk van de ventrikelfunctie. Klinische kenmerken van acute ernstige MR zijn kortademigheid, vermoeidheid, een nieuw apicaal holosystolisch geruis, flash longoedeem en shock.
Het nieuwe systolische geruis kan alleen vroeg- tot middensynstolisch zijn, niet holosystolisch. Het kan zacht zijn of zelfs afwezig door de abrupte stijging van de linker atrium druk, die de drukgradiënt tussen het linker atrium en de LV vermindert, in vergelijking met chronische MR. Het geruis is het best te horen aan de apex en niet aan de onderste linker sternale rand, en het gaat zelden gepaard met een sensatie. S3 en S4 gallops worden verwacht.
Diagnose van MR
De clinicus kan niet vertrouwen op een nieuw holosystolisch murmuur om MR te diagnosticeren of de ernst ervan te beoordelen vanwege de variabele hemodynamische status. Bij een patiënt met AMI die zich presenteert met een nieuw apicaal systolisch geruis, acuut longoedeem, en cardiogene shock, is een hoge index van klinische verdenking voor ernstige MR de sleutel tot diagnose.
Chest radiografie kan in de acute setting aanwijzingen voor longoedeem laten zien zonder klinisch significante hartvergroting.
Echocardiografie met color flow Doppler imaging is het standaard diagnostisch instrument voor het detecteren van MR. Transthoracale echocardiografie heeft de voorkeur bij de eerste screening, maar transesofageale echocardiografie is van onschatbare waarde voor het vaststellen van de ernst en het precieze mechanisme van acute MR, vooral wanneer de verdenking op papillaire ruptuur hoog is. Bij alle patiënten moet hartkatheterisatie worden verricht om de omvang en ernst van coronaire hartziekte vast te stellen.
Behandeling van MR
Vaststelling van hemodynamische stabiliteit, opheldering van het precieze mechanisme van acute MR, en snelle therapie zijn alle noodzakelijk voor een gunstige uitkomst. Medische behandeling omvat vermindering van de druk in de naaste omgeving door het gebruik van diuretica, natriumnitroprusside en nitraten bij patiënten die niet hypotensief zijn.
Bij patiënten bij wie de hemodynamiek in het gedrang komt, moet snel intra-aortale balloncasspulsatie worden toegepast. Deze ingreep vermindert gewoonlijk aanzienlijk de afterload en het regurgitant volume, waardoor de cardiale output verbetert ter voorbereiding op chirurgische reparatie. Zonder chirurgische reparatie resulteert medische therapie alleen bij patiënten met een papillaire spierscheuring in onvoldoende hemodynamische verbetering en een slechte prognose op korte termijn.
Noodoperatieve interventie is de behandeling bij uitstek voor papillaire spierscheuring. Chirurgische benaderingen kunnen reparatie of vervanging van de mitralisklep omvatten. Bij afwezigheid van papillaire spiernecrose verbetert mitralisklepreparatie de overlevingskans meer dan mitralisklepvervanging. Dit verschil komt doordat het subvalvulaire apparaat gewoonlijk behouden blijft. Mitralisklepreparatie elimineert ook complicaties die verband houden met het niet goed functioneren van de prothese.
Bij patiënten met uitgebreide necrose van de papillaire spier en/of de ventriculaire vrije wand wordt de voorkeur gegeven aan mitralisklepvervanging. In één studie werd aangetoond dat coronaire bypass grafting (CABG), uitgevoerd op het moment van de operatie, de overleving op korte en lange termijn verbeterde.
De enige situatie waarin een spoedoperatie veilig kan worden vermeden is in het geval van intermitterende MR als gevolg van recidiverende ischemie. Bij deze patiënten kan succesvolle myocardiale revascularisatie effectief zijn. Deze procedure wordt uitgevoerd door middel van angioplastie of coronaire bypass grafting.
Dynamische LVOTO
Oorspronkelijk werd gedacht dat dynamische LVOTO alleen aanwezig was bij hypertrofische cardiomyopathie, hebben verschillende onderzoekers de aanwezigheid van dynamische LVOTO gerapporteerd als een complicatie van acuut voorste MI. De aanwezigheid van dynamische LVOTO is ook verondersteld een van de etiologieën te zijn voor myocardiale ruptuur.
Dynamische LVOTO wordt mechanisch veroorzaakt door compensatoire hyperkinesis van de basale en middensegmenten van de LV bij patiënten met distale LAD infarcten. Voorspellers van verhoogde regionale wandbeweging in niet-infarct zones zijn de afwezigheid van multivatulaire ziekte, vrouwelijk geslacht, en hogere flow in het infarct-gerelateerde bloedvat. De verhoogde contractiekracht van het basale myocard veroorzaakt mitralis regurgitatie via het Venturi effect. Dit resulteert in een verhoogde OTO, die leidt tot een verdere vermindering van de LV-output in de setting van reeds aanwezige systemische hypoperfusie.
Deze verhoogde LVOTO in de setting van beschadigd transmuraal myocard vormt een perfecte setting waarin er een verhoogde end-systolische intraventriculaire druk is, die een verhoogde wandspanning induceert van de verzwakte, necrotische infarctzone. Deze vaak fatale complicatie komt het meest voor bij vrouwen, oudere patiënten (>70 jaar), en patiënten zonder voorafgaand MI.
Clinische presentatie van LVOTO
De getroffen patiënten kunnen de gebruikelijke symptomen van een verhoogd autonoom symptomencomplex hebben, zoals ademnood, diaphorese, en koele, klamme ledematen, naast de typische tekenen en symptomen van AMI.
Deze patiënten kunnen snel overgaan in cardiogene shock met ernstige orthopneu, dyspneu, en oligurie, en ze kunnen een veranderde mentale status hebben door cerebrale hypoperfusie. Patiënten kunnen zich presenteren met een nieuw systolisch ejectie geluid, een nieuw holosystolisch geluid uitstralend naar de axilla als gevolg van systolische anterior beweging (SAM) van de mitralis bladder. Een S3 galop, pulmonale rales, hypotensie, en tachycardie kunnen ook aanwezig zijn; deze laatste fysieke tekenen kunnen volledig afwezig zijn in de acute setting.
Transsthoracale of transesofageale echocardiografie (TTE/TEE) is de diagnostische test van keuze en kan nauwkeurig het hyperkinetische segment, LVOTO, en mitrale leaflet SAM karakteriseren.
Behandeling van LVOTO
Overweeg de vermindering van de hypercontractiliteit van het myocard door zorgvuldige toevoeging van beta-blokkade. Ook langzame volume reanimatie door afterload verhoging (fenylepherine) kan de preload verhogen en LVOTO en SAM verlagen. Het zou het beste zijn om afterload-verhogende medicatie te vermijden. Vasodilatoren, inotropes en ballonpompen moeten ook worden vermeden omdat zij LVOTO kunnen verhogen.
RV failure
Vaak gezien in de setting van een inferieur MI, is een milde RV disfunctie na MI gebruikelijk; in de meeste gevallen is het effect op de LV echter minimaal.
Significante RV hypokinesis treedt op wanneer er sprake is van proximale rechter corinair arteriële occlusie met weinig collateraal vanuit de linker circulatie. Er wordt verondersteld dat omdat het RV dunwandig is en een lagere zuurstofbehoefte heeft, er coronaire perfusie is gedurende de gehele hartcyclus; daarom is een wijdverspreid irreversibel infarct zeldzaam.
Typisch RV falen kan zich presenteren met hypotensie (als gevolg van het gebrek aan LV preload) en jugulaire veneuze distensie met een vrij longveld. Hoewel dit klassiek wordt beschreven in het kader van RV falen, wordt dit triade zelden in zijn zuivere vorm gezien in de klinische setting. De meeste patiënten presenteren zich met cardiogene shock of LV-falen met geassocieerde autonome symptomen.
De aanwezigheid van een veneuze jugulaire druk van meer dan 8 cm H2O en het Kussmaul-teken is zeer gevoelig en specifiek voor ernstig RV-falen.
Occasioneel veroorzaakt een rechts-naar-links shunting via een patent foramen ovale aanhoudende hypoxemie. Houd deze eigenaardige complicatie in gedachten.
Elektrocardiografisch presenteren patiënten zich met inferieure ST-elevatie in combinatie met ST-elevatie in de V4R-afleiding. De röntgenfoto van de borstkas ziet er meestal gaaf uit, zonder veneuze distensie in de bovenste kwab.
Diagnose van RV-falen
Twee-dimensionale (2D) echocardiografie en magnetische resonantie imaging (MRI) zijn zeer nuttig. Meestal zal echocardiografie helpen om de diagnose te stellen.
Swan-Ganz katheterisatie bevindingen zijn meestal suggestief voor hoge RV druk met een lage PCWP.
Behandeling van RV falen
Volume reanimatie om de PCWP op of rond de 15 mmHg te houden kan helpen bij het temporiseren door tijdelijk de RV voorspanning te verhogen. De definitieve behandeling bestaat echter uit het herstellen van de coronaire circulatie. In zeldzame gevallen van ernstig falen van de RV moet mechanische ondersteuning van de bloedsomloop met behulp van RV-assistentieapparatuur (AD) worden overwogen, hetzij tijdelijk, hetzij als overbruggingstherapie in de setting van uitgebreide biventriculaire betrokkenheid.