Fysische eigenschappen van ionische vs. covalente verbindingen
In het algemeen hebben ionische en covalente verbindingen verschillende fysische eigenschappen. Ionische verbindingen vormen harde kristallijne vaste stoffen die smelten bij hoge temperaturen en bestand zijn tegen verdamping. Deze eigenschappen vloeien voort uit de karakteristieke interne structuur van een ionische vaste stof, schematisch weergegeven in deel (a) in figuur 2.7.4, die de driedimensionale array van afwisselend positieve en negatieve ionen toont die bij elkaar worden gehouden door sterke elektrostatische aantrekkingen. Zoals weergegeven in deel (b) van figuur 9.5.1 bestaan de meeste covalente verbindingen daarentegen uit afzonderlijke moleculen die bij elkaar worden gehouden door relatief zwakke intermoleculaire krachten (de krachten tussen de moleculen), ook al worden de atomen binnen elk molecuul bij elkaar gehouden door sterke intramoleculaire covalente bindingen (de krachten binnen het molecuul). Covalente stoffen kunnen gassen, vloeistoffen of vaste stoffen zijn bij kamertemperatuur en -druk, afhankelijk van de sterkte van de intermoleculaire interacties. Covalente moleculaire vaste stoffen hebben de neiging zachte kristallen te vormen die bij lage temperaturen smelten en gemakkelijk verdampen.
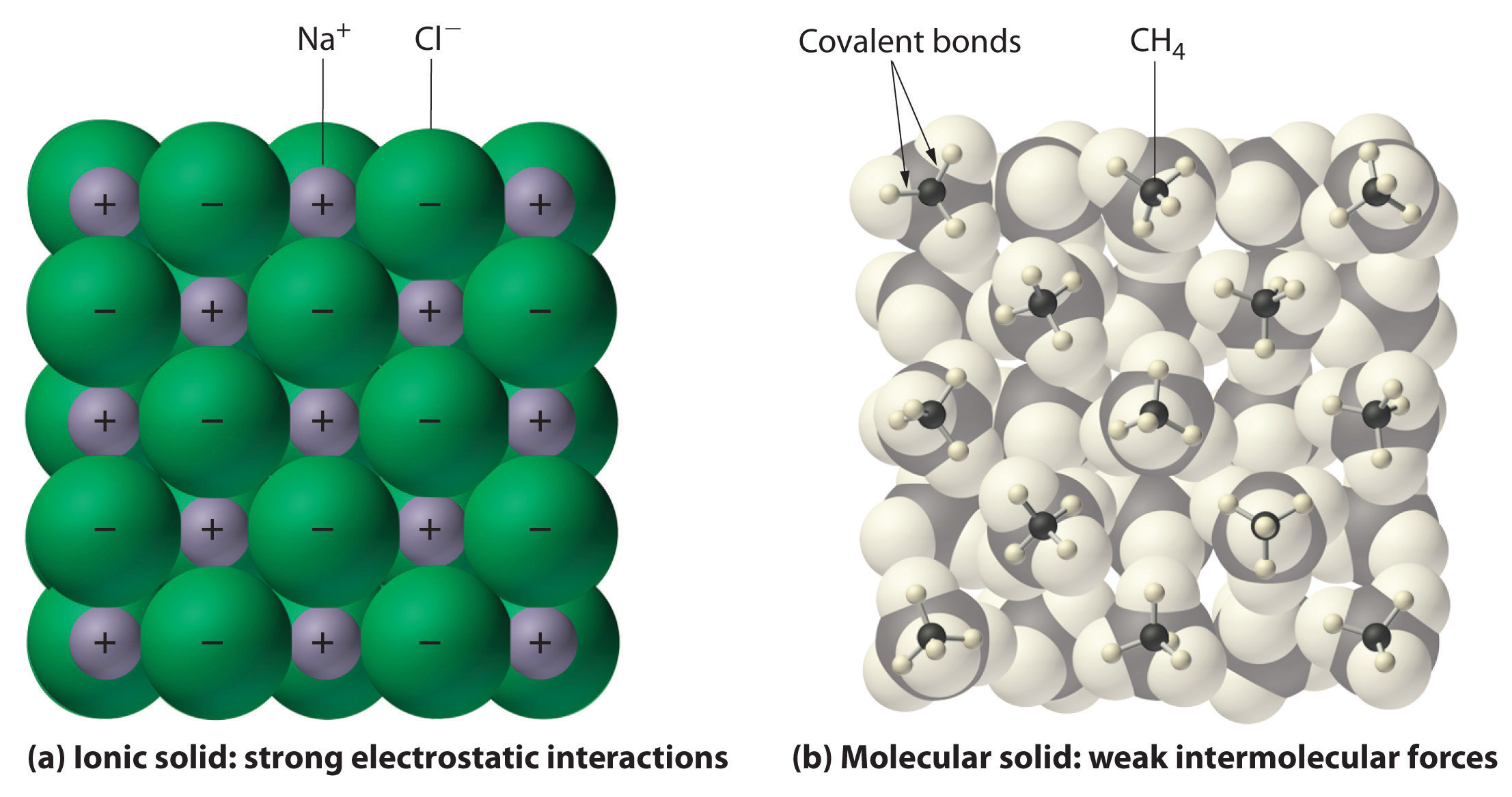
Figuur 9.5.1: Interacties in Ionische en Covalente vaste stoffen. (a) De positief en negatief geladen ionen in een ionische vaste stof zoals natriumchloride (NaCl) worden bij elkaar gehouden door sterke elektrostatische interacties. (b) In deze voorstelling van de pakking van methaanmoleculen in vast methaan, een prototypisch moleculair vast lichaam, worden de methaanmoleculen in het vast lichaam slechts bij elkaar gehouden door relatief zwakke intermoleculaire krachten, hoewel de atomen in elk methaanmolecuul bij elkaar worden gehouden door sterke covalente bindingen.
Hydrocarbons
Moleculaire vaste stoffen bestaan uit atomen of moleculen die aan elkaar worden gehouden door dipool-dipool interacties, London dispersiekrachten, of waterstofbruggen, of een combinatie hiervan. De ordening van de moleculen in vast benzeen is als volgt:

Figuur 9.5.2: De structuur van vast benzeen. In vast benzeen zijn de moleculen niet met hun vlakken evenwijdig aan elkaar gerangschikt, maar onder hoeken van 90°.
Omdat de intermoleculaire interacties in een moleculaire vaste stof relatief zwak zijn in vergelijking met ionische en covalente bindingen, hebben moleculaire vaste stoffen de neiging zacht te zijn, weinig te smelten en gemakkelijk te verdampen (\(ΔH_{fus}) en \(ΔH_{vap}) zijn laag). Voor gelijksoortige stoffen neemt de sterkte van de London dispersiekrachten gelijkmatig toe met toenemende molecuulmassa. Zo liggen de smeltpunten van benzeen (C6H6), naftaleen (C10H8) en antraceen (C14H10), met één, twee en drie gefuseerde aromatische ringen, bij respectievelijk 5,5°C, 80,2°C en 215°C. Ook de fusie-enthalpie neemt binnen de reeks geleidelijk toe: benzeen (9,95 kJ/mol) < naftaleen (19,1 kJ/mol) < antraceen (28,8 kJ/mol). Als de moleculen echter vormen hebben die zich niet efficiënt in het kristal kunnen samenpakken, dan zijn de smeltpunten en de enthalpie’s van fusie vaak onverwacht laag, omdat de moleculen niet in staat zijn zich te rangschikken om de intermoleculaire interacties te optimaliseren. Zo hebben tolueen (C6H5CH3) en m-xyleen smeltpunten van respectievelijk -95°C en -48°C, die aanzienlijk lager liggen dan het smeltpunt van het lichtere maar meer symmetrische analoog, benzeen.
Zelfhelend rubber is een voorbeeld van een moleculaire vaste stof met het potentieel voor belangrijke commerciële toepassingen. Het materiaal kan uitrekken, maar wanneer het in stukken wordt gebroken kan het zich weer aan elkaar hechten door het waterstofbruggennetwerk te herstellen zonder enig teken van zwakte te vertonen. Het wordt onder meer bestudeerd voor gebruik in kleefstoffen en fietsbanden die zichzelf kunnen genezen.

Figuur 9.5.3: Tolueen en m-xyleen. De methylgroepen aan de fenylring in tolueen en m-xyleen verhinderen dat de ringen zich net zo goed samenpakken als in vast benzeen.