24-6C Reacties van nitroverbindingen
Nitroverbindingen zijn in thermodynamische zin vrij onstabiel; zo is de ontledingswarmte van nitromethaan, volgens de volgende stoichiometrie, \(67.4: {kcal mol}^{-1}).
Bij het commercieel gebruik van nitroverbindingen als explosieven wordt geprofiteerd van de aanzienlijke energie en de snelle reactiesnelheid van dit soort reacties. Bij sommige nitroverbindingen, zoals TNT, is er nog het voordeel van de geringe schokgevoeligheid.
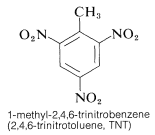
TNT wordt niet gemakkelijk tot ontploffing gebracht door een simpele schok en brandt zelfs zonder te exploderen. Zodra de detonatie echter begint, plant de ontleding zich snel voort. De eigenschappen van een redelijke stabiliteit bij hantering en een hoog thermodynamisch potentieel maken nitroverbindingen bijzonder nuttig. Andere polynitroverbindingen die bruikbaar zijn als explosieven zijn PETN (Sectie 17-3C), cycloniet (Sectie 16-4C), picrinezuur, en tetryl:
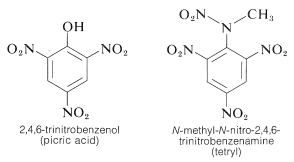
Een belangrijk kenmerk van aromatische polynitroverbindingen is hun vermogen om “ladingsoverdracht”-complexen te vormen met aromatische koolwaterstoffen, vooral die welke gesubstitueerd zijn met alkylgroepen. Complexen van 2,4,6-trinitrobenzenol (picrinezuur) en aromatische koolwaterstoffen zijn vaak kristallijne vaste stoffen, die nuttig zijn voor de scheiding, zuivering en identificatie van aromatische koolwaterstoffen. Deze stoffen worden “koolwaterstofpikraten” genoemd, maar de naam is misleidend omdat het eigenlijk geen zouten zijn. Bovendien worden soortgelijke complexen gevormd tussen aromatische koolwaterstoffen en trinitrobenzeen, hetgeen aantoont dat de nitrogroepen en niet de hydroxylgroep essentieel zijn voor de complexvorming. De binding in deze complexen lijkt op die in de complexen van halogenen met alkenen en benzeen (paragrafen 22-4D en 10-3C) en is het gevolg van attractieve krachten tussen elektron-rijke en elektron-arme stoffen. De beschrijvende naam – ladingsoverdrachtscomplex – suggereert dat het complex VB-structuren heeft waarbij een elektron wordt overgedragen van het donormolecuul (elektronrijk) naar het acceptormolecuul (elektronarm). De naam “complex” wordt ook gebruikt omdat meestal ten minste één component van het complex een elektronensysteem heeft. Lading-overdracht of lading-overdracht complexen tussen polynitroverbindingen en aromatische koolwaterstoffen blijken sandwich-achtige structuren te geven met de aromatische ringen in parallelle vlakken, hoewel niet noodzakelijkerwijs precies over elkaar gecentreerd:
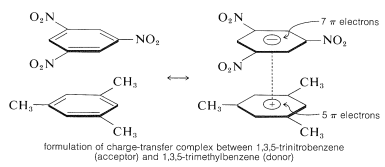
Lading-overdracht complexen zijn bijna altijd sterker gekleurd dan hun individuele componenten. Een spectaculair voorbeeld is benzeen en tetracyanoetheen, die elk afzonderlijk kleurloos zijn, maar die bij menging een helder-oranje complex geven. Een verschuiving naar langere golflengten van absorptie, in verhouding tot hun componenten, is te verwachten voor ladingsoverdrachtscomplexen vanwege de grotere mogelijkheid tot stabilisatie van de aangeslagen toestand door elektronendelokalisatie waarbij beide componenten betrokken zijn.
Reductie van nitroverbindingen vindt gemakkelijk plaats met een verscheidenheid aan reductiemiddelen en dergelijke reducties maken een bijzonder nuttige synthese van aromatische aminen mogelijk (hoofdstuk 23-12B):
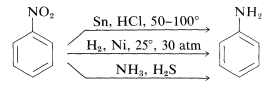
Voor de reductie van een nitroverbinding tot een amine zijn zes equivalenten reductiemiddel nodig:
Men zou niet verwachten dat zo’n reductie in één enkele stap plaatsvindt. De reductie verloopt namelijk stapsgewijs en via een reeks tussenproducten, die met sterke reductiemiddelen in zure oplossing hooguit een kortstondig bestaan hebben. De tussenproducten die achtereenvolgens worden gevormd uit nitrosoverbindingen, en gesubstitueerde azanolen (hydroxylamines), zijn:
}{RNHOH}} \ce{RN=O} \links}{longrightarrow}} \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}}
Zo kunnen aryl-gesubstitueerde azanolen rechtstreeks worden verkregen uit de overeenkomstige nitroverbindingen met zink en ammoniumchlorideoplossing. Zink en zoutzuur geeft echter het amine:
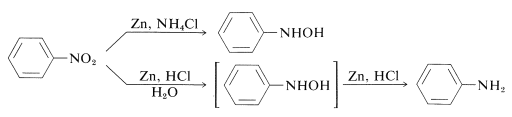
Het verschil tussen deze reacties zit in de reductiesnelheden die samenhangen met de zuurgraad van de oplossing. Ammoniumchloride is een veel zwakker zuur dan ammoniumchloride; de pH van ammoniumchloride-oplossingen is ongeveer 6.
Oxidatie van de arylazanolen onder gecontroleerde omstandigheden levert nitroso-verbindingen op. Deze reactie lijkt op de oxidatie van alcoholen tot ketonen (hoofdstuk 15-6B):
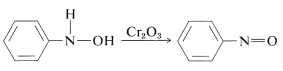
Annuctie van arylnitroverbindingen met minder krachtige reductiemiddelen, vooral in alkalische media, geeft wat een mysterieus conglomeraat van bimoleculaire reductieproducten lijkt te zijn. Bijvoorbeeld, met nitrobenzeen,
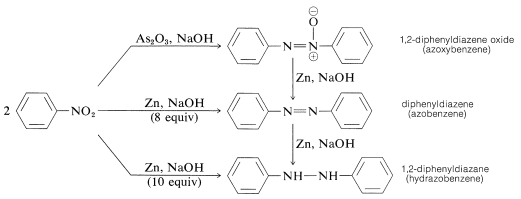
Al deze stoffen kunnen met tin en zoutzuur worden gereduceerd tot benzenamine. Bijgevolg kan elk van deze stoffen een tussenproduct zijn bij de reductie van nitroverbindingen tot aminen, maar dit hoeft niet het geval te zijn. De vorming van de bimoleculaire reductieproducten is het resultaat van door basen geïnduceerde reacties tussen nitrosoverbindingen en azanolen of aminen en mogelijk verdere reductie van de oorspronkelijk geproduceerde stoffen.
Een aantal polynitrobenzeenderivaten heeft belangrijke herbicidale toepassingen. Voorbeelden zijn \(\ce{N}^3})-diethyl-6-trifluormethyl-2,4-dinitro-1,3-benzeendiamine en \(\ce{N}^3})-dipropyl-4-trifluormethyl-2,6-dinitrobenzenamine:
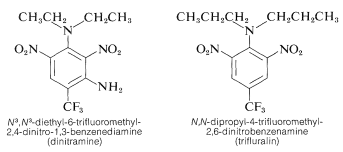
Deze stoffen doden bij vermenging met de bodem onkruidzaailingen, maar geen gewassen als katoen, sojabonen en pinda’s. De activiteit is hoog; normaal gesproken is slechts ongeveer 0,08 g m}^{-2} nodig voor een goede onkruidbestrijding.
De belangrijkste reacties van nitroalkanen zijn die waarbij de waterstofgenen van de primaire en secundaire verbindingen betrokken zijn. Zo is nitromethaan zuur genoeg om op te lossen in waterige hydroxideoplossingen. Het anion dat zo ontstaat, heeft een elektronische structuur die analoog is aan die van het nitraatanion:
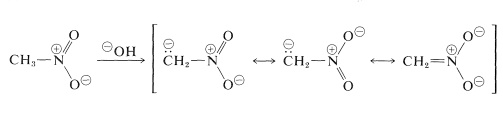
Een interessante eigenschap van dit ion is dat wanneer oplossingen ervan worden aangezuurd, er een onstabiele, vrij sterk zure isomeer van nitromethaan ontstaat (de aci-vorm genoemd), die langzaam weer overgaat in de stabielere nitrovorm:
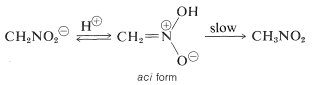
Dergelijke veranderingen vinden ook plaats bij het aanzuren van het enolzout van een carbonylverbinding, waarbij het belangrijkste verschil is dat de aci-nitroverbinding veel langer meegaat dan een enol van een eenvoudige keton (zie hoofdstuk 17-1B).
Primaire en secundaire nitroverbindingen ondergaan aldol-addities en Michael-addities met geschikte carbonylverbindingen en basische katalysatoren:
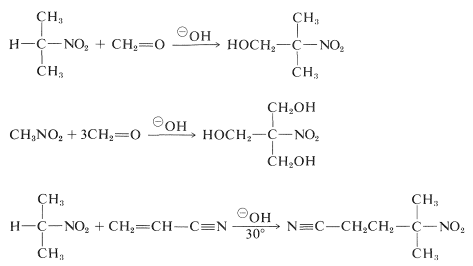
Helaas zijn alkyleringsreacties die analoog zijn aan de basegekatalyseerde alkylering van carbonylverbindingen in het algemeen niet bruikbaar voor de synthese van hogere nitroverbindingen, omdat alkylering van de geconjugeerde basen van primaire nitroverbindingen langzamer verloopt dan alkylering van de geconjugeerde basen van primaire nitroverbindingen.