Leerdoelen
- De belangrijkste soorten radioactiviteit definiëren en er voorbeelden van geven.
Atomen zijn opgebouwd uit subatomaire deeltjes-protonen, neutronen en elektronen. Protonen en neutronen bevinden zich in de atoomkern en zorgen voor het grootste deel van de massa van het atoom, terwijl elektronen in schillen en subschillen rond de kern cirkelen en verantwoordelijk zijn voor de grootte van een atoom. Herinner u de notatie om een isotoop van een bepaald atoom beknopt weer te geven:
Het element in dit voorbeeld, weergegeven door het symbool C, is koolstof. Het atoomnummer, 6, is het subscript linksonder op het symbool en is het aantal protonen in het atoom. Het massagetal, het superscript linksboven het symbool, is de som van het aantal protonen en neutronen in de kern van deze specifieke isotoop. In dit geval is het massagetal 12, wat betekent dat het aantal neutronen in het atoom 12 – 6 = 6 is (d.w.z. het massagetal van het atoom min het aantal protonen in de kern is gelijk aan het aantal neutronen). Soms wordt het atoomnummer in deze notatie weggelaten, omdat het symbool van het element zelf het karakteristieke atoomnummer weergeeft. De twee isotopen van waterstof, 2H en 3H, krijgen hun eigen naam: respectievelijk deuterium (D) en tritium (T). Een andere manier om een bepaalde isotoop uit te drukken is door het massagetal achter de naam van het element te vermelden, zoals koolstof-12 of waterstof-3.
De atoomtheorie ging er in de 19e eeuw van uit dat kernen een vaste samenstelling hadden. Maar in 1896 ontdekte de Franse wetenschapper Henri Becquerel dat een uraniumverbinding die in de buurt van een fotografische plaat werd geplaatst, een beeld op de plaat maakte, zelfs als de verbinding in een zwarte doek was gewikkeld. Hij redeneerde dat de uraniumverbinding een soort straling uitzond die door het doek ging en de fotografische plaat belichtte. Nader onderzoek toonde aan dat de straling een combinatie was van deeltjes en elektromagnetische stralen, met als uiteindelijke bron de atoomkern. Deze uitstralingen werden uiteindelijk, collectief, radioactiviteit genoemd.
Er zijn drie hoofdvormen van radioactieve uitstoot. De eerste wordt een alfadeeltje genoemd, dat wordt gesymboliseerd door de Griekse letter α. Een alfadeeltje is samengesteld uit twee protonen en twee neutronen, en is dus hetzelfde als een heliumkern. (We gebruiken vaak α om een alfadeeltje voor te stellen). Het heeft een 2+ lading. Wanneer een radioactief atoom een alfadeeltje uitzendt, vermindert het atoomnummer van het oorspronkelijke atoom met twee (door het verlies van twee protonen), en zijn massagetal met vier (door het verlies van vier kerndeeltjes). We kunnen de emissie van een alfadeeltje voorstellen met een chemische vergelijking-bijvoorbeeld, de alfadeeltjesemissie van uranium-235 is als volgt:
Hoe weten we dat een product van de reactie {^{231}_{90}Th}} is? We gebruiken de wet van behoud van materie, die zegt dat materie niet kan worden gemaakt of vernietigd. Dit betekent dat we aan beide kanten van de chemische vergelijking hetzelfde aantal protonen en neutronen moeten hebben. Als onze uraniumkern 2 protonen verliest, blijven er 90 protonen over, waardoor het element als thorium wordt geïdentificeerd. Bovendien, als we 4 kerndeeltjes van de oorspronkelijke 235 verliezen, blijven er 231 over. We gebruiken dus aftrekking om de isotoop van het thoriumatoom te identificeren – in dit geval ^(^231}_{90}Th}).
Chemici gebruiken vaak de namen ouderisotoop en dochterisotoop om het oorspronkelijke atoom en het product anders dan het alfadeeltje aan te duiden. In het vorige voorbeeld is U de moederisotoop, en is de dochterisotoop de dochterisotoop. Wanneer een element op deze manier in een ander element verandert, ondergaat het radioactief verval.
Voorbeeld \(\PageIndex{1}}): Radon-222
Schrijf de atoomvergelijking die het radioactieve verval van radon-222 door de emissie van alfadeeltjes voorstelt en identificeer de dochterisotoop.
Oplossing
Radon heeft een atoomnummer van 86, dus de moederisotoop wordt voorgesteld als \(\ce{^{222}_{86}Rn}\). Het alfadeeltje stellen we voor als Ôce{^{4}_{2}He}} en door aftrekking (222 – 4 = 218 en 86 – 2 = 84) identificeren we de dochterisotoop als een isotoop van polonium, Ôce{^{218}_{84}Po}}:
(\ce{_{86}^{222}Rnrightarrow \, _2^4He + \, _{84}^{218}Po})
Oefening \(\PageIndex{1}\): Polonium-209
Schrijf de atoomvergelijking die het radioactieve verval van polonium-209 door de emissie van alfadeeltjes voorstelt en identificeer de dochterisotoop.
Antwoord
(^84}^{209}Po^rightarrow, _2^4He + ^, _{82}^{205}Pb})
Het tweede belangrijke type radioactieve emissie heet een bètadeeltje, gesymboliseerd door de Griekse letter β. Een bètadeeltje is een elektron dat uit de kern wordt uitgeworpen (niet uit de elektronenschillen om de kern) en heeft een lading van 1-. We kunnen een bètadeeltje ook voorstellen als β-. Het netto-effect van de emissie van bètadeeltjes op een kern is dat een neutron wordt omgezet in een proton. Het totale massagetal blijft gelijk, maar omdat het aantal protonen met één toeneemt, gaat het atoomnummer met één omhoog. Koolstof-14 vervalt door het uitzenden van een bètadeeltje:
Ook hier is de som van de atoomnummers aan beide kanten van de vergelijking gelijk, evenals de som van de massagetallen. (Merk op dat aan het elektron een “atoomnummer” van 1 wordt toegekend, gelijk aan zijn lading.)
Het derde belangrijke type radioactieve emissie is geen deeltje, maar veeleer een zeer energetische vorm van elektromagnetische straling die gammastralen wordt genoemd, gesymboliseerd door de Griekse letter γ. Gammastralen zelf dragen geen algemene elektrische lading, maar zij kunnen elektronen uit atomen in een monster van materie slaan en het elektrisch geladen maken (waarvoor gammastralen ioniserende straling worden genoemd). Zo wordt bij het radioactieve verval van radon-222 zowel alfa- als gammastraling uitgezonden, waarbij de laatste een energie heeft van 8,2 × 10-14 J per vergane kern:
Dit lijkt misschien niet veel energie, maar als 1 mol radonatomen zou vervallen, zou de energie van de gammastraling 49 miljoen kJ bedragen!
Voorbeeld: Boron-12
Schrijf de atoomvergelijking die het radioactieve verval van boron-12 door emissie van betadeeltjes weergeeft en identificeer de dochterisotoop. Gelijktijdig met het betadeeltje wordt een gammastraal uitgezonden.
Oplossing
Het moederisotoop is een elektron, een van de producten is een elektron, een isotoop. Opdat de massa en het atoomnummer aan beide zijden dezelfde waarde hebben, moet het massagetal van de dochterisotoop 12 zijn en het atoomnummer 6. Het element met een atoomnummer 6 is koolstof. De volledige atoomvergelijking is dus als volgt:
De dochterisotoop is (^{12}_6 C}).
Oefening (\Index{2}\): Jodium-131
Schrijf de atoomvergelijking die het radioactieve verval van jodium-131 door de emissie van betadeeltjes weergeeft en identificeer de dochterisotoop. Gelijktijdig met het betadeeltje wordt een gammastraal uitgezonden.
Antwoord
Alfa-, bèta- en gammastraling hebben verschillende vermogens om materie te doordringen. Het relatief grote alfadeeltje wordt gemakkelijk door materie tegengehouden (hoewel het een aanzienlijke hoeveelheid energie kan afgeven aan de materie waarmee het in aanraking komt). Bèta-deeltjes dringen slechts in geringe mate in materie door, misschien hooguit enkele centimeters. Gammastralen kunnen diep in materie doordringen en kunnen een grote hoeveelheid energie aan de omringende materie afgeven. Tabel geeft een overzicht van de eigenschappen van de drie belangrijkste soorten radioactieve straling.
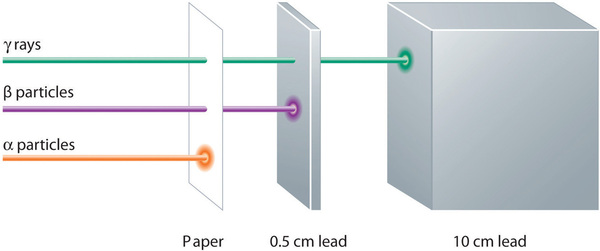
| Karakteristiek | Alfadeeltjes | Betadeeltjes | Gammastralen |
|---|---|---|---|
| symbolen | α, \(\mathrm{_{2}^{4}He}\) | β, \(\ce{^{0}_{-1} e}) | γ |
| identiteit | heliumkern | elektron | elektromagnetische straling |
| lading | 2+ | 1- | geen |
| massagetal | 4 | 0 | 0 |
| penetrerend vermogen | minimaal (dringt niet door huid heen) | kort (dringt enigszins door huid en sommige weefsels heen) | diep (dringt diep door weefsels heen) |
Occasioneel, breekt een atoomkern in kleinere stukken in een radioactief proces dat spontane splijting (of splijting) wordt genoemd. Typisch, zijn de dochterisotopen die door splitsing worden geproduceerd een gevarieerde mengeling van producten, eerder dan een specifieke isotoop zoals bij alfa- en betadeeltjesemissie. Vaak produceert splijting een overmaat aan neutronen die soms door andere kernen worden opgevangen, waardoor mogelijk extra radioactieve gebeurtenissen worden veroorzaakt. Uranium-235 ondergaat in geringe mate spontane splijting. Een typische reactie is
waarbij \ce{_0^1n}\) een neutron is. Zoals bij elk nucleair proces moeten de som van de atoomnummers en de massagetallen aan beide zijden van de vergelijking gelijk zijn. Spontane splijting komt alleen voor in grote kernen. De kleinste kern die spontane splijting vertoont, is lood-208.
Splijting is het radioactieve proces dat wordt gebruikt in kerncentrales en één type kernbom.
Key Takeaway
De belangrijkste soorten radioactiviteit zijn alfadeeltjes, bètadeeltjes en gammastralen.
Oefening voor begripsherziening
-
Wat zijn de belangrijkste soorten radioactiviteit? Schrijf chemische vergelijkingen die elk type laten zien.
Antwoord
-
De belangrijkste soorten radioactiviteit zijn alfaverval, bètaverval en gammastraling; alfaverval met gammastraling: \^(^86}^{222}Rn ^84}^{218}Po + ^4_2He + ^gamma}); bètaverval: \(antwoorden zullen variëren)
>