A humán Neisseria és rokon fajok közül három faj – N. mucosa, M. catarrhalis és K. denitrificans – redukálja a nitrátot. A nitrátredukciós teszt kritikus teszt a N. gonorrhoeae és a K. denitrificans megkülönböztetésére, különösen akkor, ha a K. denitrificans törzsei a festett kenetben gram-negatív diplokokkuszoknak tűnnek.
Elv
A baktériumfajok megkülönböztethetők a nitrát nitritté vagy nitrogéngázokká való redukciós képességük alapján. Az emberi eredetű Neisseriaceae családok közül a Neisseria mucosa, a Moraxella catarrhalis és a Kingella denitrificans törzsek redukálják a nitrátot. A M. catarrhalis és a K. denitrificans törzseit tévesen N. gonorrhoeae-ként azonosították. A nitrátredukciós teszt lehetővé teszi a nitrátpozitív és a nitrátnegatív N. gonorrhoeae fajok megkülönböztetését. A nitrát redukciója egyes fajoknál anaerob légzéssel párosulhat.
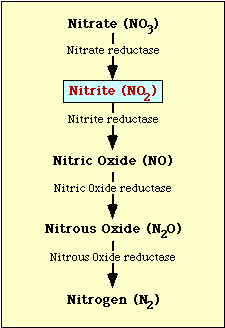
A nitrátredukcióban részt vevő biokémiai útvonalat az 1. ábra mutatja. A nitrát nitritté redukálódik, amely ezután nitrogén-oxiddá, dinitrogén-oxiddá vagy nitrogénné redukálódhat (1. ábra).
l. ábra. Nitrátredukciós útvonal.
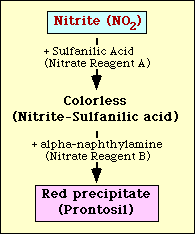
A nitrátredukciós teszt alapja a nitrit kimutatása a közegben egy organizmussal való inkubációt követően. Ha jelen van a közegben, a nitrit szulfanilsavval (Nitrátreagens A) reagál, és színtelen komplexet (nitrit-szulfanilsav) képez. Ez a komplex vörös csapadékot (prontoszil) eredményez, amikor a teszthez nitrátreagens B-t (alfa-naftilamin) adunk, amint az a 2. ábrán látható.
2. ábra. A nitrit kimutatásának diagramszerű ábrázolása a közegben.
A közegben csak akkor keletkezik vörös szín, ha a közegben nitrit van jelen. A vörös szín hiánya a közegben a szulfanilsav és az alfa-naftilamin hozzáadása után csak azt jelenti, hogy a közegben nincs jelen nitrit. Ennek a megfigyelésnek két magyarázata lehet:
- A nitrát nem redukálódott; a törzs nitrát-negatív.
- A nitrát nitritté redukálódhatott, amely aztán teljesen nitrogén-oxiddá, dinitrogén-oxiddá vagy nitrogénné redukálódott, amely nem reagál a nitrittel reagáló reagensekkel; a törzs nitrát-pozitív.
Minden olyan tesztközeget, amely a nitrátreagensek hozzáadása után negatív eredményt ad, tovább kell vizsgálni annak megállapítására, hogy a két értelmezés közül melyik a pontos.
A sikeres nitrátredukciós teszt attól függ, hogy a tesztet a megfelelő körülmények között végezzük el.
- A reakció akkor megy végbe a legjobban, ha az alapközeg támogatja a szervezet növekedését. Azonban, bár egyes Neisseria fajok nem növekednek jól a táptalajon, a nitrátredukciós teszt sikeresen elvégezhető olyan táptalajon is, amely nem támogatja a növekedést, ha a táptalajt erősen beoltjuk, hogy elegendő preformált enzim álljon rendelkezésre a reakció lejátszódásához.
A nitrátreakció csak anaerob körülmények között játszódik le. A nitráttartalmú közeget csövekbe adagoljuk, hogy alacsony felület:mélység arányt kapjunk, ami korlátozza az oxigén diffúzióját a közegbe, pl. 5 ml közeget adagolunk egy 13 mm átmérőjű csőbe. A Neisseria és a rokon fajok felhasználják a közegben lévő oxigént, és gyorsan anaerob körülményeket teremtenek, amelyek ideálisak a nitrát redukciójához.
A nitrátredukciós tesztet 0,2% kálium-nitrátot tartalmazó közegben végzik. A táptalajt erősen beoltjuk a gyanús szervezet tiszta tenyészetével, és 48 órán át 35C-36,5C-on inkubáljuk inkubátorban, kiegészítő szén-dioxiddal vagy anélkül.
A nitrátredukciót a Griess-Llosvay-reagensekkel, szulfanilsavval és alfa-naftilaminnal mutatjuk ki. A szulfanilsavat (A nitrátreagens) az inkubációs keverékhez adjuk, és komplexet (nitrit-szulfanilsav) képez a közegben jelen lévő nitrittel. Amikor alfa-naftil-amint (Nitrátreagens B) adunk az inkubált közeghez, vörös csapadék (prontoszil) képződik a közegben jelen lévő nitrit-szulfanilsav komplexszel.
A szervezet nitrátpozitívnak jelenthető, ha a közegben az A és B nitrátreagensek közeghez adása után vörös szín alakul ki, ami azt jelzi, hogy a szervezet a nitrátot nitritté redukálta.
A vörös szín hiánya mindkét reagens hozzáadása után nem jelenti automatikusan azt, hogy a szervezet nem képes a nitrát redukciójára. Előfordulhat, hogy a törzsek a nitrátot nitritté redukálták, majd a nitritet teljesen nitrogéntartalmú gázokká redukálták, amelyek nem mutathatók ki, amikor az A és B nitrátreagenseket hozzáadjuk a táptalajhoz. Ha a szulfanilsav és az alfa-naftilamin hozzáadása után a közeg színe nem változik, kis mennyiségű (“késhegynyi”) cinkport adunk az inkubált közeghez. A cinkpor kémiailag katalizálja a nitrát nitritté történő redukcióját. Így ha a nitrátot az organizmusok nem redukálták, azaz nitrát-negatívak, akkor a cinkpor redukálja azt, és az inkubált közegben 15 percen belül vörös szín alakul ki. Ha a cinkpor hozzáadása után nem alakul ki szín az inkubált táptalajban, akkor az organizmusok nemcsak nitrátot redukáltak nitritté, hanem a nitritet nitrogéngázokká is redukálták; ezek az organizmusok nitrátpozitívak is.
Noha a nitrátos táptalajt fordított Durham-csövekkel látják el a gáztermelés kimutatására, a Neisseria fajok esetében a gáztermelést nem regisztrálják. Bár egyes fajok a nitrátot a nitriten túl nitrogéngázokká redukálhatják, a gáz nem halmozódhat fel a csőben. A gáz felhalmozódása a gáztermelés sebességétől függ. Ha a gáz nagyon lassan termelődik, előfordulhat, hogy feloldódik a közegben, és nem halmozódik fel a Durham-csőben.
Mintavételi követelmények
Optimumminta: Egy gyanús gram-negatív, oxidáz-pozitív diplokokkusz (Neisseria spp. vagy M. catarrhalis) tiszta tenyészete csokoládé-agaron, amelyet szén-dioxiddal dúsított légkörben, 35 °C és 36,5 °C között 18-24 órán keresztül inkubáltak.
Elfogadhatatlan minta:
A vizsgálati eredményeket befolyásoló tényezők:
- A vizsgálati táptalajt elég erősen kell beoltani ahhoz, hogy az előképzett enzimekkel való reakció létrejöhessen.
- Az izolátumok tenyészete csokoládé-agaron, 35C-36,5C-on 24 óránál hosszabb ideig inkubálva. Az elégtelen beoltás nem teszi lehetővé, hogy az organizmusok elhasználják az oxigént, hogy olyan anaerob körülményeket teremtsenek, amelyek között a nitrát redukciója megtörténhet.
Túl sok cinkpor hozzáadása az inkubált csőhöz a nitrátnak a nitriten túli nagyon gyors nitrogéngázzá történő redukcióját eredményezheti, így a nitrit nem mutatható ki.
A minta stabilitása:
- A nitrátredukció kimutatása a Neisseria és a rokon fajok esetében az előképzett enzimek jelenlététől függ.
- A vizsgálatokat csak 24 órás tenyészetből kinyert inokulummal szabad elvégezni.
- A nitrátközeget a tenyészet inkubátorból való eltávolítását követő 30 percen belül be kell oltani; a tenyészet szobahőmérsékleten való hosszabb expozíciója csökkent enzimaktivitást eredményezhet.
Közeg/reagensek
Közeg:
Szívinfúziós leves (Difco), 25,0 g
Kálium-nitrát, 2,0 g
Desztillált víz, 1000,0 ml- Oldjuk fel az összetevőket desztillált vízben; állítsuk be az oldatot pH 7-re.0.
- Adagoljunk 5 ml aliquotát a tápoldatból 16 mm x 100 mm-es gázbetétes csövekbe (Durham-csövek, 6 mm x 50 mm).
Autoklávozzuk 15 percig 121 C-on.
- Nitrát-reduktáz-pozitív kontroll: Neisseria gonorrhoeae, ATCC 43069
Tároljuk a táptalajt 4 C-tól 10 C-ig (hűtve) a felhasználásig. Az oltás előtt melegítse elő a táptalajt szobahőmérsékletre.
Reagensek: Szulfanilsavoldat (Nitrátreagens A): 0,8% 5N ecetsavban
Kémiai név: 4-Aminobenzol-szulfonsav
Tárolja a Nitrátreagens A-t 15C és 30C között (szobahőmérsékleten) legfeljebb 3 hónapig, sötétben. A reagensek sötétbarna üvegedényekben tárolhatók; az üvegeket a sötétség biztosítása érdekében alumíniumfóliába lehet csomagolni.
Alfa-naftilamin oldat (Nitrátreagens B): 0,6% 5N ecetsavban
Kémiai név: N,N-dimetil-1-naftilamin
Tárolja a Nitrátreagens B-t 2C és 8C között (hűtve) legfeljebb 3 hónapig, sötétben. A reagensek sötétbarna üvegedényekben tárolhatók; a palackokat alumíniumfóliába lehet csomagolni a sötétség biztosítása érdekében.
Cinkpor, reagens minőségű: Szobahőmérsékleten (15C és 30C között)
Figyelmeztetés: Az ecetsav maró hatású. A bőrrel való érintkezés hólyagokat és égési sérüléseket okozhat. Érintkezés esetén azonnal öblítse ki a szemet és a bőrt bő vízzel (legalább 15 percig)
Minőségellenőrzés/vizsgálati eljárás
QC törzsek:
QC törzseket 20% glicerint tartalmazó triptikus szójaleves oldatban -70C-on tároljuk. A kontrolltörzsek reakcióit a fagyasztott törzsek készítésekor meg kell erősíteni. A QC törzsek -70C-on legfeljebb 2 évig tárolhatók.
Eljárás:
A QC törzseket a klinikai izolátumokkal azonos módon vizsgáljuk. A QC törzseket a vizsgálat elvégzése előtt legalább egyszer szubkultúrázni kell a kezdeti tenyésztés után a fagyasztott mintából. A klinikai izolátumokat szelektív táptalajból vagy tisztított szubkultúrákból lehet szubkultúrázni. Biztosítani kell, hogy a kultúrák tiszták legyenek.
- A -70 C-on tárolt kontrolltörzsek fioláit fel kell olvasztani.
- Az izoláláshoz csokoládé agar vagy kiegészített GC agar lemezekre kell törni. Inkubáljuk 35C és 36,5C között szén-dioxiddal dúsított légkörben 18-24 órán keresztül.
-
Szteril tamponnal készítsünk erős szuszpenziót jól izolált telepekből az izolátum 35C és 36C között csokoládé táptalajon inkubált tiszta kultúrájából.5 C-on, szén-dioxiddal dúsított légkörben 18-24 órán keresztül.
Figyelem: A N. gonorrhoeae és néhány más Neisseria spp. törzse nem nő meg ezen a táptalajon. Így a reakció függhet az előképzett enzimtől.
- Inkubáljuk a beoltott táptalajt és egy be nem oltott táptalaj kontroll táptalaj csövet 35 C és 36,5 C közötti hőmérsékleten szén-dioxiddal dúsított légkörben 48 órán keresztül.
-
Ha a szuszpenzió az A és B reagensek hozzáadása után színtelen, adjunk a közeghez kis mennyiségű (4-5 mg; “éles késhegy”) cinkport. Erősen rázzuk fel a csövet, és hagyjuk állni szobahőmérsékleten 10-15 percig.
Ha a közeg a Zn por hozzáadása után színtelen marad, a teszteredmény pozitív.
Ha a közeg rózsaszínűvé válik a Zn por hozzáadása után, az eredmény negatív. - Az eredmények leolvasása és rögzítése.
A 48 órás inkubáció után adjunk pasteur pipettával 5 csepp #A reagensből, majd 5 csepp #B reagensből mindkét csőbe. Jól rázzuk fel a csövet, hogy a reagenseket a táptalajjal összekeverjük.
Vizsgáljuk meg a szuszpenziót rózsaszínvörös színre, amelynek néhány percen belül ki kell alakulnia, ha a táptalaj még meleg. A reakció kicsit tovább tarthat, ha a reagensek hozzáadásakor a közeg hideg.
Ha a szuszpenzió a Zn por hozzáadása előtt rózsaszínvörösre színeződik, a reakció pozitív, és a vizsgálat befejeződött. Ne végezzük el a 4. lépést.
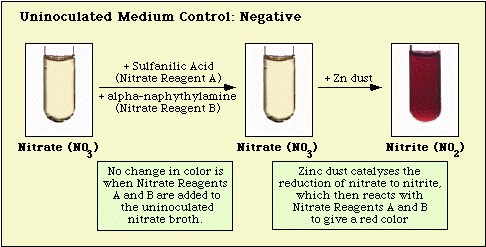
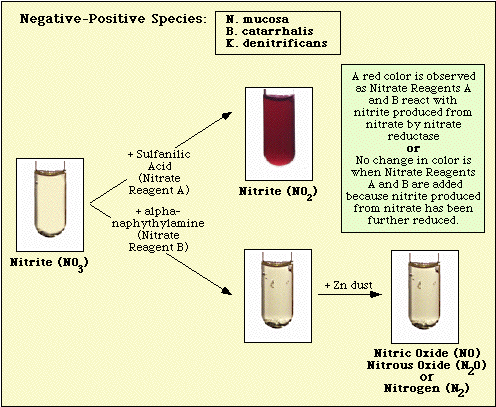
A beoltatlan közegkontrollal, valamint nitrát-negatív és nitrát-pozitív izolátumokkal megfigyelt reakciókat a 3., a 4. és az 5. ábra szemlélteti.
3. ábra. A beoltatlan nitrátközeggel megfigyelt reakció.
4. ábra. Nitrát-negatív fajokkal megfigyelt reakció.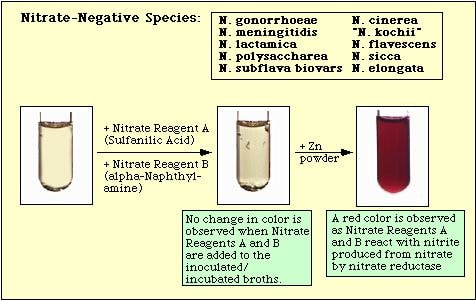
5. ábra. Nitrát-pozitív fajokkal megfigyelt reakciók.
Minőségellenőrzési ütemterv:
- A nitrátreduktáz QC-tesztet minden nap elvégzik, amikor klinikai izolátumokat vizsgálnak.
Problémák & Megoldások
A nitrátredukciós teszt hamis negatív vagy hamis pozitív eredményeket adhat, ha a táptalajt nem pontosan állítják elő vagy a tesztet nem pontosan végzik. A reakció ebben a tesztben számos tényezőtől függ.
- Az, hogy a Zn-por hozzáadása után a beoltatlan közeg kontrollcsövében nem észlelhető rózsaszínű szín, annak oka lehet, hogy (1) a közeg nem tartalmaz nitrátot, vagy (2) túl sok cinkport adtunk hozzá, amely katalizálta a nitrát nitriten túli redukcióját nitrogéngázokká. A legegyszerűbb megoldás, ha több nitrátos közeget kapunk, biztosítva, hogy az alapközeghez nitrátot adjunk. Alternatív megoldásként beoltjuk a táptalajt egy pozitív kontroll törzzsel, de rövidebb inkubációs idő után vizsgáljuk meg a reakciót; a N. mucosa törzsek néhány órás inkubáció után pozitív nitritreakciót produkálnak. Ha bebizonyosodik, hogy a táptalaj nitrátot tartalmaz, ismételje meg a tesztet, amíg meg nem határozza a hozzáadandó cinkpor megfelelő mennyiségét. Kritikus fontosságú, hogy megtudja, mennyi cinkport kell hozzáadni a teszthez. Túl sok cinkpor hozzáadása hamis pozitív eredményt eredményezhet.
- Ha az A és B nitrátreagensek közeghez való hozzáadása után rózsaszínű színt észlelünk a beoltatlan közeg kontrolljában, akkor a közeg nitrittel szennyezett. Az egyetlen megoldás egy új tétel nitrittel nem szennyezett táptalaj beszerzése.
- Nitrátot tartalmazó táptalajban a pozitív kontrolltörzs, a Kingella denitrificans pozitív reakciójának elmaradása csak akkor fordulhat elő, ha a törzs nem K. denitrificans. Ellenőrizzük újra a pozitív kontrolltörzs azonosságát. Válasszon egy új tenyészetet a kontrolltörzsből, és ismételje meg a vizsgálatot. Hasonlóképpen, ha a negatív kontrolltörzzsel, a N. gonorrhoeae-vel pozitív nitrátreduktáz-tesztet kapunk, akkor vagy a negatív kontrolltörzs nem N. gonorrhoeae, vagy a tenyészet nitrátpozitív organizmussal szennyezett. Ellenőrizze újra a gonokokkusz-referenciatörzs tisztaságát és azonosságát. Ismételje meg a vizsgálatot a N. gonorrhoeae megerősített tenyészetének tiszta tenyészetével.
- A nitrátredukciós reakció jelzi a szervezetek nitrátredukciós képességét, amely reakció csak anaerob körülmények között megy végbe; a reakció nem megy végbe, ha a szervezetek folyamatos oxigénellátást kapnak. Így a reakció nem fordulhat elő olyan nyugalmi kultúrákban (különösen a lassú növekedésű fajok esetében), amelyekben a táptalaj sekély rétegekben van elosztva, amelyek lehetővé teszik az oxigén diffúzióját a táptalajba. Annak megállapítására, hogy van-e oxigén a táptalajban, egy csepp oxidázreagens hozzáadásával lehet tesztelni a táptalajhoz. Ha a közeg lilára színeződik, a közeg oxigént tartalmaz, és a nitrátredukciós reakció nem következhet be. Ha a közeg színtelen marad, a közeg nem tartalmaz oxigént, és a nitrátredukciós teszt elvégezhető. Megfigyelték, hogy a N. gonorrhoeae sejtek gyorsan elhasználják az oxigént, ha elegendő sejtet oltanak a táptalajba. Ha körülbelül 1-2 órás inkubáció után oxidázreagens hozzáadására kerül sor, a közeg tiszta marad. Mivel az oxidázreagens elpusztítja a közegben lévő gonokokkuszokat, a közeg a cső tetejétől kezdve fokozatosan lilává válik, ahogy az oxigén a közegbe diffundál. Ha a tápfolyadékot a fent javasoltaktól eltérő méretű csövekbe adagoljuk, győződjünk meg arról, hogy a felület-mélység arány legalább a fent javasoltakkal megegyező vagy annál kisebb. Ha a cső átmérője, amelybe a tápfolyadékot adagoljuk, nagyobb, mint a fent leírtak, használjunk nagyobb mennyiségű tápfolyadékot, hogy ugyanazt a felület-mélység arányt tartsuk fenn.
-
A nitrátredukciós reakció nem következhet be, ha a tápfolyadék, amelyben a vizsgálatot végezzük, nem teszi lehetővé a szervezet normális növekedését. A teszt azonban elvégezhető olyan közegben is, amely nem támogatja az organizmusok növekedését, ha az inokulum elég sűrű ahhoz, hogy az előképzett enzimek kimerítsék a meglévő oxigénkészletet, és gyorsabban redukálják a nitrátot, mint ahogyan az oxigén a közegbe diffundál.
Megjegyzés: Annak ellenőrzéséhez, hogy az oxigén eltávolításra került-e a közegből, adjunk 2-3 csepp oxidázreagenst a beoltott közeg egy duplikátumához. Ha az oxigén megfelelően eltávolításra került a közegből, az oxidázreagens nem fog azonnal lilára színeződni. Ha a táptalaj oldott oxigént tartalmaz, az oxidázreagens lilára színeződik. Vegye figyelembe azt is, hogy a nitrátredukciós tesztet olyan közegben is el lehet végezni, amelyhez az oxidázreagens már hozzá lett adva.
- Az A reagensnek a vizsgálati közeghez történő hozzáadásakor a nitrát redukciójának eredményeként keletkező nitrit komplexet képez a szulfanilsavval, amely a B reagensben lévő alfa-naftilaminnal vörös csapadékot képez. A vörös szín jelenléte a vizsgálati közegben azt jelzi, hogy a nitrát redukciójának eredményeként nitrit van jelen. A vörös szín hiánya az A és B reagensek hozzáadása után azonban nem feltétlenül jelenti azt, hogy a nitrát nem redukálódott. A vörös szín kialakulásának elmaradása azt jelentheti, hogy 1) a nitrát nem redukálódott, vagy 2) a nitrát redukciójának eredményeként keletkező nitrit maga is nitrogéngázokká redukálódott. Annak megállapításához, hogy a nitrit redukálódott-e, tegyünk kis mennyiségű cinkport az inkubációs keverékbe, ha az az A és B reagensek hozzáadása után színtelen. A cinkpor katalizálja a nitrát nitritté történő redukcióját; a még nem redukált nitrátot tartalmazó közegben vörös színnek kell kialakulnia. Fontos azonban, hogy ne adjunk hozzá túl sok cinkport; a felesleges cinkpor katalizálja a nitrátból keletkező nitrit redukcióját, ami színtelen közeget eredményez, és a tesztet tévesen pozitívnak értelmezi (hamis pozitív eredmény).
- A negatív kontroll törzzsel, a N. gonorrhoeae-vel kapott pozitív nitrátreduktáz teszt a cinkpor hozzáadása után azt jelzi, hogy a nitrát a nitriten túl redukálódott, valószínűleg azért, mert túl sok cinkport adtunk a teszthez. Ismételje meg a tesztet, ügyelve arra, hogy nagyon kevés cinkport adjon hozzá. A rózsaszín szín, amely azt jelzi, hogy a szervezet nem redukálta a nitrátot, 10-15 perc alatt alakulhat ki. Ne adjon hozzá több cinkport! Várja meg a szín kialakulását. Ha 30 perc alatt nem alakul ki szín, a tesztet pozitívnak kell értelmezni.
A teszt korlátai
Ha a tesztet megfelelően végzik, és a minőségellenőrző törzsek megfelelő eredményeket adnak, a tesztnek nem lehetnek korlátai. Gondoskodni kell arról, hogy a teszt minden összetevője megfelelően legyen elvégezve.
A nitrátredukciós teszt alapján önmagában nem lehet nemzetséget vagy fajt azonosítani.
Eredmények, értelmezés és jelentés
Az izolátumokat nitrátpozitívnak lehet jelenteni, ha az A és B reagensek hozzáadása után nitritet (rózsaszínű színt) észlelünk az oltott táptalajban, vagy ha a cinkpor hozzáadása után nem észlelünk színt a táptalajban.
Az izolátumokat Nitrát-negatívként lehet jelenteni, ha az A és B reagensek hozzáadása után nem mutatható ki nitrit (nincs színváltozás), vagy ha a beoltott táptalajban a cinkpor hozzáadása után rózsaszín szín alakul ki.
Bibliográfia
Knapp JS, Clark VL. A Neisseria gonorrhoeae anaerob növekedése nitritredukcióval párosulva. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Útmutató a baktérium nemzetségek azonosításához. The Williams & Wilkins Co., Baltimore, MD.