Klinikai előzmények
Két ornitin-transzkarbamiláz-hiányos, karbamidciklus-zavarban szenvedő beteg került intenzív osztályunkra 12 hónapon belül. Mindketten korábban egészséges férfiak voltak, akik kezdetben kisebb beavatkozásokat követően jelentek meg nem körülírható, de progresszív neurológiai tünetekkel (az esetek összefoglalása az 1. keretes írásban).
Mindkét betegnél a kezdeti neurológiai tünetek (fejfájás, szellemi lassúság, koordinációs zavar) körülbelül 24-48 órával a valószínű kiváltó ok után jelentkeztek, ami mindkét esetben egy-egy adag kortikoszteroid volt. Az 1. betegnél az álmosság 48 órával később inkoherenciává, homályos látássá és súlyos nyugtalansággá fokozódott, ami 2 nappal később intubálást tett szükségessé. A 2. betegnél a 48 órás fejfájás, hányinger, homályos látás és epigasztrikus fájdalom a következő 2 napban zavartságba és lassú beszédbe torkollott; a következő napra kóma alakult ki, ami intubálást igényelt.
A perifériás kórházba való beszállításkor mindkét betegnél kiterjedt patológiai vizsgálatokat végeztek, beleértve a vérvizsgálatokat (teljes vérkép, vesefunkciós vizsgálatok, májenzimszintek, véralvadási profil és gyulladásos markerek), lumbálpunkciót és agyi képalkotó vizsgálatokat (komputertomográfia és mágneses rezonancia képalkotás). E vizsgálatok eredményei mind rendben voltak.
A jelentős hyperammonaemia azonosítása körülbelül 36-48 órával a kórházba kerülés után történt. A betegek kómában voltak, amikor kórházunkba szállították őket. Az 1. beteg hosszabb ideig tartózkodott intenzív osztályunkon, tartósan minimális tudatállapotban; a 2. beteg agyhalált és szervdonációt szenvedett.
Az orvosok ismerik a hyperammonaemia leggyakoribb okait, beleértve a májbetegséghez társuló fokozott fehérjeterhelést és a gyógyszerek, például a nátrium-valproát okozta karbamidciklus enzimzavarokat. A vér emelkedett ammóniaszintjének ritkább, de fontos okai az öröklött karbamidciklus-rendellenességek (UCD). A legsúlyosabb formák a korai életkorban jelentkeznek, de e rendellenességek enyhébb formái felnőttkorban is jelentkezhetnek.
AzUCD-k az anyagcsere veleszületett hibáinak egy csoportja, amelynek becsült teljes előfordulási gyakorisága 1:80001 és 1:30 0002 születés között van. A karbamid bioszintézisében részt vevő hat enzim vagy két transzportfehérje bármelyikének működési zavara okozza, amely folyamat túlnyomórészt a májban zajlik. A karbamidciklus az aminosav-katabolizmus során keletkező ammónia ártalmatlanításának végső útvonala. Az ammónia neurotoxikus, és a vérszint 50 μmol/l feletti akut emelkedése neurológiai tüneteket okozhat. Míg a 100 μmol/L feletti ammóniaszint obtundációt okozhat, az enyhébb emelkedéseket az előfordulásuk klinikai kontextusában kell értelmezni.
A két betegünket érintő UCD ornitin-transzkarbamiláz (OTC) hiány volt, amely a leggyakoribb a karbamidciklus rendellenességei közül. Az OTC-hiány X-kromoszómához kötött tulajdonság, ezért gyakrabban fordul elő férfiaknál, bár a női hordozók dekompenzálódhatnak jelentős stressz, például szülés után.3 A többi UCD autoszomális recesszív tulajdonság.4
A felnőttkori első megjelenés a hiány enyhébb fokának tulajdonítható, és gyakran a fehérjebevitel önkorlátozásának is, mint tanult viselkedésnek, amely lehetővé teszi a stabilitást, amíg egy környezeti stresszor nem lép fel. A karbamidciklus fokozott igénybevételéhez vezető állapotok, mint például a fehérjeterhelés, fertőzés, szisztémás kortikoszteroidok, gyors fogyás, műtét, trauma és kemoterápia,5 mind előidézhetik a dekompenzációt az UCD-ben szenvedő egyéneknél. Ebben a folyóiratban 2007-ben számoltunk be egy 44 éves férfi esetéről, aki korábban nem diagnosztizált OTC-hiányban halt meg koszorúér-bypassműtét után.6
A cikkünkben leírt két beteg esetében egyetlen, de jelentős véletlenszerű kortikoszteroidadag volt a kiváltó esemény, a hosszan tartó koplalás pedig állandósította az ördögi metabolikus ciklust, amely súlyos hyperammonaemiában csúcsosodott ki.
Felnőtteknél a hyperammonaemia pszichiátriai vagy neurológiai tünetekkel jelentkezhet, beleértve a fejfájást, zavartságot, agitációt harcias viselkedéssel, dysarthria, ataxia, hallucinációk és látáskárosodás,3 amelyek toxikus metabolikus encephalopathiát tükröznek. Az idegrendszeri jelenségeket hasi tünetek (hányinger, hányás) kísérhetik.
Két esetünk jól illusztrálja a progresszív hyperammonaemia lefolyását, ha a kezelést nem kezdik meg időben: súlyosbodó kognitív károsodás és agyi ödéma, majd kóma, görcsrohamok és az intrakraniális hipertónia miatti halál kialakulásával.
Ha a beteg kognitív zavarának aránytalan és progresszív jellegére nincs alternatív magyarázat, ezt fontos jelzésnek kell tekinteni a metabolikus etiológia lehetőségének feltárására. Mivel a hanyatlás napok alatt következik be, van lehetőség életmentő beavatkozásra, ha az állapotot időben felismerik.
A vér ammóniaszintjének mérését a metabolikus szűrés részeként ilyen esetben a lehető leghamarabb el kell végezni. Ha az ammóniaszint emelkedett, anyagcsere-specialistával kell konzultálni, plazma aminosavprofilt kell készíteni, vizeletből szerves savakat és orotsavat kell mérni, és sürgősségi kezelést kell kezdeményezni a hyperammonaemia miatt.
A karbamidciklushoz kötött hyperammonaemiás kóma kezelésének három eleme a következő:
-
az ammónia fizikai eltávolítása hemodialízissel vagy hemodiafiltrációval;
-
a katabolikus állapot megfordítása inzulin/dextróz és intralipid infúzióval; és
-
a fehérje átmeneti visszatartása és a nitrogénmegkötők megkezdése, amint rendelkezésre állnak.
Ezeket az intézkedéseket metabolikus orvos irányításával kell megkezdeni, és olyan intenzív osztályon, ahol az agitáció vagy a kóma kezelhető. Az ammóniaszint dialízissel gyorsan csökkenthető; eltávolítása az áramlási sebességtől függ, így az intermittáló hemodialízis a leghatékonyabb eltávolítási módszer, amint azt a 2. keretes írás mutatja. Emiatt a sürgősségi környezetben az ammónia korai ellenőrzésére a folyamatos vénás hemodiafiltráció helyett az intermittáló dialízist javasoljuk.
Míg a kezelés kezdetén a súlyos neurológiai károsodás nagy aggodalomra ad okot, ez önmagában nem lehet ok a kezelés visszatartására, mivel a jó neurológiai felépülés lehetséges. Ezt illusztrálja egy középkorú beteg esetbeszámolója, aki a kezelés megkezdésekor a dekortikális testtartás ellenére is felépült.5
Szorgalmazzuk az ammóniaszint korai értékelését azoknál a betegeknél, akiknek megmagyarázhatatlanul megváltozott a tudatállapota, vagy ha kognitív zavaruk aránytalannak tűnik bármely egyidejűleg fennálló szisztémás betegséghez képest. Az ellátás számos szükséges eleme megkezdhető a nem tercier intenzív osztályokon is. A kezelés megkezdése a kórházban, ahol a beteg megjelenik, alapvető fontosságú, mivel ez egy orvosi vészhelyzet; a neurológiai kimenetel és a túlélés döntően a beavatkozás időzítésétől függ. Korai felismerés és megfelelő kezelés esetén a neurológiai felépülés prognózisa jó.
Tanulságok a gyakorlat számára
-
A karbamidciklus-zavarok először felnőttkorban jelentkezhetnek, és olyan kiváltó okok, mint szisztémás betegség, fokozott fehérjeterhelés, műtét vagy kortikoszteroidok leplezhetik le őket.
-
Az ammóniaszint mérése egyszerű, de kritikus vizsgálat a megmagyarázhatatlan tudatzavarban szenvedő betegeknél.
-
A szakaszos hemodialízis igen hatékony az ammónia gyors kontrollja szempontjából, és a gyors korrekció szempontjából jobb, mint a folyamatos hemodiafiltráció.
-
A hyperammonaemia sürgősségi kezelését korán el kell kezdeni a pusztító neurológiai károsodás megelőzése érdekében.
1. doboz – A két beteg kórtörténete
1. beteg: 24 éves, férfi
Egészségügyi előzmények
- Obstruktív alvási apnoe; nincs említésre méltó családi előzmény; magasan funkcionáló egyén
- Vélhetően precipitáns:
Következmény
- Műtét után 48 órával bizonytalanság és letargia, ami 24 óra alatt inkoherenciává vált
- 12 órával később súlyos nyugtalanság miatt intubálták
- GCS a következő 48 óra alatt 5-6-ra csökkent; ammóniaszint 334 μmol/l (RR, < 50 μmol/l); betegségspecifikus kezelés megkezdése
- 6 órával később megemelkedett intrakraniális nyomás (tág pupillák, agyi ödéma az agyi CT-n), ami frontális vérömlennyel szövődve dekompresszív craniectomiához vezetett, ami kiürítést igényelt
- Hosszú intenzív osztályos és kórházi tartózkodás
Kimenetel
- Minimálisan eszméletlen állapotban maradt (22 hónaposan)
- Elbocsátották az ápolási intézménybe
- A plazma és vizelet biokémiai elemzése összhangban volt az OTC hiányával (emelkedett vizelet-orotinsav; magas plazma glutaminszint; alacsony plazma ornitin-, citrullin- és argininszint)
- A genetikai vizsgálat megerősítette az OTC gén mutációját, amely az OTC hiányhoz társul
2. beteg: 39 éves, férfi
Kórelőzmény
- Krónikus térdfájdalom; nincs említésre méltó családi előzmény; magasan funkcionáló egyén
- Vélhetően precipitáns: Fejfájás, hányinger, epigasztrikus fájdalom, homályos látás és koordinációs zavar 48 órával az injekció beadása után
- A következő 48 órában zavartságig fokozódott
Progresszió
- , lelassult beszéd
- A GCS progresszív csökkenése, intubálást igényelt
- Görcsös aktivitás
- Újabb agyi CT agyi ödémát mutatott
- Ammóniaszint: 652 μmol/L (RR, < 50 μmol/L); betegségspecifikus kezelés megkezdése; intrakraniális nyomásmonitor behelyezése; az intrakraniális hipertónia kontrolljának hiánya; palliatív döntés
Kimenetel
- Agyhalál és szervdonáció (kivéve májdonáció: ellenjavallt)
- A biokémiai leletek összhangban vannak az OTC hiányával (a vizelet orotsavszintjének mély emelkedése, a plazma glutaminszintje magas, az argininszint alacsony)
- A genetikai vizsgálat megerősítette az OTC gén mutációját, amely az OTC hiányhoz társul
GCS = Glasgow coma score; RR = referencia tartomány; CT = komputertomográfia; OTC = ornitin-transzkarbamiláz.
2. doboz – Két betegünk ammóniaszintje és a kezelésre adott válaszuk*
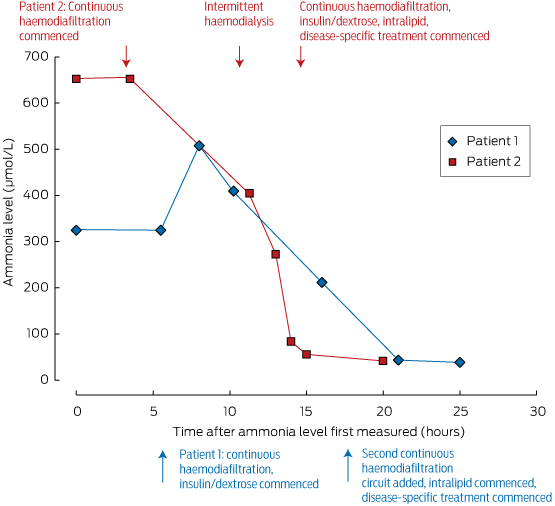
* Figyeljük meg a szérum ammóniaszintjének gyors csökkenését a 2. betegnél, amelyet az intermittáló hemodialízis megkezdése után (körülbelül 10 órával az első mérés után) értünk el.
.