A guanozin-trifoszfát (pontosabban guanozin-5′-trifoszfát, vagy az egyszerűség kedvéért általában GTP rövidítve is) egy nagy energiájú nukleotid (nem tévesztendő össze a nukleoziddal), amely a citoplazmában található vagy a guanin bázist alkotva polimerizálódik.
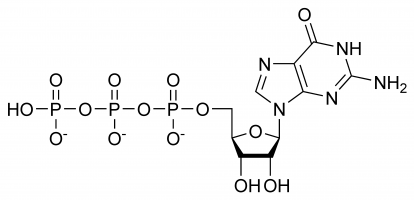
A GTP-nek szelektív szerepe van az RNS-szálak kialakításában, a fehérjeszintézis energiahordozó molekulájaként, koenzimként, a cGMP elődjeként – másodlagos hírvivő molekulaként vagy effektormolekulaként működik. Az utóbbi kettőt általában G-fehérje-modulációval mutatják ki. Mindezek összetett háromdimenziós szerkezetének és a különböző kémiai csoportok sokféleségének köszönhetőek, amelyekből áll. Az egyszerűség kedvéért ezért úgy gondolhatunk rá, mint különböző funkcionális csoportok sokaságára, amelyek gyakorlatilag egymástól elszigetelten különböző funkciókat látnak el (bár időnként a szerkezet is szerepet játszik, pl. amikor kölcsönhatásba lép egy enzimmel és egy másik szubsztráttal), pl. csak a trifoszfát vesz részt a polimerizációhoz szükséges energia felszabadításában, míg csak a guanin bázis vesz részt a deaminálásban. Fontos megjegyezni, hogy az elején megadott lista nem tartalmazza a kémiai kölcsönhatásokat, hanem csupán különböző képességeinek bemutatására szolgál.
A GTP-ben a ribózcukor központi szerepet játszik a kovalens kötésű guanin és trifoszfát molekulák háromdimenziós elrendezésében. Ez a monoszacharid hidroxilcsoportokat biztosít a kondenzációs reakciókhoz és nukleofil támadásokhoz, amelyek közül az utóbbi fontos az RNS-molekulák pusztulásához és így a génexpresszió szabályozásához. A guaninmolekula és a trifoszfát a C’1, illetve a C’5 atomoknál kovalens kötéseket képez, azonban más hidroxilcsoportok felhasználása is lehetséges, amennyiben a kialakuló szerkezet nem okoz összeütközést. A purin szempontjából egy kondenzációs reakció eredményeként kötődik a 9’N-jénél, amely korábban kovalens kötésben volt egy hidrogénatomhoz. Mivel a guanin egy purin bázis, az adenin-trifoszfáttal (ATP) együtt a purin-trifoszfátok közé sorolható, és az inozin-monofoszfát módosításával jön létre.
Tartalom
- 1 Tévhit: GTP, egy alapvető építőelem
- 2 Egy a sok RNS-bázis elődje közül
- 3 GTP; az univerzális ATP unokatestvére
- 4 A jelátvitel egyik forrása
- 5 Hivatkozások
Tévhit: GTP, egy alapvető építőelem
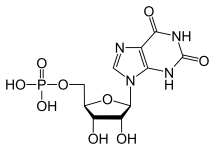
A máj a fő szerv, amely a purin- és piramidin-nukleotidokat szintetizálja. A purin nukleotidok (GTP és ATP) úgy szintetizálódnak, hogy először ATP-ből, glutaminból, glicinből, CO2-ből, aszpartátból és formiátból inozin-monofoszfátot hoznak létre. Az IMP
ezután módosítható, hogy bármelyik molekula keletkezzen.
A GTP képződés esetében az IMP-t először az IMP-dehidrogenáz alakítja át XMP-vé. Az így létrejövő kémiai és szerkezeti változás lehetővé teszi a GTP-szintáz működését, amely az XMP-t gyorsan GMP-vé alakítja. A GMP azonban nem nagy energiájú molekula, mivel nem rendelkezik trifoszfáttal, ezért aztán a nukleozid-foszfát-kinázok foszforilálják, hogy először egy difoszfátot, majd végül egy trifoszfátot kapjanak.
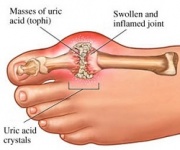
A GTP általában oldhatatlan húgysavvá katabolizálódik, amely aztán a vizeletben nátrium-urátkristályok formájában keletkezhet. Ez a folyamat kórosnak tekinthető, ha a szinoviális ízületekben zajlik, és húgysav keletkezik, amely aztán káros mononátrium-uráttá vagy kalcium-pirofoszfát-dihidráttá alakul. Az ilyen vegyi anyagok jelenléte lehetővé teszi a gyulladás és az ízületi gyulladás kialakulását, és a kombinált tünetek a betegség köszvényként való besorolásához vezetnek. A megfelelő purin nukleotidkatabolizmus fontosságának másik példája a súlyos kombinált immunhiányos betegség, amely az esszenciális B- és T-limfociták pusztulásához vezet
Egy a sok RNS-bázis elődje közül
Az RNS és a DNS között számos különbség van, de az elsődleges különbség az egyes polimereket felépítő nukleobázisok szerkezetében van. Az RNS nukleobázisok a ribózcukron egy 2’OH-csoportot tartalmaznak, ami lehetővé teszi, hogy kémiailag lényegesen reaktívabbak, katalitikusabbak és instabilabbak legyenek. Fontos megjegyezni, hogy a guanozin-trifoszfát csak a guanin bázis előállításával foglalkozik az RNS-ben. A GTP analógja a DNS-ben a guaninbázis képződéséhez a dezoxiguanozin-trifoszfát. Ez a trifoszfát dezoxiribóz cukrot tartalmaz,
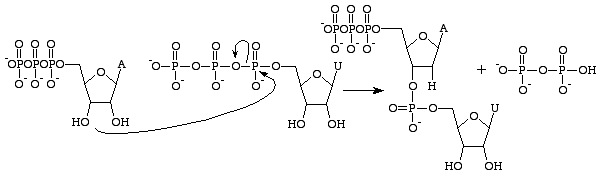
2’OH csoport nélkül, ami lényegesen stabilabbá teszi – megakadályozza a nukleofil támadásokat, amelyek a nukleobázisok közötti foszfodiészterkötéseket hasítanák. Ez ideális, mivel az RNS-nek szét kell bomlania, miután fehérjévé fordították, míg a DNS-nek érintetlenül kell maradnia a genetikai információ leánysejtre történő átviteléhez.
A guanozin-trifoszfát egy anhidridkötés hasadása következtében guaninbázist képez, és szabad foszfátokként alfa- és gamma-foszfátokat szabadít fel. A GMP ezután foszfodiészterkötést képez a közeli 3’OH-csoportot tartalmazó bázissal, és 3’OH-csoportot szolgáltat a következő RNS-bázis számára. Ez a reakció csak akkor következik be, ha a GMP-vel ellentétes bázis a citozin, amellyel hidrogénkötést tud kialakítani, és amelynek sebességét az RNS-polimeráz növeli. Az RNS-polimeráz nem igazítja a trifoszfátokat. Csupán katalizálja a reakciót, amely azután következik be, hogy ez önállóan megtörtént. A katalízis után a molekula egy polinukleotidlánc része, és már nem GTP-ként, hanem guanin bázisként ismert.
GTP; Az univerzális ATP unokatestvére
Az anhidridkötés hasadásából származó energia kinyerésének mögöttes mechanizmusa minden trifoszfát esetében azonos. A trifoszfátok magas energiatartalmát három különböző mechanizmus révén érik el. Az első az egyes foszfátcsoportokra ható taszító erőknek
köszönhető. Ez hozzájárul a kötött trifoszfátok nagyfokú instabilitásához és az alacsonyabb energiájú állapot elérésének nagyfokú “vágyához”. A második a rezonancia-stabilizációnak köszönhető. Amikor a GTP
GDP-vé alakul, a meglévő elektronpárok lehetséges pozícióinak száma megnő, ami nagyobb stabilitást kölcsönöz. Ez az érv a GDP GMP-vé történő átalakításakor is érvényesül. A harmadik a foszfátok megnövekedett mennyisége által a molekulát körülvevő vízmolekulák konformációjára gyakorolt kedvezőtlen entrópikus hatásnak köszönhető.
Mivel a GTP koncentrációja a citoplazmában lényegesen alacsonyabb, mint az ATP-é, ezért a sejtek anyagcsere-folyamataiban speciális funkciókat lát el.
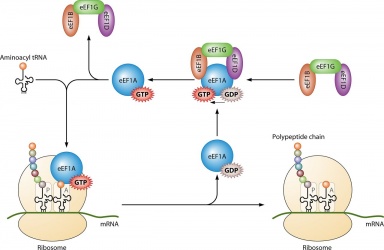
Elsődleges felhasználása a fehérjeszintézisben van, amikor a riboszómális iniciáció során az IF2-vel, az Ef-Tu-val és az Ef-G-vel az elongáció során és ;az RF3-mal a termináció során párosul. Az összes GTP molekula, amely az említett fehérjékkel kötődik, defoszforilálódik, ami GDP-t és szabad foszfátot eredményez
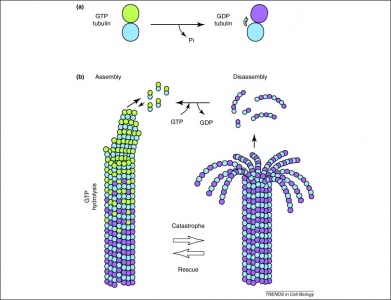
A GTP-t emellett a tubulin dimerek is hasznosítják a mikrotubulusok kialakításában. A tubulin dimerek alfa- és béta-tubulinból állnak, amelyek mindegyike rendelkezik GTP-kötőhelyekkel. Mivel a béta-tubulin a filamentum plusz végén található, a GTP mindig itt hidrolizálódik, amikor a hosszabbodó polimerhez egy újabb dimer adódik. Fontos, hogy a GTP hidrolízise gyengíti a tubulin dimerek közötti nem kovalens kölcsönhatásokat, ami megkönnyíti a mikrotubulusok feloldását, ha szükséges. Megjegyzendő, hogy az alfa-tubulin fehérje GTP-je nem defoszforilálódik, így a mikrotubulus szerkezetén keresztül konzisztensnek tekinthető.
A jelátvitel forrása
A GTP specifikus kémiai és térbeli konformációjának felhasználását hatékonyan bizonyítja a jelátvitelben való felhasználása. Elsősorban a különböző jelátviteli útvonal fehérjéinek aktivitását képes megkötni és szabályozni, amelyeket két különböző csoportba sorolhatunk. Az első csoportba a heterotrimer GTP-kötő fehérjék (más néven heterotrimer G-fehérjék) tartoznak, amelyek a G-fehérjéhez kapcsolt receptorok aktiválásakor a GTP-t használják fel a jelátviteli útvonal más fehérjéinek aktivitásának módosítására. A második a monomer GTP-kötő fehérjék (más néven monomer G-fehérjék). Ezek a G-fehérje kapcsolt receptoroktól eltérő receptorokra reagálnak. A magyarázatuk során említett tipikus példa a Ras fehérje. Megjegyzendő, hogy nem csak a specifikus kémia miatt képesek szelektíven megkötni a GTP b-t, hanem az indukált illeszkedés jelensége miatt is. A megkötött GTP aztán egy bizonyos idő után hidrolizálódik, és így a fehérje öninaktiválódását és a jelátviteli útvonal túlzott stimulációjának megakadályozását eredményezi. A GTP hidrolízise után a GDP kötve marad, mivel a konformációs változás a GTP-molekula és a GDP-molekula affinitásának eltolódását eredményezi. Ez azonban egy impernamentális változás, és a G-fehérje kapcsolt receptor általi későbbi aktiválással visszafordítható.
A GTP reaktánsként is felhasználható a cGMP előállításához, amely egy viszonylag gyakori másodlagos jelzőmolekula. A katalízist az NO felszabadulása váltja ki, amely aktiválja a guanilát-ciklázt, egy olyan enzimet, amely GTP-ből cGMP-t állít elő. A cGMP ezután effektorként működhet a fehérjekinázok felé, amelyek foszforilálják és módosítják a specifikus fehérjék működését.
- J Koolman és KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell és P A Weil. Harper’s Illustrated Biokémia. 28. kiadás. Peking, Kína. 2009.
- J Dow, G Lindsay és J Morrison, Biokémia: Molecules, Cells and the Body (Molekulák, sejtek és a test). 1. kiadás. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body (Molekulák, sejtek és a test). 1. kiadás. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body (Molekulák, sejtek és a test). 1. kiadás. Wokingham, Anglia. Addison-Wesley. 1996.
- J Koolman és KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- J Koolman és KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- M W King. Az orvosi biokémia oldala. 2016. szeptember. Idézve: 11:31. 03.12.2016. Elérhető: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell és P A Weil. Harper’s Illustrated Biokémia. 28. kiadás. Peking, Kína. 2009.
- M W King. Az orvosi biokémia oldala. 2016. szeptember. Idézve: 11:31. 03.12.2016. Elérhető: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Az orvosi biokémia oldala. 2016. szeptember. Idézve: 11:31. 03.12.2016. Elérhető: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Az orvosi biokémia oldala. 2016. szeptember. Idézve: 11:31. 03.12.2016. Elérhető: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Az orvosi biokémia oldala. 2016. szeptember. Idézve: 11:31. 03.12.2016. Elérhető: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay és J Morrison, Biokémia: Molecules, Cells and the Body (Molekulák, sejtek és a test). 1. kiadás. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1. kiadás. Wokingham, Anglia. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1. kiadás. Wokingham, Anglia. Addison-Wesley. 1996.
- J Koolman és KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto és R Stryer. Biokémia. Nyolcadik kiadás. Város és ország Ismeretlen. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto és R Stryer R. 2015. Biochemistry. Nyolcadik kiadás. Város és ország Ismeretlen. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Nyolcadik kiadás. Város és ország Ismeretlen. Freeman and Co. 2015.
- T E Dever és R Green. A megnyúlási, befejeződési és újrahasznosítási fázisok az Eukariótákban. CSHPB. July 2012. 4:7:1-16
- B Alberts et al. A sejt molekuláris biológiája. 6. kiadás. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6. kiadás. New York, USA. Garland Science. 2015.
- J Koolman és KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- J Koolman és KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3. kiadás, Stuttgart, Németország. Thieme 2013.