Introduction: A Migrén klinika
A migrén egyoldali fejfájásból áll, amelyet egyéb szenzoros, vegetatív és kognitív tünetek halmaza kísér, és a 2016-os Global burden of disease (GBD) tanulmány a hatodik leggyakoribb betegségként és a rokkantság egyik fő okaként azonosította az egész világon, gyakran fordul elő munkaképes korban és fiatal felnőtt és középkorú nőknél (Collaborators, 2018). Ezért a migrén a fogyatékossággal megélt életévek (YLD) tekintetében nagyon komoly társadalmi problémát jelent, és a 15-49 éves korosztályon belül a legfontosabb oka az YLD-nek (lásd Steiner et al., 2018). Az ilyen betegség terheit egészen a közelmúltig nem azonosították, mivel: a migrén nem okoz tartós fogyatékosságot vagy halált; a fejfájás alkalmanként előfordul az általános népességben (Collaborators, 2018). Bár a migrén pontos patogenezise nem ismert, az extracranialis keringés érintett (Drummond és Lance, 1983). A migrén klinikai lefolyása különböző, egymást követő vagy kísérő szakaszokban artikulálódik: premonitoros, aura, fejfájás és posztdromosz (a premonitoros fázishoz hasonló) (Goadsby és mtsi., 2017a). A premonitoros fázis magában foglalja az ingerlékenységet, az étel utáni sóvárgást, a merev nyakat, és a rohamot megelőző 2-72 óra között jelentkezhet, és a többi fázison keresztül folytatódik. A fejfájás-zavarok nemzetközi osztályozásának harmadik kiadásában (ICHD-3) szereplő meghatározások szerint:
– az aurát egy vagy több átmeneti, reverzibilis neurológiai deficit jellemzi, amelyek közül legalább egynek egyoldalú lokalizációval kell rendelkeznie, amelyek legalább 5 perc alatt alakulnak ki, és amelyek közül mindegyik deficit 5-60 percig tart;
– a migrén 4-72 órán át tartó fejfájásrohamokból áll, amelyeket hányinger, fotofóbia és fonofóbia vagy mindkettő kísér (lásd Goadsby et al., 2017a).
A nem fájdalmas ingereket követő fájdalomérzetként definiált bőrallodinia a betegek több mint 70%-ánál fordul elő (Lambru et al., 2018). A súlyos fejfájás a posztdrómás fázisban csillapodik vagy megszűnik, míg más tünetek, mint az aszténia, a szomnolencia és a fotofóbia továbbra is érintik a beteget, ami a migrén hátterében álló komplex neurális alapot mutatja (Lambru és mtsi., 2018). Az érintett havi napok számától függően a migrént epizodikusnak (kevesebb mint 15 migrénes vagy fejfájós nap) vagy krónikusnak (legalább 15 nap, amelyek közül 8 vagy több migrénes nap) minősítik (lásd Goadsby és mtsi., 2017b). Ez a szempont jelentősen befolyásolja a betegség hatását és a terápiás lehetőségeket (Giamberardino et al., 2017). Havi 1-3 roham esetén csak abortív tüneti gyógyszereket lehet alkalmazni, míg havi 4-14 roham esetén kötelező a megelőző kezelés kiegészítése; ez utóbbi kezelésekre a betegség krónikussá válásának elkerülése érdekében van szükség (Giamberardino és Martelletti, 2015; Giamberardino et al., 2017), valamint a gyógyszeres túladagolásos fejfájás és a refrakter migrén kockázatának csökkentése érdekében (Martelletti, 2017).
A migrén patofiziológiája és a kalcitonin génfüggő peptid (CGRP)
A migrénes rohamok pontos oka még nem ismert, de a jelenlegi kutatások a trigeminovaszkuláris rendszerben és az egész agytörzsben zajló szenzibilizációs folyamatok jelentőségét, valamint a fájdalomfeldolgozó területeken a szürkeállomány csökkenésének megfigyelését emelik ki (lásd Goadsby et al, 2017a). A sejttestet tartalmazó trigeminalis ganglionból pszeudo-unipoláris primer afferensek szinapszisba lépnek az ereken és a trigeminocervikális komplexen, ahonnan másodrendű rostok szinapszisba lépnek harmadrendű thalamocorticalis neuronokon és a locus coeruleuson, a periaqueductalis szürkén és a hipotalamuszon (Goadsby et al., 2017a). A trigeminalis ganglionból és a nyaki háti gyökérganglionokból származó nociceptív rostok innerválják a dura mater ereket, és termináljaik vasoaktív neuropeptideket, például kalcitonin génnel kapcsolatos peptidet (CGRP) bocsátanak ki, ami vazodilatációt indukál. A CGRP, a CLR és a RAMP1 expresszióját a humán dura erekben az 1A-C ábrák mutatják. Az extracerebrális érrendszert innerváló autonóm idegrostok valóban számos neurotranszmitter vazoaktív molekulát tartalmaznak: noradrenalin, szerotonin, acetilkolin, neuropeptid Y (NPY), vazoaktív bélpolipeptid (VIP), substance P (SP), neurokinin A (NU) és CGRP (Goadsby és mtsai., 1990). A CGRP-receptor-antagonisták a dura materből érkező nociceptív információt blokkolva hatnak: azt a thalamicus magokban dolgozzák fel, ahonnan magasabb agykérgi régiókba jut. Ezeket a trigeminovaszkuláris rendszerből származó bemeneteket az agytörzs leszálló pályája modulálja: az 5-hidroxi-triptamin (5HT)1B/1D receptor agonisták, azaz a triptánok feltehetően ezen a rendszeren keresztül hatnak, és ellensúlyozzák a bekövetkezett vazodilatációt. Míg a propranololt és a topiramátot megelőző kezelésként, addig az utóbbi gyógyszereket a migrén akut epizódjaiban alkalmazzák. Különösen az 5HT1B/D preszinaptikus receptorokra közvetlenül ható triptánok vazokonstriktor hatásuk mellett gátolják a nocicepcióban szerepet játszó mediátorok, például a CGRP felszabadulását. Továbbá kísérletileg kimutatták, hogy a szumatriptán gátolja a tranziens receptor potenciál vanilloid 1 (TRPV1) által közvetített befelé irányuló áramot a trigeminális ganglionokban (Evans és mtsai., 2012). A CGRP a migrénes rohamok során szabadul fel, és számos szerepet mutat, mint a legvazoaktívabb neuropeptid, amelynek kraniovaszkuláris szintje megnő a betegség lefolyása során (Goadsby és mtsi., 1990). Kimutatták, hogy a CGRP a cerebrospinális folyadékban is változásokon megy keresztül (van Dongen és mtsai., 2017). A megváltozott központi ingerlékenység kiváltó okait és a migrénes fájdalomepizódok ezt követő kitörését már régóta vizsgálják. Az idegrostok ingerlése ortodromos és antidromos akciós potenciálokat egyaránt elősegíthet, és különösen a tranziens receptor potenciált (TRP) expresszáló duralis peptiderg primer szenzoros afferensek aktiválása számos molekula, köztük a CGRP felszabadulását indukálhatja, amelyek neurogén gyulladásként ismert gyulladásos szöveti reakciókat váltanak ki (Xanthos és Sandkuhler, 2014). A CGRP különösen a koponya nocicepcióban és a vazodilatáció epifenoménjében vesz részt, amely a meningeális és agyi ereken lévő receptoraihoz kötődik (Deen és mtsai., 2017). Ezek a folyamatok elősegítik a trigeminális másodrendű rostok szenzitizációját, amelyek a felerősített fájdalmas ingereket magasabb régiókba, például a talamuszba, a hipotalamuszba és a kéregbe viszik, így keletkezik a migrén (Dussor et al., 2014). A TRP-k számos környezeti irritatív ingerre, mint például hőmérséklet- és pH-változásokra válaszul aktiválódnak, amelyek a hajlamos egyéneknél migrénes fájdalmat válthatnak ki. A CGRP a 11. kromoszómán található, szintén a kalcitonint kódoló CALC I gén szövetspecifikus alternatív splicingje révén termelődik. Ezzel szemben a β CGRP a 11-es kromoszóma egy másik helyén található CALC II génből termelődik. α CGRP neuropeptid a központi idegrendszerben 37 aminosavból álló α izoformaként van jelen, és jelátvitelét két receptor közvetíti.
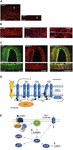
1. ábra. CGRP előfordulása és útvonala a migrénben. A CGRP, a CLR és a RAMP1 expressziója a humán duraerekben: (A) CGRP immunreaktivitás az adventitiában található vékony rostokban; (B) kereszt- és hosszmetszetek, amelyek a RAMP1 expresszióját mutatják a simaizomsejtek citoplazmájában; (C) a CLR és a RAMP1 koexpressziója a simaizomsejt-rétegben. (D) CGRP receptor komponensek és a receptor jelátvitel és internalizáció szempontjából fontos reziduumok. A CGRP-receptort a CLR (kék), a RAMP1 (sárga) és az RCP (narancssárga) alkotja. A funkcionálisan fontos maradékokat egybetűs rövidítésekkel ábrázoljuk. Az aminosavmaradványok számozása az előre jelzett N-terminális szignálpeptid kezdetétől kezdődik (Swiss-Prot Q16602). A CLR C-terminusán belül több aminosav (∼N400-C436) és az ICL3/TM5 találkozásánál lévő I312 aminosav szükséges a hatékony CGRP-mediált internalizációhoz. A CGRP-receptor fontos jellemzőit, köztük a TM6 “csomót” (P343) és a CLR feltételezett nyolcadik hélixét (∼G388-W399) illusztráljuk. C′, C-terminális; ECL, extracelluláris hurok; ICL, intracelluláris hurok; N′, N-terminális; TM, transzmembrán. (E) CGRP receptor által közvetített intracelluláris jelátvitel: A Gαs jelátvitel növeli az AC (zöld) aktivitását, emelve az intracelluláris cAMP-ot, aktiválva a PKA-t és ezt követően számos potenciális downstream effektor működését. Az (A-C) panelek Eftekhari és munkatársai (2013), illetve a (D,E) panelek Walker és munkatársai (2010) engedélyével készültek.
Az elsőt kanonikus CGRP-receptorként ismert Gαs fehérjéhez kapcsolt receptor, amelynek működéséhez a receptor aktivitást módosító fehérje (RAMP) 1 szükséges (Goadsby és munkatársai, 2017a). A második a humán amilin 1-es altípusú receptor (AMY1): az amilin a kalcitonin géncsaládba tartozik, és hormonális aktivitással rendelkezik. Amikor a CGRP a receptorához kötődik, a β-arrestinnel való komplexképzés után dynamin/clathrin-függő internalizációnak van kitéve (lásd Walker és mtsai., 2010). Konformációs változások következnek be, amelyek az adenilát-cikláz (AC) aktiválódását, a cAMP növekedését és a protein-kináz A (PKA) aktiválódását idézik elő, ami az endoteliális nitrogén-oxid-szintáz és a fájdalomválaszok közvetlen aktiválásán keresztül elősegítheti az értágulást. Ez utóbbi receptor a Gαq/11-hez kapcsolódhat a foszfolipáz C (PLC) aktiválásával, a mitogén-aktivált protein kinázhoz (MAPK) és az NO felszabadulásához (lásd Walker és mtsai., 2010) (a CGRP receptor által közvetített intracelluláris jelátvitel sematikus ábrázolását lásd az 1D,E ábrán). A CGRP adása migréneseknek rohamokat vált ki, és ez a bizonyíték alátámasztja a migrén patogenezisében betöltött központi szerepét (Lassen és mtsai., 2002). Egy jelmegszakító rendszert még nem azonosítottak: A CGRP-t a neprilizin, az inzulint lebontó enzim és az endotelin-konvertáló enzim-1 metabolizálja, és feltételeztek egy újrafelvételi aktív transzportrendszert is (lásd Russell és mtsai., 2014). Továbbá, amikor a receptort átmenetileg aktiválja a CGRP, az endoszómákba internalizálódik, és gyorsan visszakerül a sejtmembránba, míg a receptor krónikus stimulációja deszenzitizációt és lizoszomális degradációt indukál (lásd Russell et al., 2014).
Farmakológiai beavatkozások a CGRP útvonalon
A migrén egy sokrétű, rokkantságot okozó neurovaszkuláris zavar, és a jelenlegi, orális triptánokkal végzett terápia hatékony az akut rohamokban, bár a betegek mintegy 40%-a rezisztens a kezelésre (Ferrari és mtsi., 2001; Edvinsson, 2015). Ezek a szelektív 5-HT1B/1D agonisták, amelyek közül a leggyakrabban használt a főként szubkután úton ható szumatriptán, terápiás hatásukat a koponyaerek vazokonstrikcióján, valamint a trigeminális és trigeminocervikális rendszer gátlásán keresztül fejtik ki (lásd Ferrari és mtsi., 2001). Az érszűkület azonban határt jelent e gyógyszerek kardiovaszkuláris mellékhatásainak. Továbbá a triptánokkal való kezelés nem tarthat tovább havi 9 napnál a gyógyszer okozta fejfájás kockázata miatt. 2010-ben az Élelmiszer- és Gyógyszerügyi Hivatal (FDA) engedélyezte az A-típusú botulinum toxin (BoNT-A) alkalmazását a migrén megelőzésére nem reagáló krónikus migrénes betegeknél, azonban bonyolult adagolása (31 helyen kell beadni) korlátozza a betegek compliance-ét. A CGRP-nek a migrén patofiziológiájában játszott kulcsfontosságú szerepe miatt kifejlesztették receptorának antagonistáit. Ezek a gyógyszerek a gepantok osztályába tartoznak. A Telgecepant, az első orális gepant jól tolerálható volt a koszorúér-betegségben szenvedő migrénes betegeknél (ClinicalTrials.gov NCT00662818, Ho és mtsai., 2012), de májtoxicitást mutatott, ezért az e kis molekulák folyamatos kutatása ellenére új megközelítést javasoltak, amely a CGRP (nezumabs) vagy a CGRP-receptor (numabs) elleni monoklonális antitestek (mAbs) kifejlesztéséből áll. Ezek a gyógyszerek feltehetően gátolják a keringő CGRP-molekulák hatását a migrénes rohamok megelőzése érdekében, és mivel méretük miatt nem lépik át a vér-agy gátat (BBB), a hatás helyének a trigeminális rendszerben kell lennie (Edvinsson, 2015). Különösen a duralis erek nem tartoznak a BBB-be. Ezenkívül a CGRP valószínűleg nem lépi át a BBB-t, és parakrin modulátorként hat, mivel a trigeminalis ganglion fél neuronjai expresszálják, amelyek nem mutatják a CGRP-receptort, amelyet a szatellit gliasejtek és a trigeminalis ganglion neuronális szóma 30%-a expresszál (lásd Yuan et al., 2017). Jelenleg négy mAb-t, az eptinezumabot, a fremanezumabot, a galcanezumabot és az erenumabot vizsgálják klinikai vizsgálatokban epizodikus és krónikus migrén kezelésére. Az első három mAb a CGRP ellen irányuló humanizált antitest, míg az erenumab a kanonikus receptor ellen irányuló humán antitest. E gyógyszerek felezési ideje meglehetősen hosszú, így havonta legfeljebb egy beadást tesz lehetővé, és ez azért érdekes, mert a mAb-okat intravénásan vagy szubkután módon kell beadni. Különösen az eptinezumabot csak intravénásan lehet beadni (Israel és mtsai., 2018). A III. fázisú PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) vizsgálat (ClinicalTrials.gov NCT02559895) az eptinezumab hatékonyságát vizsgálta a gyakori epizodikus migrén megelőzésében. Az eredmények szignifikáns csökkenést mutattak az elsődleges végpontban, amely a havi migrénes napok (MMD-k) csökkenésében állt az 1-12. hét átlagosan 8,5 napos kiindulási értékéről 4,3 MMD-re 300 mg-os adaggal, 3,9-re 100 mg-os adaggal és 4,0-ra 30 mg-os adaggal a placebo 3,2 napjához képest (Saper és mtsi., 2018). A krónikus migrén megelőzésében alkalmazott eptinezumab értékelésére 1121 résztvevőt vontak be a PROMISE 2 vizsgálatba (ClinicalTrials.gov NCT02974153). A galcanezumab hatékonyságát az epizodikus migrén megelőzésében az EVOLVE-1 fázis 3 kettős vak, randomizált, placebokontrollos vizsgálatban (ClinicalTrials.gov NCT02614183) 4 szakaszra bontva, valamint az EVOLVE-2 fázis 3 randomizált, kontrollált, kettős vak 6 hónapos klinikai vizsgálatban (ClinicalTrials.gov NCT02614196) értékelték. Az EVOLVE-1 vizsgálatban a galcanezumab mindkét dózisa (120 és 240 mg) teljesítette az elsődleges kimenetelt, azaz a havi migrénes fejfájásnapok számának szignifikáns, 4,7, illetve 4,6 napos csökkenését a placebo 2,8 napos értékéhez képest (Stauffer és mtsi., 2018). Az EVOLVE-2 vizsgálatban a betegek havonta 120 vagy 240 mg galcanezumab injekciót kaptak. A havi átlagos migrénes fejfájásnapok száma 4,3, illetve 4,2 nappal csökkent, szemben a placebóval elért 2,3 napos csökkenéssel (p < 0,001) (Skljarevski és mtsi., 2018). A másodlagos végpontok, a migrénspecifikus életminőségi kérdőív (MSQ) Role Function-Restrictive (R-FR) tartományi pontszámán keresztül értékelt funkcionális károsodás csökkenése, valamint a PGI-S (Patient Global Impression of Severity) és a MIDAS (Migraine Disability Assessment; időpont = 6. hónap) pontszámának javulása is teljesültek (Skljarevski és mtsi., 2018). A 120 és 240 mg-os galcanezumabbal kezelt betegek 147 (65,0%) és 163 (71,5%), illetve a placebóval kezelt 287 (62,3%) betegnél jelentkeztek nemkívánatos események, köztük akut miokardiális infarktus és átmeneti iszkémiás roham a galcanezumab 240 mg-os kezelés alatt álló hét betegből álló csoportban (Skljarevski és mtsi., 2018). A szisztolés/diasztolés vérnyomás kiindulási értékhez viszonyított átlagos változásában nem volt statisztikailag szignifikáns különbség. A galcanezumab 120 mg-os, a galcanezumab 240 mg-os és a placebocsoportban 19 (8,6%), 11 (5,1%), illetve 2 (0,5%) betegnél mutattak ki kezeléssel összefüggő gyógyszerellenes antitesteket (ADA). A REGAIN III. fázisú, a galcanezumabot krónikus migrén ellen értékelő vizsgálatban a 120 mg-os adaggal 4,8 nappal, a 240 mg-os adaggal pedig 4,6 nappal csökkent az MMD-k száma, szemben a placebo 2,7 napjával (lásd Yuan és mtsi., 2017). Továbbá a galcanezumabbal végzett kezelésről bebizonyosodott, hogy statisztikailag szignifikánsan tartós hatással rendelkezik (Forderreuther és mtsai., 2018). A fremanezumabot a migrén megelőző kezelésére irányuló III. fázisú HALO vizsgálatban vizsgálták (ClinicalTrials.gov NCT02638103). Az epizodikus migrén MMD-jét 12 hét alatt 3,7 nappal csökkentette 3 hónapon keresztül havi 225 mg-os adagolás mellett, illetve 3,4 nappal 675 mg-os, negyedévente egyszeri adagolás mellett, a placebo 2,2 napos csökkenéséhez képest (lásd Yuan és mtsi., 2017). Az erenumab hatékonyságát az epizodikus migrén megelőzésében a 3. fázisú, randomizált, kettős vak, placebo-kontrollált ARISE vizsgálatban (ClinicalTrials.gov NCT02483585) vizsgálták. A havi 70 mg szubkután 70 mg erenumab 2,9 nappal csökkentette az MMD-k számát a placebo 1,8 napjához képest (p < 0,001), és hatásos volt a másodlagos végpontokban, azaz az MMD-k legalább 50%-os csökkenésében és a havi migrénspecifikus gyógyszeres kezelési napok (MSMD) változásában (Dodick és mtsi., 2018). A mellékhatásokat mutató betegek aránya hasonló volt a mAb-vel és a placebóval kezelt csoportban; 4,3%-uknál a 12. hétig pozitív volt az anti-erenumab-kötő antitestek tesztje, közülük egy beteg átmenetileg pozitív volt semlegesítő antitestekre, de csak a 4. héten (Dodick és mtsi., 2018). A III. fázisú STRIVE klinikai vizsgálat (ClinicalTrials.gov NCT02456740) szintén az erenumab hatékonyságát vizsgálta az epizodikus migrén megelőzésében. Az erenumabot havi 70 vagy 140 mg-os adagban adták 6 hónapon keresztül (Goadsby és mtsi., 2017b). A kiindulási átlagos MMD-k száma 8,3 volt, és a 70 mg-os és 140 mg-os dózisok 3,2, illetve 3,7 nappal csökkentették azt, szemben a placebo 1,8 napjával (p < 0,001 mindkét dózis esetében a placebóval szemben) (Goadsby és mtsi., 2017b) (Goadsby et al., 2017b). A kezelés utolsó 3 hónapja alatt is az erenumab minden egyes adagja teljesítette a másodlagos végpontokat, azaz a kiindulási értékhez képest legalább 50%-kal csökkent a migrénes napok átlagos havi száma, valamint a kiindulási értékhez képest csökkent mind a Migraine Physical Function Impact Diary (MPFID) mindennapi tevékenységek (MPFID-EA), mind a fizikai károsodás (MPFID-PI) (Goadsby és mtsai., 2017b). Az anti-erenumab antitesteket mutató betegek közül a 70 mg-mal kezelt csoportban csak egy betegnél volt pozitív a semlegesítő antitestek tesztje, és a mAb összességében jól tolerálható volt a kreatininszint, a májtoxicitás, az összes neutrofil szám és az elektrokardiográfiás funkció tekintetében (Goadsby és mtsi., 2017b). A szerzők szerint a vizsgálat egyik korlátja, hogy kizárták azokat a betegeket, akik nem mutattak terápiás választ több mint két migrénmegelőző gyógyszercsoportra (Goadsby és mtsi., 2017b). Vannak továbbá klinikai vizsgálatok, amelyek a fremanezumab (NCT02945046 és NCT02964338) és a galcanezumab (NCT 02397473 és NCT02438826) hatékonyságát vizsgálják a cluster-fejfájás megelőzésében (lásd Israel et al., 2018), azaz a periorbitalis területen jelentkező súlyos egyoldali fájdalommal járó, könnyezéssel, kötőhártya-vörösséggel és rhinorrheával járó elsődleges fejfájás (Vollesen et al., 2018). Valóban kimutatták, hogy 1,5 μg/perc CGRP folyamatos intravénás infúziója infúziós pumpán keresztül 20 percig (2 nap alatt, legalább 7 nap különbséggel) epizodikus (aktív vagy remissziós fázisban) vagy krónikus cluster-fejfájásban szenvedő betegeknél cluster-szerű rohamokat váltott ki az aktív fázisban vagy krónikus cluster-fejfájásban szenvedő betegeknél, de nem a remissziós fázisban (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). A mAb-ok fő PK-előnyeit a hosszú eliminációs felezési idő képviseli, így korlátozva a napi adagolás szükségességét és a proteolízis általi clearance-t. A gepantok májra gyakorolt hatásai és a CGRP értágító tulajdonságai miatt a CGRP-szignalizáció gátlásának legfélelmetesebb kockázatai a feltételezett hepatotoxicitásban és a kardiovaszkuláris elméleti kockázatban állnak (Yuan és mtsai., 2017). Az Európai Fejfájás Szövetség (EHF) a Grading of Recommendation, Assessment, Development and Evaluation (GRADE) módszert alkalmazva, és amennyiben ez nem volt lehetséges, egy szakértői testület véleményére támaszkodva iránymutatásokat készített a CGRP-ellenes mAbok alkalmazásáról (Sacco és mtsai., 2019).
A migrén elleni mAbok farmakokinetikai (PK)/farmakodinamikai (PD) összefüggései
A mAbok kifejlesztése teljesen új megközelítést jelentett a CGRP-útvonal gátlására. A kis molekulák helyett a mAb-ok alkalmazásával elért fő PD-javulás az, hogy könnyebb a széles CGRP-receptor-ligandum-kötőhelyet megcélozni (Taylor, 2018). A mAb-ok fő PK-előnyeit a hosszú eliminációs felezési idő jelenti a napi adagolás szükségessége és a proteolízis általi clearance nélkül, a CGRP-szignalizáció gátlásának legfélelmetesebb kockázatai pedig a feltételezett májtoxicitásban állnak, a gepantok májra gyakorolt hatásai miatt, valamint a kardiovaszkuláris elméleti kockázatban, a CGRP értágító tulajdonságai miatt. A mAb-ok gyártásuktól a célpontig vezető útját követően azonban az első akadály, amellyel ezek a molekulák találkoznak, a beadásuk, mivel szájon át való biológiai hozzáférhetőségük csekély. Ezért parenterális beadási útvonalra van szükség, és a kezeléshez való ragaszkodás elősegítése érdekében a felezési időnek hosszúnak kell lennie (Taylor, 2018). Az immunglobulinok (Ig)G1, 2 vagy 4 a lehetőségek (Wang és mtsai., 2008; Taylor, 2018). Az IgG eredetén kívül az esetleges keresztreaktivitás és a katabolizmus egyéni módosításai is befolyásolhatják a felezési időt (Bonilla, 2008; Taylor, 2018). A mAbs előállítására használt technológia a folyamatos osztódásban lévő sejtekből álló hibridómák használatára támaszkodik, amelyek egyetlen antitesttípus meghatározott klónjait termelik, variabilitás nélkül vagy alacsony variabilitással (Taylor, 2018). A mAb-t alkotó aminosavak eredete alapján megkülönböztethetünk kimérikus (rágcsáló immunizáció; a rágcsáló Fragment antigénkötő régió Fab megtartása, de a humán Fragment kristályosítható régió Fc bevezetése), humanizált (zumabok, ahol az egér komplementaritást meghatározó régiók, CDR-ek, a humán Fab régiókra vannak oltva) és humán (a humán antitest gén teljes szekvenciájának bevezetése az egérbe, amely így humanizálódik, mint például a XenoMouse) mAb-ket (lásd Taylor, 2018). A CDR-ek befolyásolják a célponthoz való illeszkedést. A migrén elleni 4 mAb közül csak az erenumab humán, míg a beoltott CDR-ek a fremanezumab esetében egérből, az eptinezumab esetében nyúlból, a galcanezumab esetében pedig valószínűleg egérből származnak (lásd Taylor, 2018). Konkrétan az egyetlen CGRP-receptor elleni mAb az erenumab, amely egy humán IgG2λ, a másik három CGRP-helyek ellen irányuló mAb pedig a következő: eptinezumab, egy genetikailag módosított humanizált IgG1k; fremanezumab, egy humanizált IgG2k; galcanezumab, egy humanizált IgG4 (Edvinsson et al., 2018). Az erenumab (Tmax 3-14 nap) havi szubkután beadást igényel, akárcsak a fremanezumab (Tmax 3-20 nap) és a galcanezumab (Tmax 7-14 nap) (Taylor, 2018). Ezzel szemben az eptinezumabot (Tmax 4,8 h) 3 havonta egyszer intravénásan kell beadni; gyorsabban asszociálódik és lassabban disszociál, mint a fremanezumab és a galcanezumab. Mivel a mAb-k nagy méretű fehérjék, nem tudnak könnyen átjutni a BBB-n. Egyes CGRP-receptorok a BBB-n kívül helyezkednek el, ami lehetővé teszi az anti-CGRP mAb-k hatását (Edvinsson, 2018). A kötődés előtt az antitest pinocitózison keresztül jut be az érrendszeri endotélsejtekbe. A nagy látszólagos eloszlási térfogat függhet a szövetektől és a mAb kapcsolódó kötődési képességétől (Lobo és mtsai., 2004; Taylor, 2018). Az erenumab a legújszerűbb megközelítés, mivel ez az egyetlen, amely a humán G-protein-kapcsolt receptor kalcitonin receptorszerű receptor CALCRL (a CGRP és az adrenomedullin receptorokban szükséges) és a RAMP1 extracelluláris domének fúziós fehérjéjét célozza, beleértve a CGRP kötőzsebét is (Edvinsson és mtsai., 2018). Kimutatták, hogy kompetitíven gátolja a -CGRP kötődését a humán CGRP receptorhoz humán neuroblastóma sejtekben (SK-N-MC) 0,02 ± 0,01 nM Ki értékkel (Shi és mtsai., 2016). Az erenumab erős és teljes antagonizmust fejtett ki a CGRP által stimulált cAMP-akkumuláció ellen, 2,3 ± 0,9 nM IC50 értékkel az SK-N-MC-ben végzett funkcionális vizsgálatokban (Shi és mtsai., 2016). Ezenkívül 5000-szer szelektívebb CGRP-receptort eredményezett, amely nem mutatott agonista/antagonista hatást más humán kalcitonin családba tartozó receptorokra, beleértve az adrenomedullin, kalcitonin és amilin receptorokat a legmagasabb vizsgált 10 μM-os koncentrációig (Shi et al., 2016). A fremanezumab különböző ereken fejtheti ki hatását, ugyanis koncentrációfüggő gátlást okoz a CGRP által kiváltott vazodilatációban előkontrahált humán agyi, meningeális és perifériás hasi artériákban (Ohlsson és mtsai., 2018). Ezenkívül a CGRP a neuronokra és a gliasejtekre, valamint a glimfatikus (nyirokkeringés-szerű) sejtekre is hathat, ez utóbbiak az aura kifejeződésében is szerepet játszanak (lásd Messlinger, 2018). A májenzimek általi metabolizmus valószínűsíthető hiánya elkerülheti a gyógyszer-gyógyszer kölcsönhatásokat. Az elimináció az aminosavak veseproteolízisén keresztül történik. Bár a klinikai vizsgálatok arról számolnak be, hogy ezek az antitestek összességében jól tolerálhatók, a kiemelt injekcióhelyi fájdalomtól eltekintve, aggodalomra ad okot az ADA termelődésén keresztüli immunogenitásuk (Taylor, 2018). Egy kettős vak, randomizált, placebokontrollos klinikai vizsgálat (ClinicalTrials.gov NCT 01337596) során, amely a galcanezumab egyszeri és többszörös dózisú kezelésének különböző sémáit értékelte, a kezelt betegek 11 betegénél (26%) alacsony (1:10 – 1:80) titerű (1:10 – 1:80) kezeléssel emergens-ADA-t mutattak ki (3 betegnél a már meglévő antitestek titerét növelték), dózis-válasz és a PK-ra és PD-re észlelt hatások nélkül (Monteith és mtsi., 2017). Az immunogenitás vizsgálata alapvető fontosságú, mivel az ADA jelenléte felgyorsíthatja a gyógyszer eltávolítását, vagy rosszabb esetben elősegítheti a végszervi károsodást (Taylor, 2018). A migrén elleni mAb-ok főbb jellemzőit az 1. táblázat foglalja össze.

Táblázat. A fremanezumab, az eptinezumab, a galcanezumab és az erenumab főbb jellemzői.
Következtetés
A migrén egy rokkant és legyengítő neurovaszkuláris fájdalmas állapot, amely az ismétlődő fejfájások több mint 90%-át képviseli, és amely felé a hajlam öröklődhet (MacGregor, 2017). A divalproex-nátrium, a nátrium-valproát, a topiramát, a metoprolol, a propranolol és a timolol a migrén megelőzésében erős, A-szintű bizonyítékokkal rendelkezik (American Academy of Neurology and American Headache Society, 2015). Azonban az összes klasszikus orális megelőző kezelést, beleértve a triciklikus antidepresszánsokat, béta-blokkolókat, 5-HT2-antagonistákat ergotikumokat és antiepileptikumokat, nem migrénre fejlesztették ki, és csak a migrénes betegek 45%-ának nyújtanak 50%-os csökkenést a migrénes fájdalommal járó havi napok számában (D’Amico és Tepper, 2008), szintén a szűkös tolerálhatóság miatti alacsony adherencia miatt. A gyógyszeres kezelés perzisztenciáját és abbahagyását egy retrospektív amerikai kárigény-elemzésben vizsgálták (Hepp és mtsai., 2017), és az eredmények azt mutatják, hogy az eredetileg alkalmazott gyógyszerhez való alacsony perzisztencia és a gyógyszerosztálytól függetlenül a 6 hónapig történő abbahagyás nagymértékű. A CGRP alapvető szerepe miatt a neuroinflammáció fenntartásában és a központi szenzitizációban a trigeminális gangliontól és az agytörzstől a migrén fiziopatológiájában részt vevő magasabb régiókig tartó útvonalon a CGRP és receptora felé új mAb-okat fejlesztettek ki. Az első kis molekulájú CGRP-antagonisták májtoxicitást mutattak, de a mAbs-ek a vazodilatáció gátlása miatt sem toxikus metabolitokat, sem kardiovaszkuláris mellékhatásokat nem produkáltak (lásd Deen és mtsai., 2017). A centrális mellékhatásokat sem emelték ki. A CGRP blokkolásának lehetséges hosszú távú hatásait még tanulmányozni kell, de ezen antitestek alapvető előnye abból fakad, hogy hosszú felezési idejük lehetővé teszi a havi vagy ritkább injekciókat, ami jelentősen javíthatja a kezeléshez való ragaszkodást és az azt követő hatékonyságot (Deen és mtsi., 2017). Így az anti-CGRP mAb-k hatékony eszközöket jelenthetnek a terápiás arzenálban a nem reagáló migrén ellen; azonban a hatékonyság és a biztonságosság (azaz a toxikus metabolitok termelődése, az ADA-val való immunogenitás, a semlegesítő antitestek és a szöveti keresztreaktivitás, valamint a mellékhatások) mélyreható nyomon követése kötelező (Taylor, 2018). A régebbi biotechnológiai termékekből származó bizonyítékok ugyanis azt mutatják, hogy a tumor nekrózis faktor α (TNFα) elleni mAb-okkal végzett terápiák a kezdeti terápiás válasz másodlagos kudarcának lehetnek kitéve (ellentétben az elsődlegesen nem reagálókkal), mivel ezek a gyógyszerek olyan antitestek termelődését indukálják, amelyek lebonthatják a mAb-t, de a célponthoz való kötődés előtt semlegesíthetik is annak hatását (lásd Prado és mtsai., 2017). Az immunogenitást befolyásolhatja a glikoziláció, a mAb típusa, az epitópok száma és a készítményben lévő szennyeződések (lásd Prado et al., 2017). Ezenkívül számos, látszólag megmagyarázhatatlan súlyos mellékhatás kapcsolódik az anti-TNFα immunogenitásához. Kiemelték a helyi és szisztémás túlérzékenységi reakciókat, a fertőzésekre való fokozott fogékonysággal járó immunhiányt és az immunkomplexképződést, amely akár halálhoz is vezethet (lásd Prado et al., 2017). Ezért a terápiás diagnosztika (theranosztika) alkalmazása javíthatja e farmakológiai eszközök megismerését és helyes kezelését (Bendtzen, 2013; Prado et al., 2017).
A szerzők hozzájárulása
MTC, LAM, PT és GB fogalmazták meg a tanulmányt. DS összegyűjtötte a vizsgálati eredményeket, elemezte a szakirodalmat és megírta a kéziratot. AA, LR és MN részt vettek az irodalmi áttekintésben. Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
Conflict of Interest Statement
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
American Academy of Neurology and American Headache Society (2015). A. függelék: a klinikusoknak szóló, bizonyítékokon alapuló iránymutatás összefoglalása, frissítés: farmakológiai kezelés az epizodikus migrén megelőzésére felnőtteknél. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Személyre szabott orvoslás: a theranosztika (terápiás diagnosztika) elengedhetetlen a tumornekrózisfaktor-alfa-antagonisták racionális alkalmazásához. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Az intravénás vagy szubkután úton beadott immunglobulin farmakokinetikája. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). A migrén és a feszültségtípusú fejfájás globális, regionális és nemzeti terhei, 1990-2016: szisztematikus elemzés a Global burden of disease study 2016 számára. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). A migrén profilaxisa: általános elvek és a betegek elfogadottsága. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). A CGRP blokkolása migrénes betegeknél – az előnyök és hátrányok áttekintése. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: az erenumab 3. fázisú randomizált vizsgálata epizodikus migrén kezelésére. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Extracranialis érelváltozások és a fájdalom forrása migrénes fejfájásban. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., and Porreca, F. (2014). A TRP-csatornák megcélzása új migrénterápiákhoz. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). CGRP-receptor-antagonisták és a CGRP és receptora elleni antitestek a migrén kezelésében. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). A CGRP-útvonal a migrénben, mint a terápiák életképes célpontja. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). A CGRP mint az új migrénterápiák célpontja – sikeres fordítás a padról a klinikára. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., and Edvinsson, L. (2013). A CGRP-t és CGRP-receptorokat tároló idegrostok differenciálódása a perifériás trigeminovaszkuláris rendszerben. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., and Premkumar, L. S. (2012). A szumatriptán gátolja a TRPV1 csatornákat a trigeminális neuronokban. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., and Goadsby, P. J. (2001). Orális triptánok (szerotonin 5-HT(1B/1D) agonisták) az akut migrén kezelésében: 53 vizsgálat metaanalízise. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). A galcanezumab megelőző hatása epizodikus vagy krónikus migrénben szenvedő felnőtt betegeknél tartós: a 3. fázisú, randomizált, kettős vak, placebokontrollos EVOLVE-1, EVOLVE-2 és REGAIN vizsgálatok adatai. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). A kalcitonin génnel kapcsolatos peptid receptor mint új célpont az epizodikus migrénben szenvedők kezelésében: az erenumab jelenlegi bizonyítékai és biztonsági profilja. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). Új gyógyszerek a migrén kezelésére. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Vazoaktív peptidek felszabadulása az ember extracerebrális keringésében migrénes fejfájás során. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). A migrén patofiziológiája: az érzékszervi feldolgozás zavara. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Az erenumab kontrollált vizsgálata epizodikus migrén kezelésére. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Az orális migrén profilaktikus gyógyszerek perzisztenciája és váltási szokásai krónikus migrénes betegek körében: retrospektív igényelemzés. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). A telcagepant randomizált, kontrollált vizsgálata migrénes és koszorúér-betegségben szenvedő betegeknél. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). CGRP monoklonális antitestek a migrén megelőző kezelésére. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). Újonnan megjelenő gyógyszerek a migrén kezelésére: egy frissítés. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002). A CGRP okozó szerepet játszhat a migrénben. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Antitest farmakokinetika és farmakodinamika. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migrén. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC20170404040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). A CGRP(r) monoklonális antitestek alkalmazása a migrén spektrumában: igények és prioritások. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). A nagy CGRP-áradat – források, nyelők és jelzőhelyek a trigeminovaszkuláris rendszerben. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). A CGRP-kötő monoklonális antitest LY2951742 (Galcanezumab) biztonságossága, tolerálhatósága, farmakokinetikája és farmakodinamikája egészséges önkéntesekben. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). A fremanezumab blokkolja a CGRP által kiváltott tágulást humán agyi, középső meningeális és hasi artériákban. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Biológiai TNF-ellenes gyógyszerek: a kezelés sikertelenségének és mellékhatásainak hátterében álló immunogenitás. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/1742525255.2017.1360280
PubMed Abstract | Cross Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Kalcitonin génnel kapcsolatos peptid: fiziológia és patofiziológia. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Az Európai Fejfájás Szövetség iránymutatása a kalcitonin génnel rokon peptidre vagy annak receptorára ható monoklonális antitestek migrénmegelőzésben történő alkalmazásáról. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). A PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) vizsgálat elsődleges eredményei: 3. fázisú, randomizált, kettős vak, placebokontrollos vizsgálat az eptinezumab hatékonyságának és biztonságosságának értékelésére a gyakori epizodikus migrén megelőzésére (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Az AMG 334, egy erős és szelektív humán monoklonális antitest farmakológiai jellemzése a kalcitonin génnel kapcsolatos peptid receptor ellen. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). A galcanezumab hatékonysága és biztonságossága az epizodikus migrén megelőzésére: az EVOLVE-2 3. fázisú, randomizált, kontrollált klinikai vizsgálat eredményei. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). A galcanezumab értékelése az epizodikus migrén megelőzésére: az EVOLVE-1 randomizált klinikai vizsgálat. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). A migrén az első számú rokkantsági ok az 50 év alattiak körében: most már az egészségügyi politikusok is felfigyelnek rá? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amylin, immunológia és fejfájásgyógyászat. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migrén biomarkerek az agy-gerincvelői folyadékban: szisztematikus áttekintés és metaanalízis. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). A kalcitonin génnel kapcsolatos peptid infúziójának hatása a klaszteres fejfájás rohamokra: randomizált klinikai vizsgálat. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). A jelátvitel szabályozása a kalcitonin génnel kapcsolatos peptid receptorok által. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Monoklonális antitestek farmakokinetikája és farmakodinamikája. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogén neuroinflammáció: gyulladásos CNS-reakciók a neuronális aktivitásra adott válaszként. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). CGRP monoklonális antitestek a migrén kezelésére: logika és előrelépés. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar
.