
Írd ide a példákat.
- 9.1 Jelzőmolekulák és sejtreceptorok
- 9.2 A jel terjedése
- 9.3 Válasz a jelre
Képzeld el, milyen lenne az élet, ha te és a körülötted élő emberek nem tudnának kommunikálni. Nem tudnád kifejezni másoknak a kívánságaidat, és nem tudnál kérdéseket feltenni, hogy többet tudj meg a környezetedről. A társadalmi szerveződés a társadalmat alkotó egyének közötti kommunikációtól függ.
Az emberekhez hasonlóan az egyes sejtek számára is létfontosságú, hogy képesek legyenek kölcsönhatásba lépni a környezetükkel és egymással. Ez attól függetlenül igaz, hogy egy sejt önmagában növekszik egy tóban, vagy egy a sok sejt közül, amelyek egy nagyobb szervezetet alkotnak. A külső ingerekre való megfelelő reagálás érdekében a sejtek összetett kommunikációs mechanizmusokat fejlesztettek ki, hogy képesek legyenek üzenetet fogadni, az információt a plazmamembránon keresztül továbbítani, majd az üzenetre reagálva változásokat idézzenek elő a sejtben.
A többsejtű szervezetekben a sejtek folyamatosan kémiai üzeneteket küldenek és fogadnak, hogy összehangolják más szervek, szövetek és sejtek működését. Az üzenetek gyors és hatékony küldésének képessége lehetővé teszi a sejtek számára, hogy összehangolják és finomhangolják funkcióikat. Bár a sejtkommunikáció szükségessége a nagyobb szervezetekben nyilvánvalónak tűnik, még az egysejtűek is kommunikálnak egymással. Az élesztősejtek jeleznek egymásnak, hogy segítsék a párosodást. A baktériumok egyes formái összehangolják tevékenységüket, hogy nagy komplexumokat, úgynevezett biofilmeket alkossanak, vagy hogy megszervezzék a toxintermelést a konkurens szervezetek eltávolítása érdekében. A sejtek kémiai jelek útján történő kommunikációjának képessége az egysejtűekből származik, és alapvető fontosságú volt a többsejtű szervezetek evolúciója szempontjából. A hatékony, hibamentes kommunikáció létfontosságú minden élet számára.
- 9.1 | Jelzőmolekulák és sejtreceptorok
- 9.1.1 A jelátvitel formái
- Parakrin jelátvitel
- Autokrin jelátvitel
- Endokrin jelátvitel
- Direkt jelátvitel
- 9.1.2 A receptorok típusai
- Belső receptorok
- Cellfelszíni receptorok
- 9.1.3. Jelzőmolekulák
- Kis hidrofób ligandumok
- Vízben oldódó ligandumok
- 9.2 | A jel terjedése
- 9.2.1. Jelátviteli útvonalak és jelerősítés
- 9.2.2 Az intracelluláris jelátvitel módszerei
- Foszforiláció
- Második hírvivők
- 9.3 | Válasz a jelre
- 9.3.1 A jelátviteli útvonalak válaszai
- Génkifejeződés
- A sejtanyagcsere fokozódása
- Cellnövekedés
- Cellhalál
- 9.3.2. A jelátviteli útvonalak megszüntetése
9.1 | Jelzőmolekulák és sejtreceptorok
A fejezet végére Ön képes lesz:
- A többsejtű szervezetekben megtalálható négyféle jelátvitel leírására.
- Hasonlítsa össze a belső receptorokat a sejtfelszíni receptorokkal.
- Megismerje a ligandok kémiai összetétele és hatásmechanizmusa közötti kapcsolatot.
Az élő sejtek világában kétféle kommunikáció létezik. A sejtek közötti kommunikációt nevezzük intercelluláris jelátvitelnek, a sejten belüli kommunikációt pedig intracelluláris jelátvitelnek. A megkülönböztetést könnyen megjegyezhetjük, ha megértjük, hogy az inter- előtag jelentése “között” (az államközi autópálya államok között halad át), az intra- pedig “belül” (az infúzió intravénás vagy “vénán belüli”).
A kémiai jeleket egy jelzősejt bocsátja ki, és egy célsejt fogadja. A célsejtek receptoroknak nevezett fehérjékkel rendelkeznek, amelyek kötődnek a jelzőmolekulákhoz, és választ váltanak ki. A receptorokhoz kötődő jelzőmolekulákat ligandumoknak nevezzük. A ligandumok és a receptorok specifikusak egymásra; egy receptor jellemzően csak az adott ligandumhoz kötődik. A jelátvitelnek azonban különböző típusai vannak.
9.1.1 A jelátvitel formái
A többsejtű szervezetekben megtalálható kémiai jelátvitel négy kategóriája: autokrin jelátvitel, parakrin jelátvitel, endokrin jelátvitel és közvetlen jelátvitel a réskapcsolatokon keresztül (9.2. ábra). A jelátvitel különböző kategóriái között a fő különbség az a távolság, amelyet a jel megtesz, hogy elérje a célsejtet.
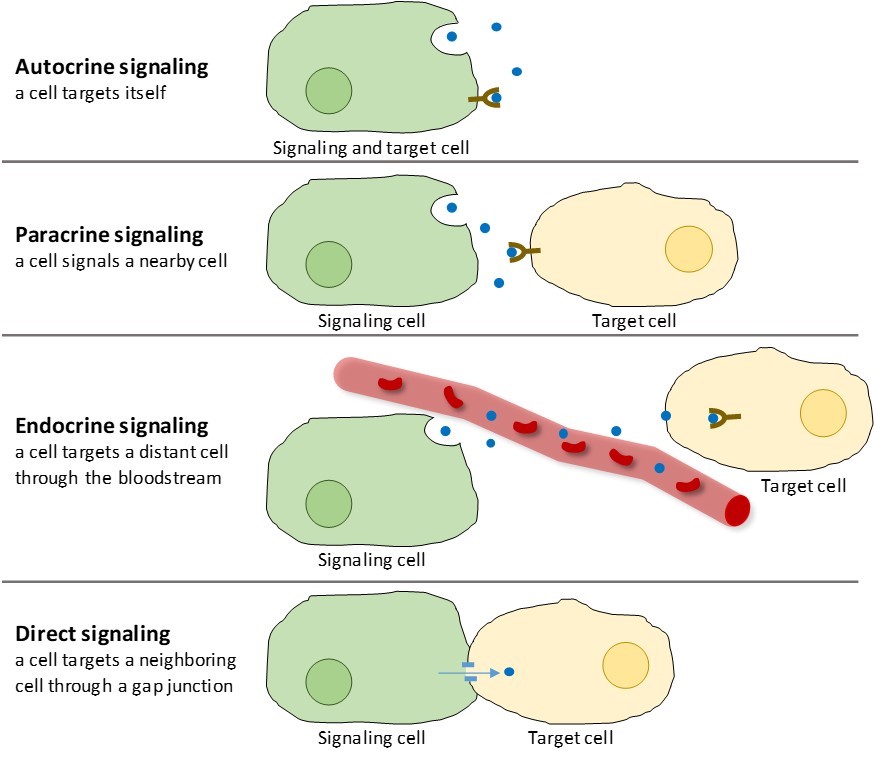
Parakrin jelátvitel
A közeli sejtek között helyileg ható jeleket parakrin jeleknek nevezzük. A parakrin jelek az extracelluláris mátrixon keresztül diffúzióval mozognak (9.2. ábra). Az ilyen típusú jelek általában gyors válaszokat váltanak ki, amelyek csak rövid ideig tartanak. Annak érdekében, hogy a válasz lokalizált maradjon, a parakrin ligandumokat általában enzimek gyorsan lebontják vagy a szomszédos sejtek eltávolítják. A szignálok eltávolítása helyreállítja a koncentrációgradienst a jelzőmolekula számára, ami lehetővé teszi, hogy ha újra felszabadulnak, gyorsan diffundáljanak az intracelluláris térben.
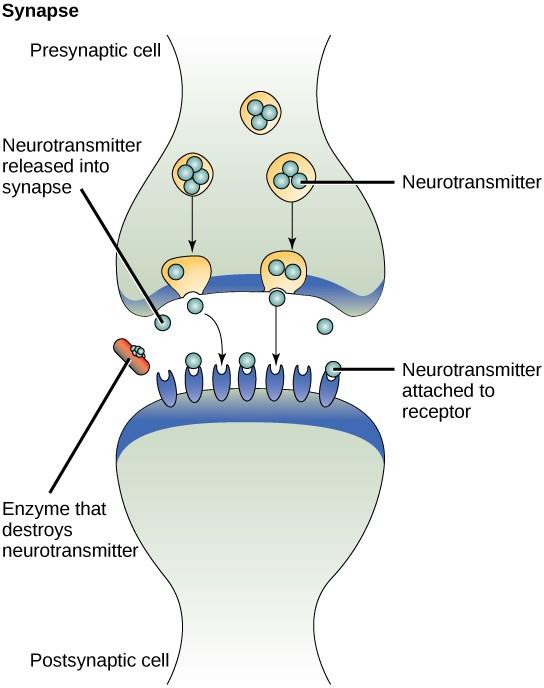
A parakrin jelátvitel egyik példája az idegsejtek közötti jelátvitel. Az idegsejtek közötti aprócska teret, ahol a jelátvitel történik, szinapszisnak nevezzük. A jelek az idegsejtek mentén gyorsan mozgó elektromos impulzusok révén terjednek. Amikor ezek az impulzusok elérik az egyik idegsejt végét, a preszinaptikus sejt (a jelet kibocsátó sejt) kémiai ligandumokat, úgynevezett neurotranszmittereket bocsát ki a szinapszisba. A neurotranszmitterek a szinapszison keresztül diffundálnak (9.3. ábra). Az idegsejtek közötti kis távolság lehetővé teszi a jel gyors terjedését, ami azonnali választ tesz lehetővé, például: “vedd le a kezed a tűzhelyről!”. Amikor a neurotranszmitter a posztszinaptikus sejt felszínén lévő receptorhoz kötődik, elindul a következő elektromos impulzus. A neurotranszmitterek gyorsan lebomlanak, vagy a preszinaptikus sejt visszaszívja őket, így a befogadó idegsejt gyorsan regenerálódhat, és felkészülhet a következő szinaptikus jelre adott gyors válaszra.
Autokrin jelátvitel
Amikor egy sejt a saját jelzőmolekulájára reagál, azt autokrin jelátvitelnek (auto = “önmaga”) nevezzük. Az autokrin jelátvitel gyakran más típusú jelátvitellel együtt fordul elő. Például, amikor egy parakrin jelet bocsátanak ki, a jelző sejt a szomszédjaival együtt válaszolhat a jelre (9.2. ábra).
Autokrin jelátvitel gyakran előfordul a szervezet korai fejlődése során, hogy a sejtek a megfelelő szövetekké fejlődjenek. Az autokrin jelátvitel szabályozza a fájdalomérzetet és a gyulladásos válaszokat is. Továbbá, ha egy sejt vírussal fertőződik, a sejt jelezheti magának, hogy programozott sejthalált végezzen, és közben elpusztítja a vírust.
Endokrin jelátvitel
A távoli sejtekből érkező jeleket endokrin jeleknek nevezzük, és endokrin sejtekből származnak. (A szervezetben sok endokrin sejt endokrin mirigyekben található, például a pajzsmirigyben, a hipotalamuszban és az agyalapi mirigyben.) Az ilyen típusú jelek általában lassabb választ váltanak ki, de hosszabb ideig tart a hatásuk. Az endokrin jelzések során felszabaduló ligandumokat hormonoknak nevezzük, olyan jelzőmolekuláknak, amelyek a test egy részében termelődnek, de bizonyos távolságban más testrészekre hatnak (9.2. ábra).
A hormonok az endokrin sejtek és a célsejtjeik közötti nagy távolságokat a véráram útján teszik meg, ami viszonylag lassú út a szervezetben. A szállítás formája miatt a hormonok felhígulnak, és alacsony koncentrációban vannak jelen, amikor a célsejtjeikre hatnak. Ez különbözik a parakrin jelátviteltől, amelyben a jelzőmolekulák helyi koncentrációja nagyon magas lehet.
Direkt jelátvitel
A gap junctions az állatokban és a plazmodesmák a növényekben a szomszédos sejtek plazmamembránjai közötti kapcsolatok. Ezek a vízzel teli csatornák lehetővé teszik a kis jelzőmolekulák diffúzióját a két sejt között. A kis molekulák, például a kalciumionok (Ca2+) képesek a sejtek között mozogni, de a nagy molekulák, például a fehérjék és a DNS nem férnek át a csatornákon. A csatornák specifitása biztosítja, hogy a sejtek függetlenek maradjanak, de gyorsan és könnyen továbbíthassák a jeleket. A közvetlen jelátvitel lehetővé teszi, hogy sejtek egy csoportja összehangolja válaszát egy olyan jelre, amelyet esetleg csak az egyikük kapott. A növényekben a plazmodesmák mindenütt jelen vannak, így az egész növény egy óriási kommunikációs hálózattá válik.
9.1.2 A receptorok típusai
A receptorok olyan fehérjemolekulák a célsejtben vagy annak felszínén, amelyek ligandumokhoz kötődnek. A receptoroknak két típusa van, a belső receptorok és a sejtfelszíni receptorok.
Belső receptorok
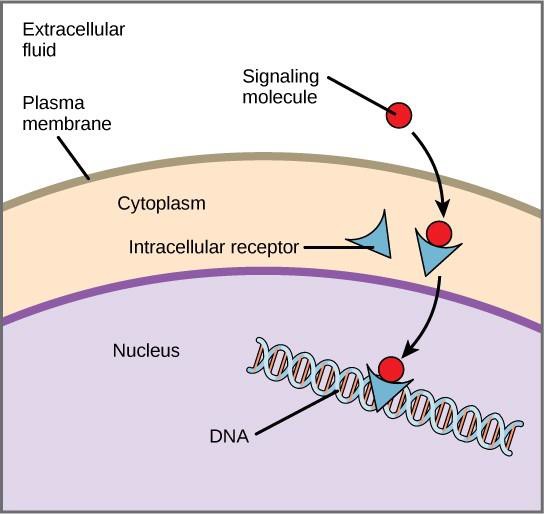
A belső receptorok, más néven intracelluláris vagy citoplazmatikus receptorok a célsejtek citoplazmájában találhatók, és olyan hidrofób ligandum molekulákra reagálnak, amelyek képesek áthaladni a plazmamembránon. A sejt belsejében számos ilyen molekula olyan fehérjékhez kötődik, amelyek az mRNS-szintézis (transzkripció) szabályozóiként működnek a génexpresszió közvetítése érdekében.
A génexpresszió az a sejtes folyamat, amely a sejt DNS-ében lévő információt aminosavak sorozatává alakítja át, amely végül fehérjét alkot. Amikor a ligandum a belső receptorhoz kötődik, konformációs változás indul el, amely a receptorfehérjén egy DNS-kötőhelyet exponál. A ligandum-receptor komplex a sejtmagba kerül, majd a kromoszómális DNS specifikus szabályozó régióihoz kötődik, és elősegíti a transzkripció elindulását (9.4. ábra). A transzkripció a sejt DNS-ében lévő információ másolásának folyamata az RNS egy speciális formájába, az úgynevezett hírvivő RNS-be (mRNS); a sejt az mRNS-ben lévő információt arra használja fel, hogy bizonyos aminosavakat a megfelelő sorrendben összekapcsoljon, és így fehérjét állítson elő. Így amikor egy ligandum egy belső receptorhoz kötődik, közvetlenül befolyásolhatja a génexpressziót a célsejtben.
Cellfelszíni receptorok
A sejtfelszíni receptorok, más néven transzmembrán receptorok, olyan integrális fehérjék, amelyek külső jelzőmolekulákhoz kötődnek. Ezek a receptorok a plazmamembránon átívelnek, és jelátvitelt végeznek, amelynek során az extracelluláris jelet intercelluláris jellé alakítják át. (9.5. ábra). Mivel a sejtfelszíni receptorfehérjék alapvető fontosságúak a sejtek normális működéséhez, nem meglepő, hogy e fehérjék bármelyikének hibás működése súlyos következményekkel járhat. Bizonyos receptormolekulák fehérjeszerkezetének hibái bizonyítottan szerepet játszanak a magas vérnyomás (hipertónia), az asztma, a szívbetegségek és a rák kialakulásában.
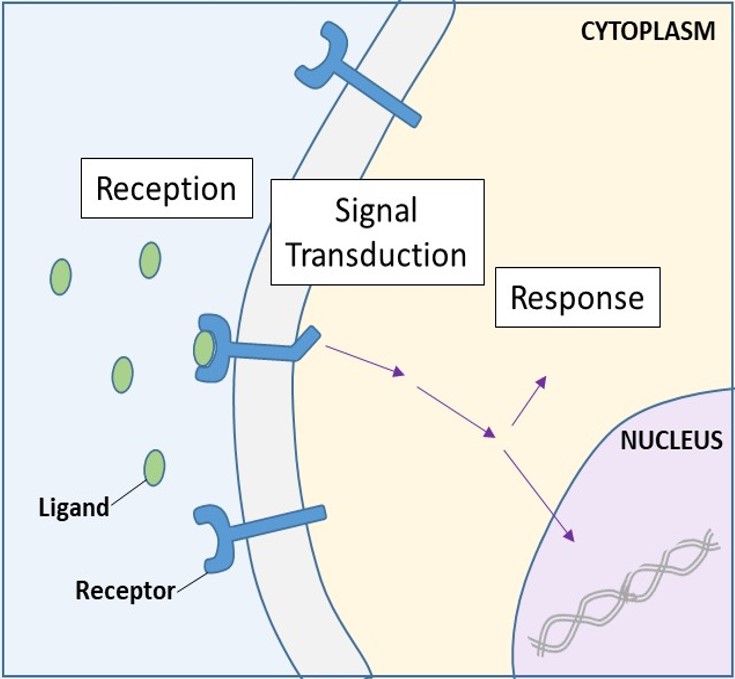
Minden sejtfelszíni receptornak három fő összetevője van: egy külső ligandumkötő domén, vagy extracelluláris domén; egy hidrofób membránon átívelő régió; és egy intracelluláris domén. A sejtfelszíni receptorok a legtöbb jelátvitelben részt vesznek a többsejtű szervezetekben. A sejtfelszíni receptoroknak három általános kategóriája van: enzimhez kötött receptorok, ioncsatornához kötött receptorok és G-proteinhez kötött receptorok.
Az enzimhez kötött receptorok olyan sejtfelszíni receptorok, amelyek intracelluláris doménnel rendelkeznek, és egy enzimhez kapcsolódnak. Egyes esetekben a receptor intracelluláris doménje maga is egy enzim. Más enzimhez kötött receptorok egy kis intracelluláris doménnel rendelkeznek, amely közvetlenül kölcsönhatásba lép egy enzimmel. Az enzimhez kötött receptorok általában nagy extracelluláris és intracelluláris doménnel rendelkeznek, de a membránon átívelő régió egyetlen alfa-hélixből áll a peptidszálban.
Amikor egy ligandum kötődik egy enzimhez kötött receptor extracelluláris doménjéhez, a jel a membránon keresztül továbbításra kerül, aktiválva az enzimet. Az enzim aktiválása események láncolatát indítja el a sejten belül, amely végül válaszreakcióhoz vezet.
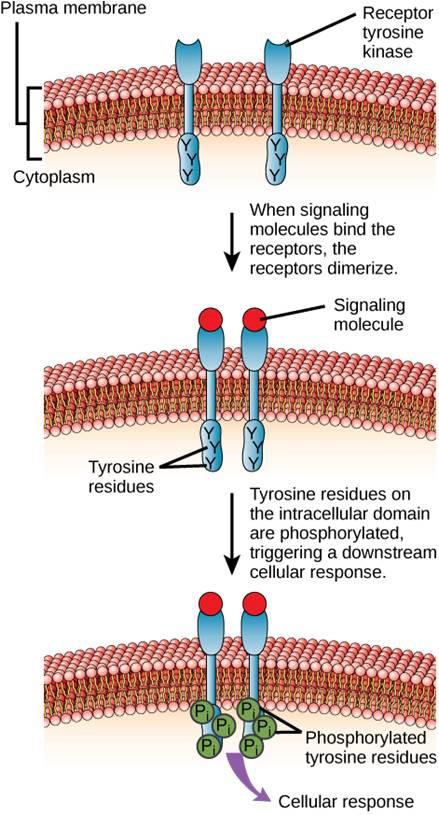
Az enzimhez kötött receptorok egyik példája a tirozinkináz-receptor (9.6. ábra). A kináz olyan enzim, amely foszfátcsoportokat visz át ATP-ből egy másik fehérjébe. A tirozin-kináz receptor foszfátcsoportokat juttat a tirozin molekulákhoz. Először a jelzőmolekulák két közeli tirozin-kináz receptor extracelluláris doménjéhez kötődnek. A két szomszédos receptor ezután összekapcsolódik, vagyis dimerizálódik. Ezután foszfátok adódnak a receptorok intracelluláris doménjének tirozin-maradványaihoz (foszforiláció). A foszforilált maradékok ezután továbbítani tudják a jelet a következő hírvivőnek a citoplazmán belül.
Az epidermális növekedési faktor receptorok a receptor-tirozinkinázok példája, amelyek ezt a jelátviteli módot követik. Az ErbB jelátvitel hibái ebben a családban olyan neuromuszkuláris betegségekhez vezethetnek, mint a szklerózis multiplex és az Alzheimer-kór.
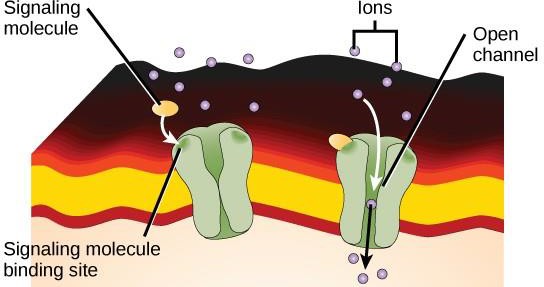
Ioncsatornához kötött receptorok kötődnek egy ligandhoz, és megnyitnak egy csatornát a membránon keresztül, amely lehetővé teszi bizonyos ionok áthaladását. A sejtfelszíni receptorok e típusának kiterjedt, hidrofób aminosavakat tartalmazó, membránon átívelő régiója van. Ezzel szemben a csatorna belsejét szegélyező aminosavak hidrofilek, hogy lehetővé tegyék az ionok áthaladását. Amikor egy ligandum kötődik a csatorna sejten kívüli régiójához, a fehérje szerkezetében konformációs változás következik be, amely lehetővé teszi az ionok, például a nátrium, kalcium, magnézium vagy hidrogén áthaladását (9.7. ábra).
G-proteinhez kötött receptorok kötődnek egy ligandhoz, és aktiválnak egy kapcsolódó G-proteint. Az aktivált G-fehérje ezután kölcsönhatásba lép egy közeli membránfehérjével, amely lehet egy ioncsatorna vagy egy enzim (9.8. ábra). Minden G-fehérjéhez kötött receptornak hét transzmembrán doménje van, de minden receptornak van egy specifikus extracelluláris doménje és G-fehérje-kötőhelye.
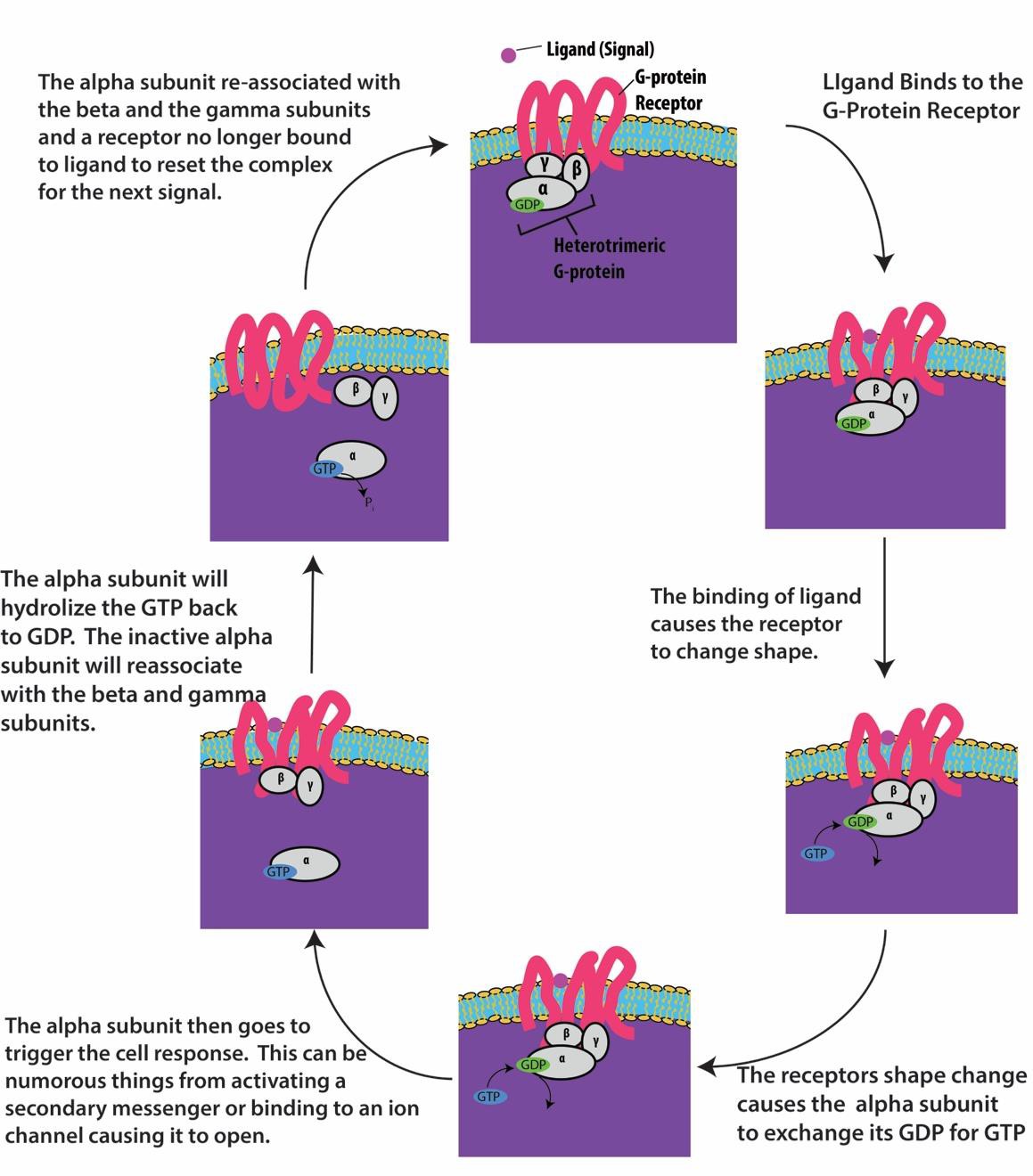
A G-fehérjékhez kötött receptorok segítségével történő jelátvitel egy ciklusban zajlik. Miután a ligandum kötődik a receptorhoz, az így létrejövő alakváltozás aktiválja a G-fehérjét, amely felszabadítja a GDP-t és felveszi a GTP-t. A G-fehérje alegységei ezután α és βγ alegységekre hasadnak. E G-fehérje fragmentumok egyike vagy mindkettő képes lehet más fehérjéket aktiválni a sejtben. Egy idő után a G-fehérje aktív α alegységén lévő GTP GDP-vé hidrolizálódik, és a βγ alegység deaktiválódik. Az alegységek újra asszociálódnak az inaktív G-fehérje kialakulásához, és a ciklus újra kezdődik (9.8. ábra).
A G-fehérjékhez kapcsolt receptorok számos élettani folyamatban szerepet játszanak, többek között a látásátvitel, az ízlelés, valamint az immunrendszer és a gyulladás szabályozásában.

A HER2 egy receptor tirozinkináz. Az emberi emlőrákok 30 százalékában a HER2 tartósan aktiválódik, ami szabályozatlan sejtosztódást eredményez. A lapatinib, az emlőrák kezelésére használt gyógyszer gátolja azt a folyamatot, amelynek során a receptor foszforilálja magát, így 50 százalékkal csökkenti a tumor növekedését. Az alábbi lépések közül melyeket gátolná a Lapatinib?
- Szignálmolekula kötődés, dimerizáció és a downstream sejtválasz
- Dimerizáció és a downstream sejtválasz
- A downstream sejtválasz
- Foszfatáz aktivitás, dimerizáció és a downstream sejtválasz
9.1.3. Jelzőmolekulák
A jelzősejtek által termelt ligandumok olyan kémiai jelek, amelyek eljutnak a célsejtekhez és választ váltanak ki. A ligandumként szolgáló molekulák típusai hihetetlenül változatosak, és a kis fehérjéktől a kis ionokig terjednek. A ligandumok vagy kis hidrofób ligandumokba sorolhatók, amelyek képesek áthatolni a plazmamembránokon, vagy vízben oldódó ligandumokba, amelyek nem képesek erre.
Kis hidrofób ligandumok
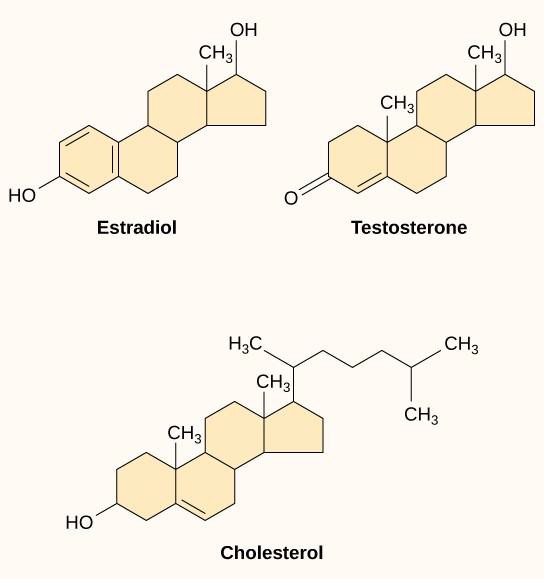
A kis hidrofób ligandumok, más néven lipidoldékony ligandumok, közvetlenül képesek átdiffundálni a plazmamembránon, és kölcsönhatásba lépni a belső receptorokkal. A ligandumok ezen osztályának fontos tagjai a szteroid hormonok. A szteroidok olyan lipidek, amelyek szénhidrogénváza négy kondenzált gyűrűvel rendelkezik; a különböző szteroidok szénvázához különböző funkciós csoportok kapcsolódnak. A szteroid hormonok közé tartozik a női nemi hormon ösztradiol, amely az ösztrogén egyik típusa; a férfi nemi hormon tesztoszteron; és a koleszterin, amely a biológiai membránok fontos szerkezeti összetevője és a szteroid hormonok előanyaga (9.10. ábra). További hidrofób hormonok közé tartoznak a pajzsmirigyhormonok és a D-vitamin. Ahhoz, hogy a hidrofób ligandumok oldódjanak a vérben, hordozófehérjékhez kell kötődniük, miközben a véráramban szállítják őket.
Vízben oldódó ligandumok
Mivel a vízben oldódó ligandumok polárisak, nem tudnak segítség nélkül átjutni a plazmamembránon. Néha túl nagyok ahhoz, hogy egyáltalán áthaladjanak a membránon. Ehelyett a legtöbb vízoldható ligandum a sejtfelszíni receptorok extracelluláris doménjéhez kötődik (lásd a 9.5. ábrát). A ligandumok e csoportja igen változatos, és magában foglalja a kismolekulákat, peptideket és fehérjéket.
9.2 | A jel terjedése
A fejezet végére képes leszel:
- Magyarázd meg, hogyan indítja el egy ligandum kötődése a jelátvitelt a sejtben.
- Megismeri, hogy az intracelluláris jelek továbbítása a foszforiláció vagy a másodlagos hírvivők szerepén keresztül történik.
Mihelyt egy vízoldható ligandum kötődik a receptorához, a jel a membránon keresztül a citoplazmába jut. A jel ily módon történő folytatását jelátvitelnek nevezzük (9.5. ábra). A jelátvitel csak sejtfelszíni receptorokkal történik, mivel a belső receptorok képesek bejutni a sejtbe.
Amikor egy ligandum kötődik a receptorához, konformációs változások következnek be, amelyek a receptor intracelluláris doménjét érintik. Ezek a konformációs változások az intracelluláris domén vagy a hozzá kapcsolódó fehérjék aktiválásához vezetnek. Bizonyos esetekben a ligandum kötődése a receptor dimerizációját okozza, ami azt jelenti, hogy két receptor egymáshoz kötődve egy stabil komplexet, úgynevezett dimert alkot. A dimer olyan kémiai vegyület, amely két (gyakran azonos) molekula egyesülésével jön létre. A receptorok ilyen módon történő kötődése lehetővé teszi, hogy intracelluláris doménjeik szoros kapcsolatba kerüljenek és aktiválják egymást.
9.2.1. Jelátviteli útvonalak és jelerősítés
Bár a jelátviteli molekulák gyakran nagyon alacsony koncentrációban fordulnak elő, mégis mélyreható hatást fejthetnek ki. Miután a ligandum a sejtfelszíni receptorhoz kötődik, a receptor intracelluláris komponenseinek aktiválása egy eseményláncot indít el, amelyet jelátviteli útvonalnak vagy jelkaszkádnak nevezünk. A jelátviteli útvonalban másodlagos hírvivők, enzimek és/vagy aktivált fehérjék aktiválnak más fehérjéket vagy hírvivőket (9.11. ábra). Az útvonal minden egyes tagja aktiválhatja az útvonal következő tagjának ezreit a jelerősítésnek nevezett folyamat során. Mivel a jel minden egyes lépésnél felerősödik, egyetlen receptor ligandhoz kötődéséből igen nagy válasz keletkezhet.
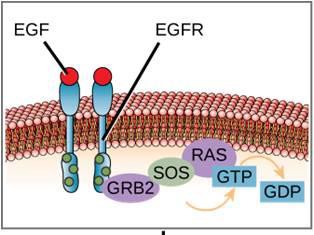
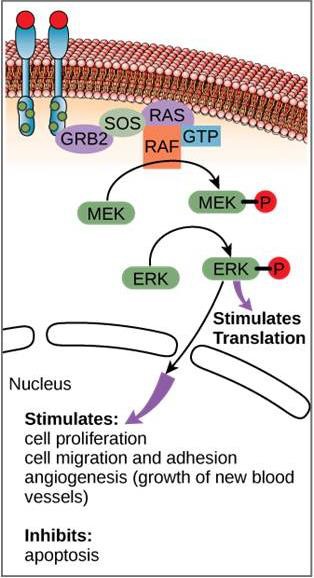
A jelátviteli útvonalra egy példát mutat a 9.11. ábra. Az epidermális növekedési faktor (EGF) olyan jelátviteli molekula, amely részt vesz a sejtnövekedés, a sebgyógyulás és a szövetek helyreállításának szabályozásában. Az EGF receptora (EGFR) egy tirozinkináz. Az aktivált kináz számos downstream molekulát foszforilál és aktivál. Amikor az EGF kötődik az EGFR-hez, a downstream foszforilációs események kaszkádja jelzi a sejtnek, hogy növekedjen és osztódjon. Ha az EGFR nem megfelelő időpontokban aktiválódik, ellenőrizetlen sejtnövekedés (rák) alakulhat ki.
Egyes rákbetegségekben a RAS G-protein GTPáz aktivitása gátolt. Ez azt jelenti, hogy a RAS-fehérje már nem képes a GTP-t GDP-vé hidrolizálni. Milyen hatással lenne ez a downstream sejtes eseményekre?
9.2.2 Az intracelluláris jelátvitel módszerei
A jelátviteli útvonal indukciója egy sejtkomponens enzim általi módosításától függ. Számos enzimatikus módosítás történhet az útvonal következő komponensének aktiválásához. A következőkben az intracelluláris jelátvitel néhány gyakoribb eseményét mutatjuk be.
Foszforiláció
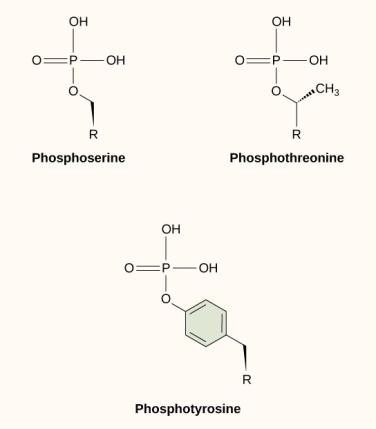
A jelátviteli útvonalakban bekövetkező egyik leggyakoribb kémiai módosítás a foszfátcsoport hozzáadása egy molekulához egy foszforilációnak nevezett folyamat során. A foszfátot hozzá lehet adni egy nukleotidhoz, például a GMP-hez, így GDP vagy GTP keletkezik. Foszfátokat gyakran adnak a fehérjék szerin-, treonin- és tirozin-maradványaihoz is, ahol az aminosav hidroxilcsoportját helyettesítik (9.12. ábra). A foszfát átvitelét egy kináznak nevezett enzim katalizálja. A foszforiláció aktiválhatja vagy inaktiválhatja az enzimeket, és a foszforiláció megfordítása, a defoszforiláció visszafordítja a hatást.
Második hírvivők
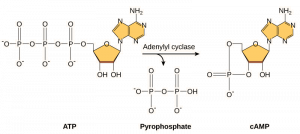
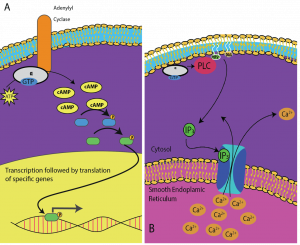
A második hírvivők olyan kismolekulák, amelyek a jelet továbbítják, miután az a jelzőmolekulának a receptorhoz való kötődésével elindult. Ezek a molekulák bizonyos sejtfehérjék viselkedésének megváltoztatásával segítik a jel terjedését a citoplazmában. A számos különböző sejttípus által használt második hírvivő a ciklikus AMP (cAMP). A ciklikus AMP-t az adenil-cikláz enzim szintetizálja ATP-ből (9.13. ábra). A cAMP fő szerepe a sejtekben az, hogy a cAMP-függő kináz (A-kináz) nevű enzimhez kötődik és aktiválja azt. Az A-kináz számos létfontosságú anyagcsere-útvonalat szabályoz: Célfehérjéinek szerin- és treonin-maradványait foszforilálja, és ezzel aktiválja őket. Az A-kináz számos különböző sejttípusban megtalálható, és a célfehérjék az egyes sejttípusokban különbözőek. Egy másik másodlagos hírvivő a Ca2+ , amely felszabadulva eláraszthatja a sejtet.
A különböző sejtek különbözőképpen reagálnak a cAMP-ra. A 9.14. ábrán egy G-fehérje receptor alfa alegysége látható, amely két különböző típusú jelátvitelt aktivál. Az első képen az alfa alegység aktiválásakor az adenilát-cikláz enzim cAMP-ot termel. cAMP ezután más fehérjéket aktivál, amelyek befolyásolják a génátírást. A második képen a G-fehérje alfa alegysége olyan kaszkádot indít el, amely Ca2+-t szabadít fel a sima endoplazmatikus retikulumból. Ebben az esetben a Ca2+ a másodlagos hírvivő, amely a sejtválaszt okozza.
9.3 | Válasz a jelre
A fejezet végére Ön képes lesz:
- felismerni, hogy a jelátviteli útvonalak irányítják a fehérjeexpressziót, a sejtanyagcserét és a sejtnövekedést.
- Megismeri az apoptózis szerepét az egészséges szervezet fejlődésében és fenntartásában.
A jelátviteli útvonalak segítségével a plazmamembránban lévő receptorok különböző hatásokat váltanak ki a sejtben. A sejt belsejében a ligandumok a belső receptoraikhoz kötődnek, lehetővé téve számukra, hogy közvetlenül befolyásolják a sejt DNS-ét és fehérjetermelő gépezetét. A jelátviteli útvonalak eredményei rendkívül változatosak, és az érintett sejttípustól, valamint a külső és belső körülményektől függnek. Az alábbiakban a válaszok egy kis mintáját ismertetjük.
9.3.1 A jelátviteli útvonalak válaszai
Génkifejeződés
Egyes jelátviteli útvonalak az RNS átírását szabályozzák. Mások a fehérjék transzlációját szabályozzák.
A sejtanyagcsere fokozódása
Az izomsejtekben lévő β-adrenerg receptorok adrenalin általi aktiválása a ciklikus AMP növekedéséhez vezet a sejten belül. Az adrenalin a mellékvese által termelt hormon, amely felkészíti a szervezetet a rövid távú vészhelyzetekre.
Cellnövekedés
A sejtek jelátviteli útvonalai a sejtosztódásban is fontos szerepet játszanak. A sejtek normális esetben nem osztódnak, hacsak más sejtek jelzései nem serkentik őket. A sejtnövekedést elősegítő ligandumokat növekedési faktoroknak nevezzük. A legtöbb növekedési faktor sejtfelszíni receptorokhoz kötődik, amelyek tirozinkinázokhoz kapcsolódnak.
Cellhalál
Ha egy sejt károsodott, feleslegessé vált vagy potenciálisan veszélyes a szervezet számára, a sejt elindíthat egy olyan mechanizmust, amely programozott sejthalált, azaz apoptózist vált ki. Az apoptózis lehetővé teszi, hogy egy sejt ellenőrzött módon pusztuljon el, ami megakadályozza a potenciálisan káros molekulák felszabadulását a sejt belsejéből. Bizonyos esetekben azonban, például vírusfertőzés vagy rák okozta ellenőrizetlen sejtosztódás esetén a sejt normális ellenőrzési és egyensúlyi rendszere megbukik. Külső jelzések is elindíthatják az apoptózist. Például a legtöbb normális állati sejt rendelkezik olyan receptorokkal, amelyek kölcsönhatásba lépnek az extracelluláris mátrixszal, egy glikoproteinekből álló hálózattal, amely strukturális támaszt nyújt az állati sejteknek. A sejtreceptoroknak az extracelluláris mátrixhoz való kötődése egy jelkaszkádot indít el a sejten belül. Ha azonban a sejt eltávolodik az extracelluláris mátrixtól, a jelátvitel megszűnik, és a sejt apoptózison megy keresztül. Ez a rendszer segít megakadályozni, hogy a sejtek a szervezetben vándoroljanak és kontrollálatlanul szaporodjanak, ahogy ez az áttétet képző tumorsejtek esetében történik.
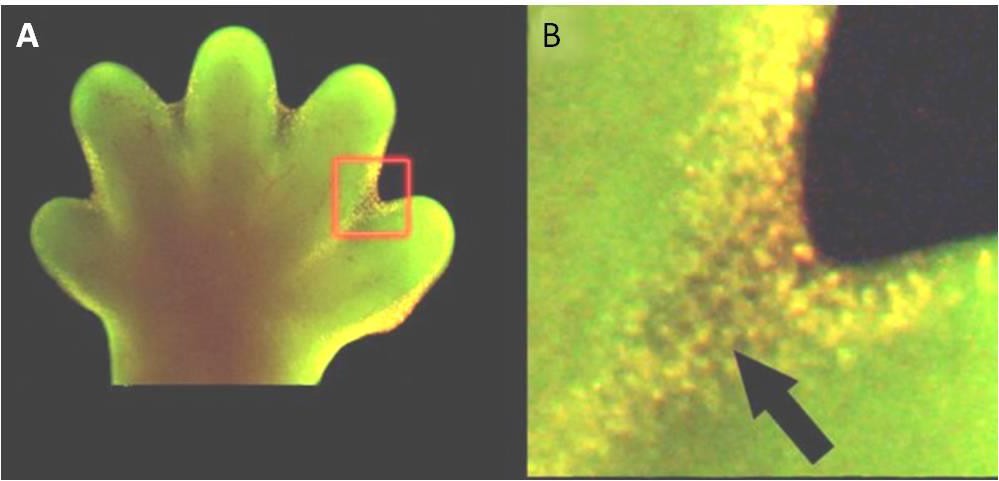
Az apoptózis a normális embriológiai fejlődéshez is elengedhetetlen. A gerinceseknél például a fejlődés korai szakaszában az egyes ujjak és lábujjak között hálószerű szövetek alakulnak ki (9.15. ábra). A normális fejlődés során ezeket a nem szükséges sejteket el kell távolítani, lehetővé téve a teljesen elkülönült ujjak és lábujjak kialakulását. Egy sejtszignál-mechanizmus indítja el az apoptózist, amely elpusztítja a fejlődő ujjak közötti sejteket.
9.3.2. A jelátviteli útvonalak megszüntetése
A daganatos sejtekben gyakran megfigyelhető aberrált jelátvitel a bizonyíték arra, hogy egy jel megfelelő időben történő megszüntetése ugyanolyan fontos lehet, mint a jel elindítása. Egy specifikus jel megállításának egyik módszere a ligandum lebontása vagy eltávolítása, hogy az ne tudjon többé hozzáférni a receptorához. Az egyik ok, amiért az olyan hidrofób hormonok, mint az ösztrogén és a tesztoszteron, hosszan tartó eseményeket váltanak ki, az az, hogy hordozófehérjékhez kötődnek. Ezek a fehérjék lehetővé teszik, hogy az oldhatatlan molekulák a vérben oldódjanak, ugyanakkor megvédik a hormonokat a keringő enzimek általi lebontástól.
A sejt belsejében számos különböző enzim fordítja vissza a jelátviteli kaszkádokból eredő sejtmódosulásokat. A foszfatázok például olyan enzimek, amelyek eltávolítják a kinázok által a fehérjékhez kapcsolt foszfátcsoportot egy defoszforilációnak nevezett folyamat során. A cAMP-ot a foszfodiészteráz AMP-vé bontja le, ezzel megszüntetve a jelet. Hasonlóképpen, a kalciumraktárak felszabadulását a sejtmembránokban található Ca2+ pumpák fordítják vissza.