Az ionos és a kovalens vegyületek fizikai tulajdonságai
Az ionos és a kovalens vegyületek általában különböző fizikai tulajdonságokkal rendelkeznek. Az ionos vegyületek kemény kristályos szilárd anyagokat alkotnak, amelyek magas hőmérsékleten megolvadnak és ellenállnak a párolgásnak. Ezek a tulajdonságok az ionos szilárd anyagok jellegzetes belső szerkezetéből erednek, amelyet sematikusan a 2.7.4. ábra a) része szemléltet, amely a váltakozó pozitív és negatív ionok háromdimenziós elrendezését mutatja, amelyeket erős elektrosztatikus vonzások tartanak össze. Ezzel szemben, amint azt a 9.5.1. ábra b) része mutatja, a legtöbb kovalens vegyület különálló molekulákból áll, amelyeket viszonylag gyenge intermolekuláris erők (a molekulák közötti erők) tartanak össze, annak ellenére, hogy az egyes molekulákon belüli atomokat erős intramolekuláris kovalens kötések (a molekulán belüli erők) tartják össze. A kovalens anyagok szobahőmérsékleten és nyomáson a molekulák közötti kölcsönhatások erősségétől függően lehetnek gázok, folyadékok vagy szilárd anyagok. A kovalens molekuláris szilárd anyagok általában lágy kristályokat alkotnak, amelyek alacsony hőmérsékleten megolvadnak és könnyen elpárolognak.
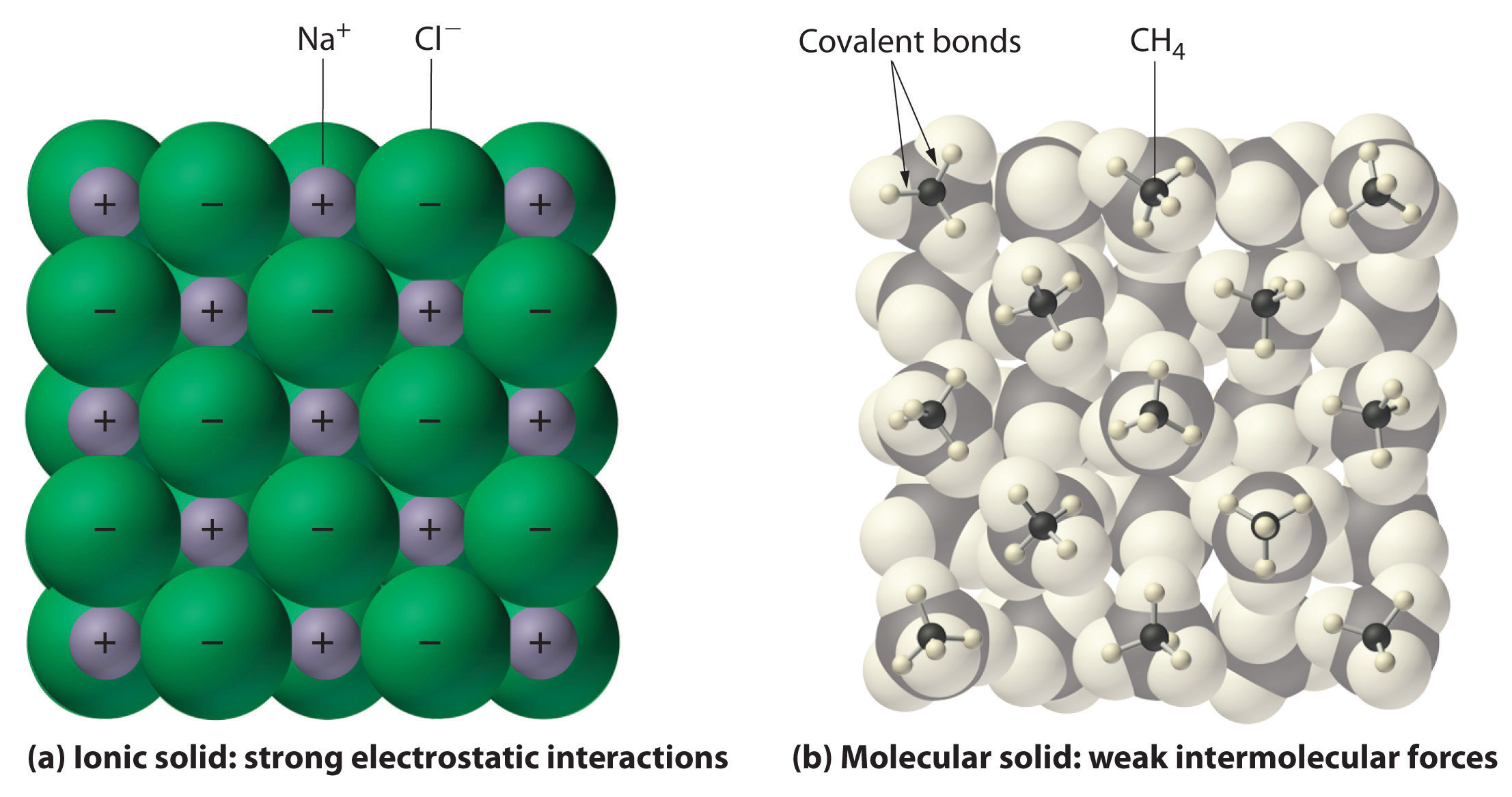
A 9.5.1. ábra: Kölcsönhatások ionos és kovalens szilárd testekben. (a) A pozitív és negatív töltésű ionokat egy ionos szilárd anyagban, például a nátrium-kloridban (NaCl) erős elektrosztatikus kölcsönhatások tartják össze. (b) A metán (\(CH_4\)) molekulák tömör metánban, egy prototipikus molekuláris szilárd anyagban való elhelyezkedésének ezen ábrázolásán a metánmolekulákat csak viszonylag gyenge intermolekuláris erők tartják össze a szilárd anyagban, annak ellenére, hogy az egyes metánmolekulákon belüli atomokat erős kovalens kötések tartják össze.
Szénhidrogének
A molekuláris szilárd testek olyan atomokból vagy molekulákból állnak, amelyeket dipól-dipól kölcsönhatások, londoni diszperziós erők vagy hidrogénkötések, illetve ezek bármely kombinációja tart egymáshoz. A szilárd benzolban a molekulák elrendeződése a következő:

A 9.5.2. ábra: A szilárd benzol szerkezete. A szilárd benzolban a molekulák nem egymással párhuzamos síkokkal, hanem 90°-os szögben helyezkednek el.
Mivel a molekulák közötti kölcsönhatások egy molekuláris szilárd anyagban viszonylag gyengék az ionos és kovalens kötésekhez képest, a molekuláris szilárd anyagok általában lágyak, alacsony olvadáspontúak és könnyen elpárolognak (\(ΔH_fus}\) és \(ΔH_vap}\) alacsonyak). Hasonló anyagok esetében a londoni diszperziós erők erőssége egyenletesen nő a molekulatömeg növekedésével. Például az egy, két és három fuzionált aromás gyűrűvel rendelkező benzol (C6H6), naftalin (C10H8) és antracén (C14H10) olvadáspontja 5,5 °C, 80,2 °C, illetve 215 °C. A benzol (C6H6), naftalin (C10H8) és antracén (C14H10) olvadáspontja 5,5 °C, 80,2 °C, illetve 215 °C. A fúziós entalpiák is egyenletesen nőnek a sorozaton belül: benzol (9,95 kJ/mol) < naftalin (19,1 kJ/mol) < antracén (28,8 kJ/mol). Ha azonban a molekulák olyan alakúak, hogy nem tudnak hatékonyan összecsomagolni a kristályban, akkor az olvadáspontok és az olvadási entalpiák általában váratlanul alacsonyak, mert a molekulák nem tudnak úgy elrendeződni, hogy a molekulák közötti kölcsönhatásokat optimalizálják. Így a toluol (C6H5CH3) és az m-xilol olvadáspontja -95°C, illetve -48°C, ami lényegesen alacsonyabb, mint a könnyebb, de szimmetrikusabb analóg, a benzol olvadáspontja.
Az öngyógyító gumi egy olyan molekuláris szilárd anyag példája, amely jelentős kereskedelmi felhasználási lehetőségekkel rendelkezik. Az anyag képes megnyúlni, de ha darabokra törik, hidrogénkötéses hálózatának újbóli felépülése révén képes újra összekapcsolódni anélkül, hogy a gyengeség bármilyen jelét mutatná. Többek között ragasztókban és öngyógyuló kerékpárgumikban való felhasználását vizsgálják.

9.5.3. ábra: Toluol és m-xilol. A toluolban és az m-xilolban a fenilgyűrűhöz kapcsolódó metilcsoportok megakadályozzák, hogy a gyűrűk ugyanolyan jól összecsomagolódjanak, mint a szilárd benzolban.