Die meisten medizinischen Behandlungen sind auf den „Durchschnittspatienten“ zugeschnitten, was bei einigen Patienten erfolgreich sein kann, bei anderen jedoch nicht. Die Präzisionsmedizin, manchmal auch als „personalisierte Medizin“ bezeichnet, ist ein innovativer Ansatz für die maßgeschneiderte Prävention und Behandlung von Krankheiten, der die Unterschiede in den Genen, der Umgebung und dem Lebensstil der Menschen berücksichtigt. Ziel der Präzisionsmedizin ist es, den richtigen Patienten zum richtigen Zeitpunkt die richtige Behandlung zukommen zu lassen.
Fortschritte in der Präzisionsmedizin haben bereits zu bedeutenden neuen Entdeckungen und FDA-zugelassenen Behandlungen geführt, die auf spezifische Merkmale von Personen zugeschnitten sind, wie z. B. die genetische Ausstattung einer Person oder das genetische Profil des Tumors einer Person. Patienten mit einer Vielzahl von Krebsarten werden routinemäßig molekularen Tests unterzogen, die es den Ärzten ermöglichen, Behandlungen auszuwählen, die die Überlebenschancen verbessern und das Risiko unerwünschter Wirkungen verringern.
- Next Generation Sequencing (NGS) Tests
- Die Rolle der FDA bei der Förderung der Präzisionsmedizin
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Leitfaden für klinische Datenbanken
- Leitfaden zur analytischen Validierung
- Bioinformatik-Plattform der FDA
- Fragen?
- Was FDA-Beamte sagen
- NGS Final Guidances
- Berichte und Diskussionspapiere
- Vergangene Sitzungen
Next Generation Sequencing (NGS) Tests
Präzisionsmedizin kann nur so gut sein wie die Tests, die die Diagnose und Behandlung leiten. Next Generation Sequencing (NGS)-Tests sind in der Lage, große Abschnitte des Genoms einer Person schnell zu identifizieren oder zu „sequenzieren“ und stellen einen wichtigen Fortschritt bei den klinischen Anwendungen der Präzisionsmedizin dar.
Patienten, Ärzte und Forscher können diese Tests nutzen, um genetische Varianten zu finden, die ihnen helfen, Krankheiten zu diagnostizieren, zu behandeln und besser zu verstehen.
Die Rolle der FDA bei der Förderung der Präzisionsmedizin
Die FDA arbeitet daran, die Genauigkeit von NGS-Tests zu gewährleisten, damit Patienten und Kliniker genaue und klinisch aussagekräftige Testergebnisse erhalten.
Die große Menge an Informationen, die durch NGS generiert werden, stellt die FDA vor neue regulatorische Fragen. Während die derzeitigen Regulierungsansätze für herkömmliche Diagnosen geeignet sind, die eine einzelne Krankheit oder einen einzelnen Zustand (wie Blutzucker oder Cholesterinspiegel) nachweisen, enthalten diese neuen Sequenzierungstechniken das Äquivalent von Millionen von Tests in einem. Aus diesem Grund hat die FDA mit Interessenvertretern aus Industrie, Laboratorien, Hochschulen sowie Patienten- und Berufsverbänden zusammengearbeitet, um einen flexiblen Regulierungsansatz für diese sich schnell entwickelnde Technologie zu entwickeln, der Konsensstandards, Crowd-Sourced-Daten und modernste Open-Source-Computertechnologie zur Unterstützung der NGS-Testentwicklung nutzt. Dieser Ansatz wird Innovationen bei Tests und in der Forschung ermöglichen und den Zugang zu genauen, zuverlässigen Gentests beschleunigen.
Streamlining FDA’s Regulatory Oversight of NGS Tests
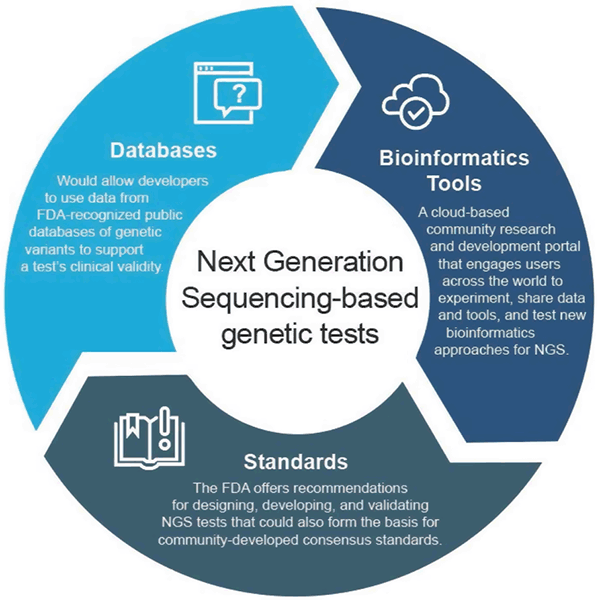
Im April 2018 hat die FDA zwei endgültige Richtlinien herausgegeben, die Ansätze zur Rationalisierung der Einreichung und Überprüfung von Daten zur Unterstützung der klinischen und analytischen Validität von NGS-basierten Tests empfehlen. Diese Empfehlungen sollen einen effizienten und flexiblen Ansatz für die behördliche Aufsicht bieten: Mit dem technologischen Fortschritt können sich die Standards schnell weiterentwickeln und zur Festlegung geeigneter Metriken für schnell wachsende Bereiche wie NGS verwendet werden. Ebenso könnten neue Behauptungen unterstützt werden, wenn sich die klinische Evidenz verbessert. Dieser adaptive Ansatz würde letztlich die Innovation unter den Testentwicklern fördern und den Zugang der Patienten zu diesen neuen Technologien verbessern.
Leitfaden für klinische Datenbanken
Der endgültige Leitfaden „Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics“ erlaubt es den Entwicklern, Daten aus von der FDA anerkannten öffentlichen Datenbanken mit genetischen Varianten zu verwenden, um die klinische Validität eines Tests zu unterstützen, und beschreibt, wie Datenbankadministratoren die Anerkennung ihrer Datenbanken beantragen können, wenn sie bestimmte Qualitätsempfehlungen erfüllen. Dieser Ansatz schafft Anreize für die gemeinsame Nutzung von Daten und bietet einen effizienteren Weg zur Marktreife.
Weitere Informationen über die Anerkennung von Datenbanken finden Sie auf der FDA-Webseite Recognition of Public Human Genetic Variants Databases.
Leitfaden zur analytischen Validierung
Der endgültige Leitfaden „Considerations for Design, Development, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases“ (Überlegungen zum Design, zur Entwicklung und zur analytischen Validierung von auf Next Generation Sequencing (NGS) basierenden In-vitro-Diagnostika (IVDs), die zur Unterstützung der Diagnose von vermuteten Keimbahnerkrankungen bestimmt sind) bietet Empfehlungen zum Design, zur Entwicklung und zur Validierung von NGS-Tests. Der Leitfaden ermutigt auch die Gemeinschaft, sich an der Entwicklung von NGS-bezogenen Standards durch Standardisierungsorganisationen (SDOs) zu beteiligen, da sich Standards schneller mit Veränderungen in der Technologie und im Wissen weiterentwickeln können und daher dazu verwendet werden können, geeignete Metriken wie spezifische Leistungsschwellen für schnell wachsende Bereiche wie NGS festzulegen.
Bioinformatik-Plattform der FDA
Die FDA hat precisionFDA geschaffen, ein cloudbasiertes Forschungs- und Entwicklungsportal, das Nutzer aus der ganzen Welt dazu einlädt, Daten und Tools auszutauschen, um bestehende und neue bioinformatische Ansätze für die NGS-Verarbeitung zu testen, zu erproben und zu validieren. Einzelpersonen und Organisationen der Genomik-Community können unter http://precision.fda.gov.
Fragen?
Bei Fragen zu den Bemühungen der FDA im Bereich der Präzisionsmedizin wenden Sie sich bitte an uns unter [email protected].
Was FDA-Beamte sagen
- FDA stellt Richtlinien zur Beschleunigung der Entwicklung von zuverlässigen, Sequenzierungstests der nächsten Generation
NGS Final Guidances
- Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 444KB)
- Considerations for Design, Development, und analytische Validierung von In-vitro-Diagnostika (IVDs) auf der Grundlage der Sequenzierung der nächsten Generation (NGS) zur Unterstützung der Diagnose vermuteter Keimbahnerkrankungen – Leitfaden für Interessenvertreter und Mitarbeiter der Food and Drug Administration (PDF – 869KB)
Berichte und Diskussionspapiere
- Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests (PDF – 424KB)
- Bericht: Paving the Way for Personalized Medicine (Archiv)
Vergangene Sitzungen
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Implikationen für Patienten und Anbieter
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances: Technical and Regulatory Aspects
- 11/13/2015: Öffentlicher Workshop – Nutzung von Datenbanken zur Bestimmung der klinischen Relevanz von humangenetischen Varianten
- 11/12/2015: Standardbasierter Ansatz für die analytische Leistungsbewertung von In-vitro-Diagnosetests mit Next Generation Sequencing
- 20.02.2015: Optimierung der regulatorischen Aufsicht der FDA über diagnostische Tests der nächsten Generation durch Sequenzierung
Öffentlicher Workshop