- trans-Zimtaldehyd Chemische Eigenschaften, Verwendung, Herstellung
- Überblick
- Pharmakokinetik
- Anwendungen
- Toxizität
- Chemische Eigenschaften
- Chemische Eigenschaften
- Chemische Eigenschaften
- Definition
- Synthese Referenz(en)
- Allgemeine Beschreibung
- Luft &Wasser Reaktionen
- Reaktivitätsprofil
- Brandgefahr
- Potenzielle Exposition
- Versand
- Inkompatibilitäten
- Abfallentsorgung
trans-Zimtaldehyd Chemische Eigenschaften, Verwendung, Herstellung
Überblick
Zimtaldehyd, ein alter Aromastoff, der aus Zimtbäumen und anderen Arten der Gattung Cinnamomum gewonnen wird, hat jetzt wegen seiner Fähigkeit, die Entwicklung von Diabetes und seinen Komplikationen zu verhindern, zunehmendes Interesse auf sich gezogen. Zimtaldehyd ist eine gelbe, viskose Flüssigkeit, die 98 % des ätherischen Öls der Zimtrinde ausmacht. Es wurde zunächst von Dumas und Péligot isoliert und dann 1854 von dem italienischen Chemiker Luigi Chiozza (1828-1889) im Labor synthetisiert. Im Jahr 2007 berichteten Subash et al. erstmals über eine hypoglykämische und hypolipidemische Wirkung von Zimtaldehyd bei männlichen Wistar-Ratten, die mit Streptozotocin (STZ) an Diabetes erkrankt waren. Cinnamaldehyd wurde seither in Tiermodellen für Diabetes und Fettleibigkeit eingehend untersucht.
Cassia oder chinesischer Zimt ist ein weit verbreitetes Gewürz, das aus der inneren Rinde des Zimtbaums gewonnen wird. Cassia wird seit Tausenden von Jahren für medizinische Zwecke verwendet und gilt als eines der 50 grundlegenden Kräuter der traditionellen chinesischen Medizin. Mehrere Teile der Cassia-Pflanze werden für medizinische Zwecke verwendet, darunter die Wurzel, die Rinde, die Blätter und die Blüten. Zimtextrakten werden verschiedene positive Wirkungen zugeschrieben, darunter antiallergische, antimikrobielle, antivirale, antioxidative, gastroprotektive, antiangiogene und Anti-Alzheimer-Wirkungen sowie insulinähnliche biologische Aktivitäten. Zimtextrakte enthalten mehrere Wirkstoffe, darunter ätherische Öle (Zimtaldehyd und Zimtaldehyd), Gerbstoffe, Schleim und Kohlenhydrate. Interessanterweise wirkt Zimtaldehyd, das auch als Zimtaldehyd bekannt ist, gegen Fettleibigkeit, indem es die Lipidakkumulation verringert und den Peroxisom-Proliferator-aktivierten Rezeptor-γ, das CCAAT/Enhancer-bindende Protein α und das Sterol-regulierende Element-bindende Protein 1 herunterreguliert. Darüber hinaus hemmt Zimtaldehyd die Lipopolysaccharid-induzierte Mikroglia-Aktivierung, indem es auf das Low-Density-Lipoprotein-Rezeptor-bezogene Protein-1 wirkt. Es wurde auch berichtet, dass Zimtaldehyd antimutagene Wirkungen in Krebszellen hat.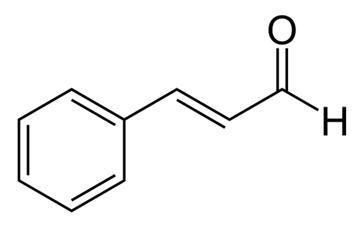
Abbildung 1: Chemische Struktur von Zimtaldehyd;
Pharmakokinetik
Zimtaldehyd kommt natürlicherweise in der trans-Zimtaldehyd-Form vor. In einem von Zhao et al. durchgeführten Experiment wurde die Pharmakokinetik von Zimtaldehyd bei Ratten unter Verwendung eines relativ empfindlichen Ansatzes der Gaschromatographie-Massenspektrometrie (GC-MS) nach oraler (500 mg/kg) und intravenöser (i.v., 20 mg/kg) Verabreichung untersucht. Die Ergebnisse zeigen, dass die AUC0-t von Zimtaldehyd nach oraler Verabreichung und nach i.v.-Verabreichung 1984 ± 531 bzw. 355 ± 53 ng h/ml beträgt. T1/2 und Tmax von Zimtaldehyd sind bei oraler Verabreichung länger (6,7 ± 1,5 h und 1,6 ± 0,5 h) als bei i.v. Verabreichung (1,7 ± 0,3 h und 0,033 h). Die Cmax beträgt 249±36 ng/ml bei oraler Verabreichung bzw. 547±142 ng/ml bei i.v.-Verabreichung. Die Ergebnisse deuten darauf hin, dass die Bioverfügbarkeit von Zimtaldehyd durch die i.v.-Verabreichung besser ist als durch die orale Verabreichung.
Weiterhin zeigen die Autoren, dass Cmax und AUC0-t proportional zur Dosis (von 125 bis 500 mg) sind, während Tmax und die mittlere Verweildauer sich nicht als Reaktion auf die Dosiseskalation ändern. Da sich Zimtaldehyd und Zimtalkohol bei Ratten ineinander umwandeln können, haben die Autoren auch die pharmakokinetischen Eigenschaften von Zimtalkohol im Rattenplasma analysiert. Die pharmakokinetischen Daten von Zimtalkohol sind 1105±337 ng-h/ml für AUC0-t, 6,7±2,8 h für T1/2, 1,5±0,7 h für Tmax und 221±66 ng/ml für Cmax, bei einer oralen Dosierung von 500 mg/kg. Interessanterweise wurde Methylcinnamat auch in den Metaboliten entdeckt. Für die pharmakokinetischen Eigenschaften von Methylcinnamat wird interessierten Lesern empfohlen, den Artikel von Zhao et al. zu lesen. Zusammenfassend lässt sich sagen, dass Zimtaldehyd nach der Absorption gut im Körper verteilt ist. Cinnamaldehyd kann sich in Cinnamylalkohol umwandeln und nach dem Eintritt in den Körper auch zu Zimtsäure oxidiert werden. Um die pharmakokinetischen Eigenschaften von Zimtaldehyd vollständig zu verstehen, sollten auch Methylzimt und Cinnamylalkohol im Plasma bestimmt werden. Die Instabilität von Zimtaldehyd stellt jedoch in Frage, dass die Bioaktivität von Zimtaldehyd wahrscheinlich auf die Summe seiner Metaboliten zurückzuführen ist. Es wird daher erwartet, dass weitere Versuche unternommen werden, um die möglichen Bedenken auszuräumen. Darüber hinaus muss der neu entwickelte SME-Zimtaldehyd mit verbesserter Bioverfügbarkeit auch auf seine antidiabetische Wirkung hin weiter untersucht werden.
Anwendungen
Zimtextrakte haben verschiedene positive Wirkungen, darunter antiallergische, antimikrobielle, antivirale, antioxidative, gastroprotektive, antiangiogene und Anti-Alzheimer-Wirkungen sowie insulinähnliche biologische Aktivitäten. Zimtaldehyd wirkt gegen Fettleibigkeit, indem es die Lipidakkumulation verringert und den Peroxisom-Proliferator-aktivierten Rezeptor-γ, das CCAAT/Enhancer-bindende Protein α und das Sterol-regulierende Element-bindende Protein 1 herunterreguliert. Außerdem hemmt Zimtaldehyd die Lipopolysaccharid-induzierte Mikroglia-Aktivierung, indem es auf das Low-Density-Lipoprotein-Rezeptor-bezogene Protein-1 abzielt. Es wurde auch berichtet, dass Zimtaldehyd antimutagene Wirkungen in Krebszellen hat. Die Wirkung von Zimtaldehyd bei der Behandlung von Krebs und Diabetes wird im Folgenden hervorgehoben:
Antikrebs
Kwon et al. berichteten zum ersten Mal, dass Zimtextrakte in vitro und in vivo den Tod von Melanomzellen durch die Hemmung von NF-κB und AP-1 induzieren. Eine nachfolgende Studie zeigte, dass HCA die wichtigste antitumorigene Verbindung in Zimtextrakten ist, die ihre wachstumshemmende Wirkung bei 29 Arten menschlicher Krebszellen in vitro und bei menschlichen SW620-Tumor-Xenografts in vivo entfaltet.
Andere Forschungsteams haben ebenfalls über antitumorigene Wirkungen von Zimtextrakten berichtet. Sie hemmen Melanomkrebszellen, indem sie die Expression von pro-angiogenen Faktoren induzieren; sie verbesserten auch die antitumorigene Aktivität von CD8-T-Zellen, indem sie deren zytolytische Aktivität erhöhten. Zimtextrakte hemmen auch den vaskulären endothelialen Wachstumsfaktor, was durch das Screening von Verbindungen auf ihre hemmende Wirkung gegen VEGFR2 entdeckt wurde. Die meisten der antitumorösen Wirkungen von Zimtextrakten können den Zimtaldehyden zugeschrieben werden, dem Hauptbestandteil des ätherischen Öls, der für den Geschmack und das Aroma des ganzen Zimts verantwortlich ist. Es wurde berichtet, dass Zimtaldehyde die Proliferation von Krebszellen durch Hemmung von Cyclin D1 in verschiedenen Tumorarten hemmen. Zimtaldehyde induzieren auch Apoptose durch die Erzeugung reaktiver Sauerstoffspezies in HL-60-Leukämiezellen und durch die Aktivierung von pro-apoptotischen Proteinen der Bcl-2-Familie und des MAPK-Signalwegs in menschlichen Hepatomzellen. Darüber hinaus zeigten dimere Zimtaldehyde, die aus HCA gewonnen werden, eine stärkere antitumorale Wirkung als monomere Zimtaldehyde, indem sie Apoptose und Zellzyklusstillstand induzierten. Darüber hinaus haben eine Reihe von Studien gezeigt, dass die antitumorösen Wirkungen von HCA und seinen Derivaten durch mehrere molekulare Mechanismen vermittelt werden. Eine kürzlich durchgeführte Studie zeigte, dass Polyphenole, die ein Zimtaldehyd-Gerüst tragen, bei cisplatinresistenten menschlichen Eierstockkrebszellen eine Verlangsamung des Zellzyklus in der G2/M-Phase und den apoptotischen Zelltod auslösen, was darauf hindeutet, dass Zimtaldehyd-Verbindungen in kombinierten Chemotherapien für Krebspatienten wirksam sein könnten. Insgesamt sind die molekularen Mechanismen, die den krebsbekämpfenden und antimetastatischen Wirkungen von Zimtaldehyden zugrunde liegen, vielfältig, was darauf hindeutet, dass Zimtaldehyd eine Substanz mit mehreren Angriffspunkten ist. Das unterschiedliche Ansprechen verschiedener Krebsarten auf verschiedene Zimtaldehyd-Derivate muss bewertet werden, um die Auswahl der wirksamsten Verbindung für jede Krebsart zu ermöglichen.
Anti-Diabetes
In den letzten Jahrzehnten wurden zahlreiche Studien durchgeführt, um die positive Rolle von Zimtaldehyd bei der Behandlung von Diabetes und seinen Komplikationen zu untersuchen. Es wurde nachgewiesen, dass die orale Verabreichung von Zimtaldehyd in einer Dosierung von 20 mg/kg Körpergewicht bis 40 mg/kg Körpergewicht pro Tag über einen Zeitraum von 21 bis 60 Tagen zu einer signifikanten Verbesserung des Blutzuckerspiegels und des glykosylierten Hämoglobins sowie der Insulinempfindlichkeit bei STZ-induzierten diabetischen Ratten führte. Es wird davon ausgegangen, dass 20 mg/kg Körpergewicht die wirksame Dosis zur Verhinderung der Entwicklung von Diabetes bei Tieren darstellt. Darüber hinaus erhöht eine vierwöchige Behandlung mit Zimtaldehyd den Plasmainsulinspiegel und den Glykogengehalt der Leber und senkt die Triglycerid- und Low-Density-Lipoprotein-Cholesterinwerte bei männlichen Wistar-Ratten, die mit STZ und/oder HFD behandelt wurden. Darüber hinaus fanden Camacho et al. heraus, dass die 5-wöchige Verabreichung von Zimtaldehyd an HFD-gefütterte C57BL/6J-Mäuse zu einer signifikanten Verringerung der Zunahme der Körperfettmasse führte. Sie behaupteten jedoch, dass die Behandlung mit Zimtaldehyd die Nüchterninsulinspiegel im Plasma und den Futterverbrauch nicht veränderte. Der Grund für die Unstimmigkeiten bei der Insulinregulierung könnte darin liegen, dass der genetische Hintergrund von C57BL/6J-Mäusen in einigen Produktionsstätten verändert wird. Die verschiedenen Unterstämme von Mäusen können erhebliche Unterschiede im Phänotyp aufweisen. Darüber hinaus könnte Zimtaldehyd in der Studie von Camacho eine glukosesenkende Wirkung durch Verbesserung der Insulinsensitivität in der Peripherie haben.
Zimtaldehyd ist in der Lage, das diabetische Fettgewebe zu verbessern, indem es die viszerale Fettablagerung reduziert und die Lipolyse, die Fettsäureoxidation und die Thermogenese fördert, was mit einer Hochregulierung von Genen für den Energieverbrauch einhergeht, einer Hemmung von PPARγ/CEBP-α und SREBP1, einer Hochregulierung von HSL und PNPLA2 und MGL, einer Induktion der AMPK-Phosphorylierung und einem Anstieg von Cpt1a in WAT und Acsl4 in BAT sowie einer Stimulation des sympathischen Nervensystems verbunden ist. Darüber hinaus verhindert Zimtaldehyd die Expression von Entzündungsgenen und verbessert die Expression von GLUTs bei diabetischen Tieren. Zimtaldehyd kann vor Diabetes schützen, indem es die Insulinsensitivität und die Glukoseaufnahme durch Regulierung des PI3K/IRS-1- und des RBP4-GLUT4-Stoffwechsels im Skelettmuskelgewebe verbessert und den Mitochondrien-Stoffwechsel durch den PGC-1α/MEF2/GLUT4-Stoffwechsel in C2C12-Zellen reguliert. Zimtaldehyd wirkt sich auch positiv auf die diabetische Leber aus, indem es die Glykogensynthese durch Regulierung der Aktivitäten von PK und PEPCK verbessert, den RBP4-Spiegel senkt und die abweichenden Leberenzyme normalisiert, was auf eine positive Rolle dieser Verbindung im Glukosestoffwechsel und in der Insulinsensitivität der diabetischen Leber hinweist.
Antimikrobielle Wirkung
Studien haben die antimikrobielle Aktivität von Zimtaldehyd, Nelken, Thymian und Rosmarin gegen E. coli O157:H7 und Salmonellen bestätigt. Wendakoon und Sakaguchi berichteten, dass sich die Carbonylgruppe von Zimtaldehyd an die Proteine bindet und so die Aminosäure-Decarboxylase-Aktivität in Enterobacter aerogenes verhindert. Smid et al. beobachteten die Schädigung der Zytoplasmamembran von Saccharomyces cerevisiae bei der Behandlung mit Zimtaldehyd, was zu einem übermäßigen Austritt von Metaboliten und Enzymen aus der Zelle und schließlich zum Verlust der Lebensfähigkeit führte. Die meisten Studien deuten darauf hin, dass die Wirkungsweise der ätherischen Öle von der Art der Mikroorganismen abhängt, vor allem von deren Zellwandstruktur und der Anordnung ihrer äußeren Membran. Sie beobachteten Schäden aufgrund der signifikanten Unterschiede in den äußeren Membranen von gram-negativen und gram-positiven Bakterien.
Toxizität
Auch heute noch gilt Zimtaldehyd als ein sicherer natürlicher Wirkstoff, der von Mensch und Tier gut vertragen wird. Das Konzept wird auch von der FDA und dem Europarat akzeptiert, die eine akzeptable Tagesdosis von 1,25 mg/kg vorschlagen.
Akute Toxizität
Cinnamaldehyd soll eine hohe Sicherheitsspanne haben, und die Verabreichung der 20-fachen wirksamen Dosis (20 mg/kg) dieser Verbindung führte während der gesamten Studie nicht zu abnormalen Verhaltenssymptomen und gestörten Serumchemiewerten. Die akute Toxizität von Zimtaldehyd ist gering, wobei die mittlere orale letale Dosis (LD50) bei verschiedenen Spezies von 0,6 g/kg Körpergewicht bis zu 3,4 g/kg Körpergewicht reicht.
Langzeittoxizität
Die Ergebnisse einer dreimonatigen Studie zeigen, dass das Körpergewicht bei weiblichen Ratten, die 16.500 oder 33.000 ppm ausgesetzt waren, und bei weiblichen Mäusen, die 8200 ppm oder mehr ausgesetzt waren, reduziert ist. Darüber hinaus ist die Futteraufnahme in allen exponierten Rattengruppen und in der Gruppe mit der höchsten Dosis bei Mäusen reduziert. Darüber hinaus erhöht die Exposition gegenüber Zimtaldehyd das Auftreten von Plattenepithelhyperplasien des Vormagens. Bei Mäusen, die Zimtaldehyd ausgesetzt waren, wurde außerdem eine erhöhte Inzidenz von olfaktorischer Epitheldegeneration in der Nasenhöhle festgestellt. Alle Ratten überlebten die dreimonatige Studie.
Sonstiges
Zinnamaldehyd kann auch zytotoxische Wirkungen in F344-Hepatozyten von Ratten zeigen, was sich durch eine Verringerung des Glutathion-Spiegels zeigt, und in HepG2-Zellen, was sich durch eine erhöhte Anzahl von Mikrokernen zeigt. Behar et al. untersuchten die potenzielle Toxizität dieses Produkts in menschlichen Embryo- und Lungenzellen. Die Ergebnisse zeigen, dass die Behandlung mit Zimtaldehyd die Mikrotubuli in menschlichen Lungenfibroblasten depolymerisiert. Zimtaldehyd verringert auch die Zellproliferation und -differenzierung durch Hemmung des Zellwachstums und der Zelldifferenzierung, durch Veränderung der Zellmorphologie und -motilität sowie durch Zunahme von DNA-Strangbrüchen und Zelltod. Eine von Olsen et al. durchgeführte Studie zeigt, dass Zimtaldehyd die Haut reizt, indem es die Kälteschmerzschwelle erhöht und die mechanische Schmerzschwelle senkt sowie die Hauttemperatur und die Hautdurchblutung beim Menschen erhöht.
- Zhou M, Chen Z, Shen S. Recent advanceson cinnamaldehyde. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. Cinnamaldehyde supplementation prevents fasting-induced hyperphagia, lipid accumulation, and inflammation in high-fat diet-fed mice. BioFactors 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Diabetic osteoporosis: Ein Überblick über die Verwendung in der traditionellen chinesischen Medizin und die klinische und präklinische Forschung. Evidence-based complementary and alternative medicine : eCAM 2016;2016:3218313.
- Dumas JP, E. Organic chemistry research – on cinnamon oil, the hippuric acid and sebacic acid. Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l’essence de cannelle“. Comptes rendus 1856;42:222-227.
- Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldehyde–a potential antidiabetic agent. Phytomedicine : international journal of phytotherapy and phytopharmacology 2007;14:15-22.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013. Zimtextrakt hemmt Degranulation und de novo Synthese von Entzündungsmediatoren in Mastzellen. Allergy 68: 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006. Antimikrobielle Aktivität von Zimt- und Nelkenöl unter modifizierten Atmosphärenbedingungen. Int J Food Microbiol 107: 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. HIV type-1 entry inhibitors with a new mode of action. Antivir Chem Chemother 19: 243-255.
- Yang CH, Li RX, Chuang LY. 2012. Antioxidative Aktivität verschiedener Teile von Cinnamomum cassia, extrahiert mit verschiedenen Extraktionsmethoden. Molecules 17: 7294-7304.
- Peterson DW et al. 2009. Zimtextrakt hemmt in vitro die mit der Alzheimer-Krankheit verbundene Tau-Aggregation. J Alzheimers Dis 17: 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012. In vivo und in vitro antidiabetische Wirkungen von wässrigem Zimtextrakt und mit Zimtpolyphenol angereicherter Lebensmittelmatrix. Food Chem 135: 2994-3002.
- Kim JE et al. 2015a. Ein neuartiges, mit Zimt verwandtes Naturprodukt mit Pim-1 hemmender Aktivität hemmt Leukämie und Hautkrebs. Cancer Res 75: 2716-2728.
- Hwang H et al. 2011. 2′-Hydroxycinnamaldehyd zielt auf Low-Density-Lipoprotein-Rezeptor-bezogenes Protein-1 ab, um Lipopolysaccharid-induzierte Mikroglia-Aktivierung zu hemmen. J Neuroimmunol2011 230: 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. Die antimutagene Wirkung von Vanillin und Zimtaldehyd auf die Spontanmutation in Salmonella TA104 ist auf eine Verringerung der Mutationen an GC-, aber nicht AT-Stellen zurückzuführen. Mutat Res 480: 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. Forschungsfortschritt der pharmakologischen Wirkungen von trans-Zimtaldehyd. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Pharmacokinetic study of cinnamaldehyde in rats by gc-ms after oral and intravenous administration. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al. 1998. Synthese und in vitro Zytotoxizität von Zimtaldehyden auf menschliche solide Tumorzellen. Arch Pharm Res 21: 147-152.
- Lee CW et al. 1999. Inhibition of human tumor growth by 2′-hydroxyand 2′-benzoyloxycinnamaldehydes. Planta Med 65: 263-266
- Kwon HK et al. 2009. Zimtextrakt unterdrückt die Tumorprogression durch Modulation der Angiogenese und der Effektorfunktion von CD8+ T-Zellen. Cancer Lett 278: 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. Novel angiogenesis inhibitory activity in cinnamon extract blocks VEGFR2 kinase and downstream signaling. Carcinogenesis 31: 481-488.
- Jeong HW et al. 2000. Cinnamaldehyde hemmen die Cyclin-abhängige Kinase 4/Cyclin D1. Bioorg Med Chem Lett 10: 1819-1822.
- Ka H et al. 2003. Cinnamaldehyd induziert Apoptose durch ROS-vermittelten mitochondrialen Permeabilitätsübergang in menschlichen promyelozytären Leukämiezellen HL-60. Cancer Lett 196: 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. Cinnamaldehyd-induzierte Apoptose in menschlichen PLC/PRF/5-Zellen durch Aktivierung der proapoptotischen Proteine der Bcl-2-Familie und des MAPK-Wegs. Life Sci 77: 938-951.
- Shin DS et al. 2006. Synthese und biologische Bewertung von dimeren Zimtaldehyden als potente Antitumormittel. Bioorg Med Chem 14: 2498-2506.
- Shin SY et al. 2014. Polyphenole mit Zimtaldehydgerüst zeigen zellwachstumshemmende Effekte auf die cisplatinresistenten A2780/Cis-Eierstockkrebszellen. Bioorg Med Chem 22: 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. Chemische Zusammensetzung und hypoglykämische und pankreasschützende Wirkung von ätherischem Blattöl aus einheimischem Zimt. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Cinnamaldehyde protects from the hypertension associated with diabetes. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2011;49:3007-3012.
- Li M, Xu Y, Zhang W. Effects of cinnamaldehyde on the expression levels of irs-1 and p85 alpha in gastrocnemius of type 2 diabetic rats. Medical Journal of Wuhan University 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Gc-ms analysis and screening of antidiabetic, antioxidant and hypolipidemic potential of cinnamomum tamala oil in streptozotocin induced diabetes mellitus in rats. Cardiovascular diabetology 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. Anti-obesity and anti-hyperglycemic effects of cinnamaldehyde via altered ghrelin secretion and functional impact on food intake and gastric emptying. Scientific Reports 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR. Der c57bl/6j-Mausstamm Hintergrund modifiziert die Wirkung einer Mutation in bcl2l2. G3 2012;2:99-102.
- Mekada K, Abe K, Murakami A, Nakamura S, Nakata H, Moriwaki K, Obata Y, Yoshiki A. Genetic differences among c57bl/6 substrains. Experimental animals 2009;58:141-149.
- Kiselycznyk C, Holmes A. All mice are not created equal. Frontiers in Neuroscience 2011;5:10.
- Attane C, Peyot ML, Lussier R, Zhang D, Joly E, Madiraju SR, Prentki M. Differential insulin secretion of high-fat diet-fed c57bl/6nn and c57bl/6nj mice: Implications of mixed genetic background in metabolic studies. PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK, Mermierd. CM, Conne. CA, Vaughanc. RA. Trans-Zimtaldehyd stimuliert die mitochondriale Biogenese durch pgc-1α und pparβ/δ, was zu einer erhöhten Glut4-Expression führt. Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. Antidiabetische Wirkungen von Zimtaldehyd und Berberin und ihre Auswirkungen auf die Expression des Retinol-bindenden Proteins 4 bei Ratten mit Diabetes mellitus Typ 2. Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Erhöhte p85/55/50-Expression und verringerte Phosphotidylinositol-3-Kinase-Aktivität in insulinresistenten menschlichen Skelettmuskeln. Diabetes 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS. Auswirkungen des hämatopoetischen Cyclooxygenase-1-Mangels auf die mit Fettleibigkeit verbundene Entzündung des Fettgewebes und Stoffwechselstörungen bei Mäusen. Metabolism: clinical and experimental 2013;62:1673-1685.
- Ohaeri OC. Wirkung von Knoblauchöl auf die Spiegel verschiedener Enzyme im Serum und Gewebe von streptozotocin-diabetischen Ratten. Bioscience reports 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH. Bewertung von neutrophilem Gelatinase-assoziiertem Lipocalin (ngal] und Retinol-bindendem Protein 4 bei Typ-2-Diabetikern mit Nephropathie. Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. and CORKE, H. 2007. Antibakterielle Eigenschaften und wichtige bioaktive Bestandteile der Zimtstange: Aktivität gegen lebensmittelbedingte krankheitserregende Bakterien. J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K. and REMMAL, A. 2003. Der Mechanismus der bakteriziden Wirkung der ätherischen Öle von Oregano und Nelke und ihrer phenolischen Hauptbestandteile auf Escherichia coli und Bacillus subtilis. J. Essent. Oil Res. 15, 356-362.
- KIM, H.-O., PARK, S.-W. and PARK, H.-D. 2004. Inaktivierung von Escherichia coli O157:H7 durch Zimtaldehyd, gereinigt aus Cinnamomum cassia-Sprossen. Food Microbiol. 21, 105-110
- WENDAKOON, C. und SAKAGUCHI, M. 1995. Inhibition of amino acid decarboxylase activity of Enterobacter aerogenes by active components in spices. J. Food Prot. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. und GORRIS, L.G.M. 1996. Fungizide und fungistatische Wirkung der sekundären Pflanzenmetaboliten Cinnamaldehyd und Carvon. In Modern Fungicides and Antimicrobial Compounds pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. From type 2 diabetes to antioxidant activity: Eine systematische Übersicht über die Sicherheit und Wirksamkeit von Zimtrinde und Cassia-Zimt. Canadian journal of physiology and pharmacology 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Insulinotropic effect of cinnamaldehyde on transcriptional regulation of pyruvate kinase, phosphoenolpyruvate carboxykinase, and glut4 translocation in experimental diabetic rats. Chemico-biological interactions 2010;186:72-81.
- Gowder SJT. Safety assessment of food flavor -cinnamaldehyde. Biosafety 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR. Untersuchungen zur Toxikologie und Karzinogenese von mikroverkapseltem trans-Zimtaldehyd bei Ratten und Mäusen. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes. Toxicology in vitro : an international journal published in association with BIBRA 1996;10:37-42.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens. Mutagenesis 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribution, quantification and toxicity of cinnamaldehyde in electronic cigarette refill fluids and aerosols. Tobacco control 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Somatosensory and vasomotor manifestations of individual and combined stimulation of trpm8 and trpa1 using topical l-menthol and trans-cinnamaldehyde in healthy volunteers. European journal of pain 2014;18:1333-1342.
Chemische Eigenschaften
trans-Zimtaldehyd ist der Hauptbestandteil von Cassiaöl (ca. 90%) und Sri-Lanka-Zimtrindenöl (ca. 75%). Geringere Mengen sind in vielen anderen ätherischen Ölen enthalten. In der Natur ist das trans-Isomer vorherrschend.
trans-Zimtaldehyd ist eine gelbliche Flüssigkeit mit einem charakteristischen würzigen Geruch, der stark an Zimt erinnert. Als ungesättigter Aldehyd durchläuft er zahlreiche Reaktionen, von denen die Hydrierung zu Zimtalkohol, Dihydrozimtaldehyd und Dihydrozimtalkohol wichtig ist. Zimtsäure wird durch Selbstoxidation gebildet.
In der Industrie wird Zimtaldehyd fast ausschließlich durch alkalische Kondensation von Benzaldehyd und Acetaldehyd hergestellt. Die Selbstkondensation von Acetaldehyd kann durch Verwendung eines Überschusses an Benzaldehyd und durch langsame Zugabe von Acetaldehyd vermieden werden.
Zimtaldehyd wird in vielen Zusammensetzungen zur Erzeugung von würzigen und orientalischen Noten (z. B. Seifenparfüm) verwendet. Es ist der Hauptbestandteil von künstlichem Zimtöl. Darüber hinaus ist es ein wichtiges Zwischenprodukt bei der Synthese von Zimtalkohol und Dihydrozimtalkohol.
Chemische Eigenschaften
KLEINE GELBE FLÜSSIGKEIT
Chemische Eigenschaften
Brennbare, gelbliche, ölige Flüssigkeit (verdickt sich bei Luftzutritt). Starker stechender, würziger, zimtartiger Geruch.
Definition
ChEBI: Das E (trans)-Stereoisomer des Zimtaldehyds, der Stamm der Klasse der Zimtaldehyde.
Synthese Referenz(en)
Chemistry Letters, 12, S. 1207, 1983
Journal of the American Chemical Society, 93, S. 2080, 1971 DOI: 10.1021/ja00737a057
Tetrahedron Letters, 18, S. 1215, 1977
Allgemeine Beschreibung
Klare gelbe Flüssigkeit mit einem Geruch nach Zimt und einem süßen Geschmack.
Luft &Wasser Reaktionen
Kann empfindlich sein bei längerer Einwirkung von Luft und Licht. Unlöslich in Wasser.
Reaktivitätsprofil
trans-Zimtaldehyd ist unverträglich mit starken Oxidationsmitteln und starken Basen. trans-Zimtaldehyd kann auch mit Natriumhydroxid reagieren.
Brandgefahr
trans-Zimtaldehyd ist brennbar.
Potenzielle Exposition
Botanisches Fungizid und Insektizid. Wird als Antipilzmittel, Maiswurzelbohrer-Lockmittel und Hunde- und Katzenabwehrmittel verwendet. Kann auf Bodenhüllen für Pilze, Reihenkulturen, Rasen und alle Lebensmittelprodukte verwendet werden. Nicht für die Verwendung in EU-Ländern gelistet.
Versand
UN1989 Aldehyde, n.o.s., Gefahrenklasse: 3; Kennzeichnungen: 3 – Entzündbarer flüssiger Stoff
Inkompatibilitäten
Aldehyde sind häufig an Selbstkondensations- oder Polymerisationsreaktionen beteiligt. Diese Reaktionen sind exotherm; sie werden oft durch Säure katalysiert. Aldehyde lassen sich leicht zu Carbonsäuren oxidieren. Durch die Kombination von Aldehyden mit Azo- und Diazoverbindungen, Dithiocarbamaten, Nitriden und starken Reduktionsmitteln entstehen brennbare und/oder giftige Gase. Aldehyde können mit Luft reagieren, wobei zunächst Peroxosäuren und schließlich Carbonsäuren entstehen. Diese Autoxidationsreaktionen werden durch Licht aktiviert, durch Salze von Übergangsmetallen katalysiert und sind autokatalytisch (sie werden durch die Produkte der Reaktion katalysiert). Der Zusatz von Stabilisatoren (Antioxidantien) zu Aldehydsendungen verzögert die Autoxidation. Unverträglich mit Oxidationsmitteln (Chlorate, Nitrate, Peroxide, Permanganate, Perchlorate, Chlor, Brom, Fluor usw.); Kontakt kann Brände oder Explosionen verursachen. Von alkalischen Materialien, starken Basen, starken Säuren, Oxosäuren, Epoxiden, Ketonen, Azofarbstoffen, Ätzmitteln, Boranen, Hydrazinen fernhalten
Abfallentsorgung
Verbrennung. Gemäß 40CFR165 die Empfehlungen für die Entsorgung von Pestiziden und Pestizidbehältern befolgen.