Unter den menschlichen Neisseria und verwandten Arten reduzieren drei Arten – N. mucosa, M. catarrhalis und K. denitrificans – Nitrat. Der Nitratreduktionstest ist ein entscheidender Test zur Unterscheidung zwischen N. gonorrhoeae und K. denitrificans, insbesondere wenn Stämme von K. denitrificans in gefärbten Ausstrichen als gramnegative Diplokokken erscheinen.
Grundsatz
Bakterienarten können auf der Grundlage ihrer Fähigkeit, Nitrat zu Nitrit oder stickstoffhaltigen Gasen zu reduzieren, unterschieden werden. Unter den Neisseriaceae menschlichen Ursprungs reduzieren die Stämme von Neisseria mucosa, Moraxella catarrhalis und Kingella denitrificans Nitrat. Stämme von M. catarrhalis und K. denitrificans sind fälschlicherweise als N. gonorrhoeae identifiziert worden. Der Nitratreduktionstest ermöglicht die Unterscheidung zwischen diesen nitratpositiven Arten und N. gonorrhoeae (nitratnegativ). Die Nitratreduktion kann bei einigen Arten mit anaerober Atmung gekoppelt sein.
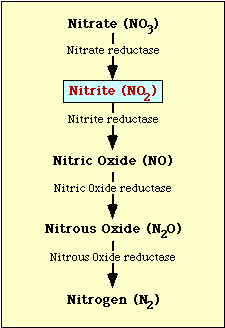
Der biochemische Weg der Nitratreduktion ist in Abbildung 1 dargestellt. Nitrat wird zu Nitrit reduziert, das dann zu Stickstoffmonoxid, Distickstoffmonoxid oder Stickstoff reduziert werden kann (Abbildung 1).
Abbildung 1. Nitratreduktionsweg.
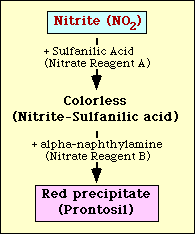
Der Nitratreduktionstest basiert auf dem Nachweis von Nitrit im Medium nach der Inkubation mit einem Organismus. Ist Nitrit im Medium vorhanden, reagiert es mit Sulfanilsäure (Nitratreagenz A) und bildet einen farblosen Komplex (Nitrit-Sulfanilsäure). Dieser Komplex ergibt dann einen roten Niederschlag (Prontosil), wenn Nitratreagenz B (alpha-Naphthylamin) zu dem Test hinzugefügt wird, wie in Abbildung 2 dargestellt.
Abbildung 2. Schematische Darstellung des Nachweises von Nitrit im Medium.
Eine rote Farbe wird im Medium nur erzeugt, wenn Nitrit im Medium vorhanden ist. Das Fehlen einer roten Farbe im Medium nach Zugabe von Sulfanilsäure und alpha-Naphthylamin bedeutet nur, dass Nitrit im Medium nicht vorhanden ist. Für diese Beobachtung kann es zwei Erklärungen geben.
- Das Nitrat kann nicht reduziert worden sein; der Stamm ist nitratnegativ.
- Das Nitrat kann zu Nitrit reduziert worden sein, das dann vollständig zu Stickstoffmonoxid, Distickstoffmonoxid oder Stickstoff reduziert worden ist, der nicht mit den Reagenzien reagiert, die mit Nitrit reagieren; der Stamm ist nitratpositiv.
Jedes Testmedium, das nach Zugabe der Nitratreagenzien ein negatives Ergebnis liefert, muss weiter getestet werden, um festzustellen, welche der beiden Interpretationen zutreffend ist.
Ein erfolgreicher Nitratreduktionstest hängt davon ab, dass der Test unter den richtigen Bedingungen durchgeführt wird.
- Die Reaktion läuft am besten ab, wenn das Ausgangsmedium das Wachstum des Organismus unterstützt. Obwohl einige Neisseria-Spezies in Brühe-Medien nicht gut wachsen, kann der Nitrat-Reduktionstest erfolgreich in einem Medium durchgeführt werden, das das Wachstum nicht unterstützt, indem das Medium stark beimpft wird, um genügend vorgebildetes Enzym für die Reaktion bereitzustellen.
- Die Nitratreaktion findet nur unter anaeroben Bedingungen statt. Das nitrathaltige Medium wird in Röhrchen dosiert, um ein geringes Verhältnis von Oberfläche zu Tiefe zu erhalten, das die Diffusion von Sauerstoff in das Medium begrenzt, z. B. werden 5 ml Medium in ein Röhrchen mit 13 mm Durchmesser dosiert. Neisseria und verwandte Spezies nutzen den Sauerstoff im Medium und stellen schnell anaerobe Bedingungen her, die ideal für die Reduktion von Nitrat sind.
Der Nitratreduktionstest wird in einem Medium durchgeführt, das 0,2 % Kaliumnitrat enthält. Das Medium wird mit einer Reinkultur des verdächtigen Organismus stark beimpft und 48 Stunden lang bei 35C bis 36,5C in einem Inkubator mit oder ohne zusätzliches Kohlendioxid bebrütet.
Die Nitratreduktion wird mit den Reagenzien nach Griess Llosvay, Sulfanilsäure und alpha-Naphthylamin nachgewiesen. Sulfanilsäure (Nitratreagenz A) wird dem Inkubationsgemisch zugesetzt und bildet mit dem im Medium vorhandenen Nitrit einen Komplex (Nitrit-Sulfanilsäure). Wenn alpha-Naphthylamin (Nitratreagenz B) dem Inkubationsmedium zugesetzt wird, bildet sich mit einem im Medium vorhandenen Nitrit-Sulfanilsäure-Komplex ein roter Niederschlag (Prontosil).
Ein Organismus kann als nitratpositiv gemeldet werden, wenn sich nach Zugabe der Nitratreagenzien A und B zum Medium eine rote Farbe entwickelt, was darauf hinweist, dass der Organismus Nitrat zu Nitrit reduziert hat.
Das Fehlen einer roten Farbe nach Zugabe beider Reagenzien bedeutet nicht automatisch, dass der Organismus Nitrat nicht reduzieren kann. Stämme können das Nitrat zu Nitrit reduziert haben und dann das Nitrit vollständig zu stickstoffhaltigen Gasen reduzieren, die nicht nachgewiesen werden, wenn die Nitratreagenzien A und B dem Medium zugesetzt werden. Wenn sich das Medium nach Zugabe von Sulfanilsäure und alpha-Naphthylamin nicht verfärbt, wird dem bebrüteten Medium eine kleine Menge („Messerspitze“) Zinkstaub zugesetzt. Der Zinkstaub katalysiert die Reduktion von Nitrat zu Nitrit auf chemischem Wege. Wenn also das Nitrat von den Organismen nicht reduziert wurde, d. h. sie sind nitratnegativ, wird es durch den Zinkstaub reduziert, und im bebrüteten Medium entwickelt sich innerhalb von 15 Minuten eine rote Farbe. Entwickelt sich nach der Zugabe von Zinkstaub keine Farbe im bebrüteten Medium, haben die Organismen nicht nur Nitrat zu Nitrit reduziert, sondern auch Nitrit zu stickstoffhaltigen Gasen; diese Organismen sind auch nitratpositiv.
Obwohl Nitratmedium mit umgekehrten Durham-Röhrchen zum Nachweis der Gasproduktion geliefert wird, wird die Gasproduktion bei Neisseria-Arten nicht erfasst. Obwohl einige Arten Nitrat über Nitrit hinaus zu stickstoffhaltigen Gasen reduzieren können, sammelt sich kein Gas im Röhrchen an. Die Ansammlung von Gas hängt von der Geschwindigkeit ab, mit der es produziert wird. Wenn Gas sehr langsam produziert wird, kann es sich im Medium auflösen und sich nicht im Durham-Röhrchen ansammeln.
Probenanforderungen
Optimales Exemplar: Eine Reinkultur eines verdächtigen gramnegativen, oxidase-positiven Diplokokkus (Neisseria spp. oder M. catarrhalis) auf Schokoladenagar, bebrütet in einer mit Kohlendioxid angereicherten Atmosphäre bei 35°C bis 36,5°C für 18 bis 24 Stunden.
Unzulässige Proben: Kulturen von Isolaten auf Schokoladenagar, die in einer mit Kohlendioxid angereicherten Atmosphäre bei 35°C bis 36,5°C für mehr als 24 Stunden bebrütet wurden.
Fehlende Faktoren, die die Testergebnisse beeinflussen:
- Das Testmedium muss stark genug beimpft werden, damit eine Reaktion mit den vorgebildeten Enzymen stattfinden kann. Ein unzureichendes Inokulum erlaubt es den Organismen möglicherweise nicht, Sauerstoff zu verbrauchen, um anaerobe Bedingungen zu schaffen, unter denen die Nitratreduktion stattfinden kann.
- Zuviel Zinkstaub, der dem bebrüteten Röhrchen zugesetzt wird, kann zu einer sehr schnellen Reduktion von Nitrat über Nitrit hinaus zu stickstoffhaltigen Gasen führen, so dass Nitrit nicht nachgewiesen wird.
Stabilität der Probe: Der Nachweis der Nitratreduktion bei Neisseria und verwandten Spezies hängt vom Vorhandensein präformierter Enzyme ab.
- Die Tests sollten nur mit Inokulum durchgeführt werden, das aus 24-Stunden-Kulturen gewonnen wurde.
- Nitratmedium sollte innerhalb von 30 Minuten nach Entnahme der Kultur aus dem Inkubator beimpft werden; eine längere Lagerung der Kultur bei Raumtemperatur kann zu einer verminderten Enzymaktivität führen.
Medium/Reagenzien
Medium: Nitratbrühe (Herzinfusionsbrühe mit 0,2 % Kaliumnitrat)
Herzinfusionsbrühe (Difco), 25,0 g
Kaliumnitrat, 2,0 g
Destilliertes Wasser, 1000,0 ml
- Die Zutaten in destilliertem Wasser auflösen; Lösung auf pH 7 einstellen.0.
- Aliquote von 5 ml der Brühe in 16-mm-x-100-mm-Röhrchen mit Gaseinsätzen (Durham-Röhrchen, 6-mm x 50-mm) verteilen.
- 15 Minuten lang bei 121C autoklavieren.
Medium bis zur Verwendung bei 4C bis 10C (gekühlt) lagern. Vor der Inokulation das Medium auf Raumtemperatur vorwärmen.
Reagenzien: Sulfanilsäurelösung (Nitratreagenz A): 0,8% in 5N Essigsäure
Chemischer Name: 4-Aminobenzolsulfonsäure
Nitratreagenz A bei 15C bis 30C (Raumtemperatur) bis zu 3 Monate im Dunkeln lagern. Die Reagenzien können in dunkelbraunen Glasbehältern aufbewahrt werden; die Flaschen können in Aluminiumfolie eingewickelt werden, um Dunkelheit zu gewährleisten.
Alpha-Naphthylamin-Lösung (Nitratreagenz B): 0,6% in 5N Essigsäure
Chemischer Name: N,N-Dimethyl-1-naphthylamin
Nitratreagenz B bei 2C bis 8C (gekühlt) bis zu 3 Monate im Dunkeln lagern. Die Reagenzien können in dunkelbraunen Glasbehältern aufbewahrt werden; die Flaschen können in Aluminiumfolie eingewickelt werden, um die Dunkelheit zu gewährleisten.
Zinkpulver, Reagenzienqualität: Bei Raumtemperatur (15C bis 30C) aufbewahren.
Warnung: Essigsäure ist ätzend. Kontakt mit der Haut kann Blasen und Verbrennungen verursachen. Bei Berührung Augen und Haut sofort mit reichlich Wasser spülen (mindestens 15 Min. lang).
Qualitätskontrolle/Prüfverfahren
QC-Stämme:
- Nitratreduktase-positive Kontrolle: Kingella denitrificans, CDC 10.236
- Nitratreduktase-negative Kontrolle: Neisseria gonorrhoeae, ATCC 43069
QC-Stämme werden bei -70C in einer Lösung von tryptischer Sojabouillon mit 20% Glycerin gelagert. Die Reaktionen der Kontrollstämme sollten zum Zeitpunkt der Herstellung der gefrorenen Bestände bestätigt werden. QC-Stämme können bei -70°C bis zu 2 Jahre gelagert werden.
Vorgehensweise:
QC-Stämme werden auf die gleiche Weise getestet wie klinische Isolate. QC-Stämme sollten nach der Erstkultur aus der gefrorenen Probe mindestens einmal subkultiviert werden, bevor der Test durchgeführt wird. Klinische Isolate können von einem Selektivmedium oder von gereinigten Subkulturen subkultiviert werden. Sicherstellen, dass die Kulturen rein sind.
- Fläschchen mit Kontrollstämmen, die bei -70°C gelagert wurden, auftauen.
- Auf Platten mit Schokoladenagar oder ergänztem GC-Agar zur Isolierung aufbrechen. Bei 35C bis 36,5C in einer mit Kohlendioxid angereicherten Atmosphäre 18 bis 24 Stunden lang bebrüten.
-
Mit einem sterilen Tupfer eine schwere Suspension von gut isolierten Kolonien aus einer Reinkultur des Isolats herstellen, das auf Schokoladenmedium bei 35C bis 36.5 C in einer mit Kohlendioxid angereicherten Atmosphäre 18 bis 24 Stunden lang inkubieren. Das Testmedium so beimpfen, daß sich eine starke Trübung ergibt.
Anmerkung: Stämme von N. gonorrhoeae und einige andere Neisseria spp. wachsen möglicherweise nicht in diesem Medium. Daher kann die Reaktion von vorgebildetem Enzym abhängig sein.
- Inokulierte Medien und ein Röhrchen mit einem uninokulierten Kontrollmedium bei 35C bis 36,5 C in einer mit Kohlendioxid angereicherten Atmosphäre 48 Stunden lang bebrüten.
-
Nach 48 Stunden Inkubation mit Pasteurpipetten 5 Tropfen Reagenz #A, gefolgt von 5 Tropfen Reagenz #B in jedes Röhrchen geben. Das Röhrchen gut schütteln, um die Reagenzien mit dem Medium zu vermischen.
Die Suspension auf eine rosa-rote Farbe untersuchen, die sich innerhalb weniger Minuten entwickeln sollte, wenn das Medium noch warm ist. Die Reaktion kann etwas länger dauern, wenn das Medium bei der Zugabe der Reagenzien kalt ist.
Färbt sich die Suspension vor der Zugabe des Zn-Pulvers rosa-rot, ist die Reaktion positiv und der Test ist abgeschlossen. Schritt 4 nicht durchführen.
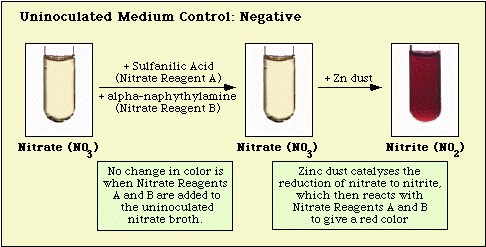
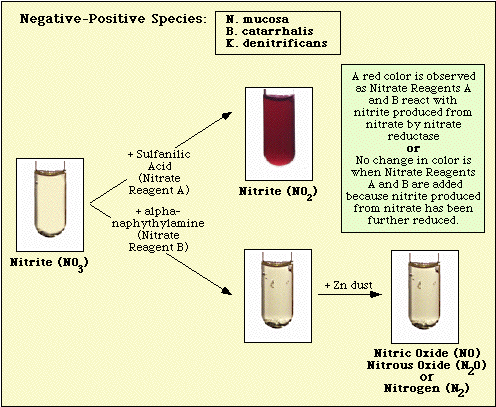
Reaktionen, die mit dem nicht angeimpften Kontrollmedium, nitratnegativen und nitratpositiven Isolaten beobachtet wurden, sind in Abbildung 3, Abbildung 4 bzw. Abbildung 5 dargestellt.
-
Ist die Suspension nach Zugabe der Reagenzien A und B farblos, eine kleine Menge (4 bis 5 mg; „scharfe Messerspitze“) Zinkstaub in das Medium geben. Das Röhrchen kräftig schütteln und 10-15 Minuten bei Raumtemperatur stehen lassen.
Bleibt das Medium nach der Zugabe von Zn-Pulver farblos, ist das Testergebnis positiv.
Färbt sich das Medium nach der Zugabe von Zn-Pulver rosa, ist das Ergebnis negativ. - Ergebnisse ablesen und aufzeichnen.
Abbildung 3. Mit ungeimpftem Nitratmedium beobachtete Reaktion.
Abbildung 4. Mit Nitrat-negativen Spezies beobachtete Reaktion.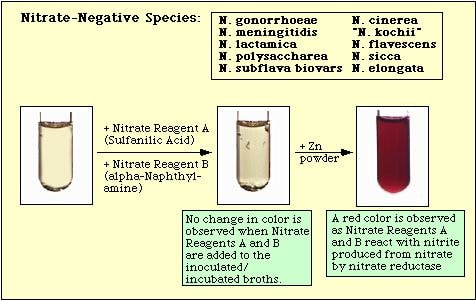
Abbildung 5. Bei nitratpositiven Arten beobachtete Reaktionen.
Qualitätskontrollplan:
- Ein Nitratreduktase-QC-Test wird an jedem Tag durchgeführt, an dem klinische Isolate getestet werden.
Probleme & Lösungen
Der Nitratreduktionstest kann falsch-negative oder falsch-positive Ergebnisse liefern, wenn das Medium nicht korrekt hergestellt oder der Test nicht korrekt durchgeführt wird. Die Reaktion in diesem Test hängt von einer Reihe von Faktoren ab.
- Wird in dem Kontrollröhrchen mit ungeimpftem Medium nach Zugabe von Zinkstaub keine rosa Farbe festgestellt, so kann dies daran liegen, dass (1) das Medium kein Nitrat enthält oder (2) zu viel Zinkstaub zugegeben wurde, der die Reduktion von Nitrat über Nitrit hinaus zu stickstoffhaltigen Gasen katalysiert hat. Die einfachste Lösung besteht darin, mehr Nitratmedium zu beschaffen und sicherzustellen, dass dem Grundmedium Nitrat zugesetzt wurde. Alternativ kann das Medium mit einem positiven Kontrollstamm beimpft werden, wobei jedoch nach einer kürzeren Inkubationszeit auf eine Reaktion zu prüfen ist; Stämme von N. mucosa erzeugen nach einigen Stunden Inkubation eine positive Nitritreaktion. Wenn bestätigt wird, dass das Medium Nitrat enthält, wiederholen Sie den Test, bis Sie die richtige Menge an Zinkstaub bestimmt haben, die Sie hinzufügen müssen. Es ist wichtig zu wissen, wie viel Zinkstaub dem Test zugesetzt werden muss. Die Zugabe von zu viel Zinkstaub kann zu einem falsch-positiven Ergebnis führen.
- Wenn in der Kontrolle des ungeimpften Mediums eine rosa Farbe festgestellt wird, nachdem die Nitratreagenzien A und B dem Medium zugesetzt wurden, ist das Medium mit Nitrit kontaminiert. Die einzige Lösung besteht darin, eine neue Charge Medium zu erhalten, die nicht mit Nitrit verunreinigt ist.
- Wenn der positive Kontrollstamm, Kingella denitrificans, in einem nitrathaltigen Medium keine positive Reaktion zeigt, kann dies nur dann der Fall sein, wenn der Stamm nicht K. denitrificans ist. Überprüfen Sie erneut die Identität des positiven Kontrollstammes. Wählen Sie eine neue Kultur des Kontrollstammes und wiederholen Sie den Test. Wird mit dem negativen Kontrollstamm, N. gonorrhoeae, ein positiver Nitratreduktasetest durchgeführt, so ist entweder der negative Kontrollstamm nicht N. gonorrhoeae oder die Kultur ist mit einem nitratpositiven Organismus kontaminiert. Reinheit und Identität des Gonokokken-Referenzstamms erneut überprüfen. Wiederholen Sie den Test mit einer Reinkultur einer bestätigten Kultur von N. gonorrhoeae.
- Die Nitratreduktionsreaktion zeigt die Fähigkeit von Organismen an, Nitrat zu reduzieren, eine Reaktion, die nur unter anaeroben Bedingungen auftritt; die Reaktion findet nicht statt, wenn die Organismen kontinuierlich mit Sauerstoff versorgt werden. Daher kann die Reaktion in stillen Kulturen (insbesondere bei langsam wachsenden Arten), in denen das Medium in flachen Schichten verteilt ist, die eine Diffusion von Sauerstoff in das Medium ermöglichen, nicht auftreten. Ein Test, um festzustellen, ob Sauerstoff im Medium vorhanden ist, kann durch Zugabe eines Tropfens Oxidase-Reagenz in das Medium durchgeführt werden. Wenn sich das Medium violett färbt, enthält das Medium Sauerstoff und die Nitratreduktionsreaktion kann nicht stattfinden. Bleibt das Medium farblos, enthält das Medium keinen Sauerstoff und der Nitratreduktionstest kann stattfinden. Es wurde festgestellt, dass N. gonorrhoeae-Zellen den Sauerstoff schnell aufbrauchen, wenn genügend Zellen in das Medium beimpft werden. Wenn nach etwa 1 bis 2 Stunden Inkubation Oxidase-Reagenz zugegeben wird, bleibt das Medium klar. Da das Oxidase-Reagenz die im Medium vorhandenen Gonokokken abtötet, wird sich das Medium allmählich violett färben, beginnend am oberen Rand des Röhrchens, wenn der Sauerstoff in das Medium diffundiert. Wird das Medium in Röhrchen mit anderen Abmessungen als den oben vorgeschlagenen dosiert, so ist darauf zu achten, dass das Verhältnis von Oberfläche zu Tiefe mindestens so groß oder kleiner ist als die oben vorgeschlagenen. Ist der Durchmesser des Röhrchens, in das das Medium gegeben wird, größer als oben beschrieben, so ist ein größeres Volumen des Mediums zu verwenden, um das gleiche Verhältnis von Oberfläche zu Tiefe beizubehalten.
-
Die Nitratreduktionsreaktion tritt möglicherweise nicht auf, wenn das Medium, in dem der Test durchgeführt wird, kein normales Wachstum des Organismus zulässt. Der Test kann jedoch auch in einem Medium durchgeführt werden, das das Wachstum der Organismen nicht unterstützt, wenn das Inokulum so dicht ist, dass die vorgebildeten Enzyme den vorhandenen Sauerstoffvorrat erschöpfen und das Nitrat schneller reduzieren können als der Sauerstoff in das Medium diffundiert.
Hinweis: Um zu überprüfen, ob der Sauerstoff aus dem Medium entfernt wurde, gibt man 2 bis 3 Tropfen Oxidase-Reagenz in ein Duplikat des angeimpften Mediums. Wenn der Sauerstoff ausreichend aus dem Medium entfernt wurde, färbt sich das Oxidase-Reagenz nicht sofort violett. Enthält das Medium gelösten Sauerstoff, färbt sich das Oxidase-Reagenz violett. Man beachte auch, dass der Nitratreduktionstest in einem Medium durchgeführt werden kann, dem das Oxidase-Reagenz zugesetzt wurde.
- Wenn Reagenz A dem Testmedium zugesetzt wird, bildet Nitrit, das infolge der Reduktion von Nitrat entsteht, einen Komplex mit der Sulfanilsäure, der mit dem alpha-Naphthylamin in Reagenz B einen roten Niederschlag bildet. Das Fehlen einer roten Farbe nach Zugabe der Reagenzien A und B bedeutet jedoch nicht unbedingt, dass das Nitrat nicht reduziert wurde. Das Ausbleiben einer Rotfärbung kann bedeuten, dass (1) das Nitrat nicht reduziert wurde oder (2) dass das Nitrit, das als Ergebnis der Nitratreduktion entsteht, selbst zu stickstoffhaltigen Gasen reduziert wurde. Um festzustellen, ob das Nitrit reduziert wurde, gibt man eine kleine Menge Zinkstaub in die Inkubationsmischung, wenn diese nach Zugabe der Reagenzien A und B farblos ist. Der Zinkstaub katalysiert die Reduktion von Nitrat zu Nitrit; in dem Medium, das noch nicht reduziertes Nitrat enthält, sollte sich eine rote Farbe entwickeln. Es ist jedoch wichtig, nicht zu viel Zinkstaub hinzuzufügen; überschüssiger Zinkstaub katalysiert die Reduktion des aus dem Nitrat gebildeten Nitrits, was zu einem farblosen Medium und einer falschen Interpretation des Tests als positiv (falsch-positives Ergebnis) führt.
- Ein positiver Nitratreduktase-Test mit dem negativen Kontrollstamm, N. gonorrhoeae, nach der Zugabe von Zinkstaub zeigt an, dass das Nitrat über Nitrit hinaus reduziert wurde, was wahrscheinlich auf die Zugabe von zu viel Zinkstaub zum Test zurückzuführen ist. Wiederholen Sie den Test und achten Sie darauf, dass Sie nur sehr wenig Zinkstaub hinzufügen. Die rosa Farbe, die anzeigt, dass der Organismus das Nitrat nicht reduziert hat, kann sich erst nach 10 bis 15 Minuten entwickeln. Geben Sie nicht mehr Zinkstaub hinzu! Warten Sie, bis sich die Farbe entwickelt hat. Wenn sich nach 30 Minuten keine Farbe entwickelt hat, ist der Test als positiv zu werten.
Einschränkungen des Tests
Wenn der Test ordnungsgemäß durchgeführt wird und die Qualitätskontrollstämme angemessene Ergebnisse liefern, sollte es keine Einschränkungen für diesen Test geben. Es ist darauf zu achten, dass alle Testkomponenten ordnungsgemäß durchgeführt werden.
Eine Identifizierung der Gattung oder Art kann nicht allein auf der Grundlage des Nitratreduktionstests erfolgen.
Ergebnisse, Auswertung und Berichterstattung
Isolate können als Nitrat-positiv gemeldet werden, wenn im angeimpften Medium nach Zugabe der Reagenzien A und B Nitrit (rosa Farbe) nachgewiesen wird oder wenn im Medium nach Zugabe von Zinkstaub keine Farbe nachgewiesen wird.
Isolate können als Nitrat-negativ angegeben werden, wenn nach Zugabe der Reagenzien A und B kein Nitrit nachgewiesen wird (keine Farbveränderung) oder wenn sich nach Zugabe von Zinkstaub zum angeimpften Medium eine rosa Farbe entwickelt.
Literaturverzeichnis
Knapp JS, Clark VL. Anaerobes Wachstum von Neisseria gonorrhoeae gekoppelt an Nitritreduktion. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Ein Leitfaden zur Identifizierung der Gattungen von Bakterien. The Williams & Wilkins Co., Baltimore, MD.