Mechanische Komplikationen des akuten Myokardinfarkts (AMI) sind Ventrikelseptumdefekt (VSD), Papillarmuskelruptur oder -dysfunktion, Ruptur der freien Herzwand, ventrikuläres Aneurysma, dynamische Obstruktion des linksventrikulären (LV) Ausflusstrakts (OT) und rechtsventrikuläres (RV) Versagen. Alle diese Erkrankungen können potenziell zu einem LV-Versagen mit kardiogenem Schock führen.
Ein gründliches Verständnis der mechanischen Komplikationen des AMI und ihrer Risikofaktoren kann den Ärzten helfen, eine frühzeitige Diagnose zu stellen. Eine schnelle Diagnose mit angemessener medizinischer Therapie und rechtzeitiger chirurgischer Intervention ist die Voraussetzung für ein günstiges Patientenergebnis. Wichtige Faktoren für die Sterblichkeit im Krankenhaus aufgrund mechanischer Komplikationen des Herzinfarkts sind fortgeschrittenes Alter, kardiogener Schock und kardiorespiratorisches Versagen.
Die Ruptur der freien Kammerwand
Die VFWR ist die schwerwiegendste Komplikation des AMI. Die VFWR ist in der Regel mit großen transmuralen Infarkten und einer vorangegangenen Infarktausweitung verbunden. Sie ist die zweithäufigste Todesursache nach dem Versagen des linken Herzens und macht 15-30 % der Todesfälle im Zusammenhang mit einem AMI aus. Die VFWR ist unbestreitbar die katastrophalste der mechanischen Komplikationen und führt zu einem akuten Hämoperikard und zum Tod durch Herztamponade.
Die Gesamtinzidenz der VFWR liegt zwischen 0,8-6,2 %. Die Inzidenz dieser Komplikation ist im Laufe der Jahre durch eine bessere 24-Stunden-Kontrolle des systolischen Blutdrucks, den verstärkten Einsatz von Reperfusionstherapien, Betablockern und ACE-Hemmern und den geringeren Einsatz von Heparin zurückgegangen.
Daten aus dem Nationalen Register für Myokardinfarkte (NRMI) zeigten eine höhere Inzidenz der Krankenhausmortalität bei Patienten, die eine Thrombolyse erhielten (12,1 %), als bei Patienten, die keine Thrombolyse erhielten (6,1 %). In der Phase-II-Studie zur Thrombolyse bei Myokardinfarkt (TIMI II) starben 16 % der Patienten innerhalb von 18 Stunden nach der Therapie an einer Herzruptur. Bei Patienten, die sich einer perkutanen transluminalen Koronarangioplastie (PTCA) unterzogen, war die Inzidenz einer Ruptur der freien Wand geringer als bei Patienten, die eine thrombolytische Therapie erhielten.
Zu den Risikofaktoren für eine VFWR gehören ein fortgeschrittenes Alter von über 70 Jahren, weibliches Geschlecht, keine früheren Infarkte, Q-Wellen im EKG, Bluthochdruck in der Anfangsphase des STEMI, die Einnahme von Kortikosteroiden oder NSAID und eine fibrinolytische Therapie mehr als 14 Stunden nach Beginn des STEMI. Bei Patienten mit Angina pectoris in der Anamnese, früherem AMI, koronarer Mehrgefäßerkrankung und chronischer Herzinsuffizienz ist die Wahrscheinlichkeit einer VFWR des LV geringer als bei anderen, da sie Kollateralen und eine ischämische Präkonditionierung entwickeln.
Klinische Darstellung der VFWR
VFWRs sind dramatisch; sie treten akut oder gelegentlich subakut als Pseudoaneurysmen auf und betreffen meist die vordere oder seitliche Wand des LV. Die meisten VFWRs treten innerhalb der ersten Woche nach einem AMI auf.
Becker et al. klassifizierten die folgenden 3 Arten von VFWRs:
-
Typ I – ein abrupter schlitzförmiger Riss, der häufig mit Vorderwandinfarkten einhergeht und früh (innerhalb von 24 h) auftritt
-
Typ II – eine Erosion des infarzierten Myokards an der Grenze zwischen infarziertem und lebensfähigem Myokard
-
Typ III – eine frühe Aneurysmenbildung, die mit älteren und stark erweiterten Infarkten korreliert
Typ III tritt in der Regel später auf als Rupturen vom Typ I oder Typ II. Die thrombolytische Therapie beschleunigt das Auftreten einer Herzruptur bei Becker Typ I und Typ II VFWR. Bei stark ausgedehnten Infarkten (Typ III) verringert die thrombolytische Therapie die Inzidenz der Herzruptur.
Ein Pseudoaneurysma bildet sich, wenn angrenzendes Perikard und Hämatom eine Myokardruptur oder -perforation abdichten. Die Wand eines Pseudoaneurysmas wird meist als aneurysmatische Ausstülpung dargestellt, die über einen schmalen Hals mit der LV-Höhle in Verbindung steht. Diese Wand besteht aus Perikard und organisierten Thromben und/oder Hämatomen. Sie enthält keine Myokardelemente, während ein echtes Aneurysma alle Elemente der ursprünglichen Myokardwand und eine relativ breite Basis aufweist. Das Pseudoaneurysma kann unterschiedlich groß sein und birgt ein hohes Rupturrisiko.
Die klinischen Symptome der VFWR variieren je nach Akuität, Lage und Größe der Ruptur. Patienten mit akuter VFWR zeigen starke Brustschmerzen, plötzliche elektromechanische Dissoziation oder Asystolie, hämodynamischen Kollaps und möglicherweise Tod. Bei etwa einem Drittel der Patienten ist der Verlauf subakut, und sie zeigen Symptome wie Synkope, Hypotonie, Schock, Arrhythmie sowie anhaltende und wiederkehrende Brustschmerzen.
Diagnose von VFWR
Die frühzeitige Diagnose von VFWRs und die Intervention sind entscheidend für das Überleben der Patienten. Ein hoher Verdachtsindex ist erforderlich, wenn Patienten mit AMI mit starken Brustschmerzen, Schock oder Herzrhythmusstörungen und einer abrupten Entwicklung einer elektromechanischen Dissoziation erscheinen. EKG-Zeichen für eine drohende VFWR sind nur begrenzt spezifisch, umfassen jedoch Sinustachykardie, intraventrikuläre Überleitungsstörungen und anhaltende oder wiederkehrende ST-Strecken-Hebungen.
Die Echokardiographie ist das diagnostische Mittel der Wahl. Der wichtigste diagnostische Befund ist ein mittelgroßer bis großer Perikarderguss mit klinischen und echokardiographischen Anzeichen einer drohenden Perikardtamponade. Bei Patienten mit Herztamponade und elektromechanischer Dissoziation erhöht ein mittelschwerer bis schwerer Perikarderguss das Mortalitätsrisiko. Patienten ohne anfängliche Herztamponade haben zwar ein geringeres Sterberisiko, sollten aber dennoch überwacht werden, da es trotzdem zu einer späten Ruptur kommen kann. Das Fehlen eines Perikardergusses in der Echokardiographie hat einen hohen negativen prädiktiven Wert. Wenn bei Patienten, die mechanisch beatmet werden, nur begrenzt transthorakale Echokardiogramme möglich sind, kann die transösophageale Echokardiographie bei der Bestätigung der VFWR hilfreich sein.
Die MRT bietet eine bessere Bildqualität und ermöglicht die Identifizierung des Ortes und der Anatomie eines ventrikulären Pseudoaneurysmas (d. h. eines rupturierten LV, das durch den Herzbeutel mit eingeschlossenem Gerinnsel zurückgehalten wird). Aufgrund des hohen Zeitaufwands und der fehlenden Transportfähigkeit der Bildgebungsgeräte ist die MRT in der Akutsituation jedoch nur von begrenztem Nutzen.
Behandlung der VFWR
Die wichtigste Präventionsstrategie ist eine frühzeitige Reperfusionstherapie, wobei die perkutane Koronarintervention (PCI) die bevorzugte Methode ist. Eine fibrinolytische Therapie ist mit einem insgesamt verringerten Risiko einer VFWR verbunden; allerdings kann ihre Anwendung mehr als 14 Stunden nach Beginn des STEMI das Risiko einer frühen Ruptur erhöhen.
Die Standardbehandlung für VFWR ist eine chirurgische Notfallreparatur, nachdem eine hämodynamische Stabilität erreicht wurde. Die Patienten benötigen möglicherweise zunächst intravenöse Flüssigkeiten, Inotropika und eine Notfall-Perikardiozentese.
Pifarré und Kollegen empfahlen den Einsatz einer intra-aortalen Ballonpumpe, um die systolische Nachlast zu verringern und die diastolische Myokardperfusion zu verbessern.
Es wurden verschiedene chirurgische Techniken angewandt, darunter die Infarktentfernung, die Verklebung mit biologischen Klebepflastern aus Polyethylenterephthalat-Polyesterfasern (Dacron; DuPont, Wilmington, DE) oder Polytetrafluorethylen-Fluorpolymer-Harz (Teflon; DuPont) sowie die Verwendung von Pflasternähten ohne Infarktentfernung.
Die Sterblichkeitsrate ist signifikant hoch und hängt weitgehend vom präoperativen hämodynamischen Status des Patienten ab. Eine frühzeitige Diagnose, die rasche Einleitung der oben beschriebenen Maßnahmen zur Erreichung einer hämodynamischen Stabilität und eine rasche chirurgische Reparatur können die Überlebensrate verbessern. Eine Folgeuntersuchung der randomisierten Acorn-Studie zeigte eine langfristige Verbesserung der linksventrikulären Struktur und Funktion nach einer Mitralklappenoperation über einen Zeitraum von bis zu 5 Jahren. Diese Daten liefern Belege für die Unterstützung der Mitralklappenreparatur in Kombination mit dem Acorn CorCap-Gerät bei Patienten mit nicht-ischämischer Herzinsuffizienz mit schwerer linksventrikulärer Dysfunktion, die medikamentös optimiert wurden, aber weiterhin Symptome mit signifikanter Mitralregurgitation aufweisen.
Ventrikelseptumruptur
VSR ist eine seltene, aber lebensbedrohliche Komplikation des AMI. Trotz optimaler medizinischer und chirurgischer Behandlung haben Patienten mit VSR eine hohe Sterblichkeitsrate im Krankenhaus. In der Ära vor der Einführung von Thrombolytika traten VSR bei 1-3 % der Patienten mit MIs auf. Mit der thrombolytischen Therapie ging die Inzidenz auf 0,2-0,34 % zurück, da die Reperfusion und die Rettung des Myokards verbessert wurden. Die bimodale Verteilung der VSR ist durch eine hohe Inzidenz in den ersten 24 Stunden gekennzeichnet, mit einer weiteren Spitze an den Tagen 3-5 und selten mehr als 2 Wochen nach AMI.
Bei Patienten, die Thrombolytika erhielten, betrug die mediane Zeit vom Auftreten der AMI-Symptome bis zur Septumruptur 1 Tag in der Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I)-Studie und 16 Stunden in der Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK)-Studie.
Zu den Risikofaktoren für eine Septumruptur gehören fortgeschrittenes Alter (>65 Jahre), weibliches Geschlecht, Ein-Gefäß-Erkrankung, ausgedehnte MI und schlechte septale Kollateralkreisläufe. Vor der Einführung von Thrombolytika waren Bluthochdruck und das Fehlen einer Angina pectoris in der Vorgeschichte Risikofaktoren für eine VSR. Die Größe des Infarkts und die Beteiligung des RV sind weitere bekannte Risikofaktoren für eine Septumruptur.
Bei Patienten mit AMI ohne Reperfusion entwickelt sich innerhalb von 3-5 Tagen nach dem Infarkt eine Gerinnungsnekrose. Neutrophile wandern in die nekrotische Zone ein und unterliegen der Apoptose, setzen lytische Enzyme frei und beschleunigen den Zerfall des nekrotischen Myokards. Einige Patienten haben Infarkte mit großen intramuralen Hämatomen, die in das Gewebe eindringen und zu einer frühen Septumruptur führen. Die Größe der Septumruptur reicht von einigen Millimetern bis zu mehreren Zentimetern.
Die VSR wird je nach Länge, Verlauf und Lokalisation als einfach oder komplex eingestuft. Bei einer einfachen Septumruptur befindet sich die Perforation auf beiden Seiten der Scheidewand auf gleicher Höhe, und es besteht eine direkte Durchgängigkeit durch die Scheidewand. Eine komplexe Septumruptur ist durch ausgedehnte Blutungen mit unregelmäßigen, serpiginösen Bahnen im nekrotischen Gewebe gekennzeichnet.
Septumrupturen treten am häufigsten bei Patienten mit großen anterioren MIs auf, die auf einen Verschluss der Arteria LAD zurückzuführen sind und ausgedehnte Septuminfarkte verursachen. Diese Infarkte sind mit ST-Strecken-Hebungen und Q-Wellen in den inferioren Ableitungen (II, III, aVF) verbunden, und diese EKG-Veränderungen sind daher häufiger bei Septumrupturen zu sehen. Diese Rupturen sind im Allgemeinen apikal und einfach.
Septalrupturen bei Patienten mit inferiorem MI treten relativ selten auf. Diese Rupturen betreffen das basale inferoposteriore Septum und sind oft komplex.
Klinische Darstellung der VSR
Symptome der VSR als Komplikation eines AMI sind Brustschmerzen, Kurzatmigkeit, Hypotonie, biventrikuläres Versagen und Schock innerhalb von Stunden bis Tagen. Die Patienten präsentieren sich häufig mit einem neuen, lauten und harten holosystolischen Geräusch. Dieses Geräusch ist am linken unteren Sternumrand am lautesten und geht mit einem palpablen parasternalen systolischen Thrill einher. RV- und LV-S3-Galopps sind häufig.
Bei Patienten mit kardiogenem Schock, der mit einer Septumruptur einhergeht, können das Herzgeräusch und der Thrill schwer zu identifizieren sein. Im Gegensatz dazu haben Patienten mit akuter MR oft ein leises systolisches Geräusch am Apex ohne Thrill.
Diagnose der VSR
Die Echokardiographie mit Farbfluss-Doppler-Bildgebung ist das diagnostische Mittel der Wahl zur Erkennung einer VSR. (Ihre Sensitivität und Spezifität liegen Berichten zufolge bei bis zu 100 %. Darüber hinaus kann sie für Folgendes eingesetzt werden:
-
Bestimmung von Ort und Größe der Septumruptur
-
Bewertung der LV- und RV Funktion
-
Schätzung des systolischen RV-Drucks
-
Bestimmung des Links-Rechts-ShuntsRechts-Links-Shunt
Zur Bestätigung der Diagnose ist in der Regel eine Herzkatheteruntersuchung erforderlich, den Grad des Links-Rechts-Shunts zu quantifizieren, die VSR von anderen Erkrankungen (z. B. Mitralinsuffizienz) zu unterscheiden und die Koronararterien darzustellen.
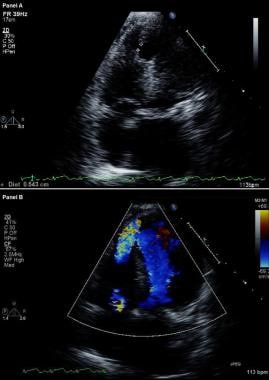 Komplikationen des Myokardinfarkts. Modifiziertes zweidimensionales Echokardiogramm (oben) und Farbfluss-Doppler-Bild (unten). Apikale Vier-Kammer-Ansichten zeigen einen Durchbruch in der Interventrikelseptum und eine freie Kommunikation zwischen den Ventrikeln durch einen großen apikalen Septum-Ventrikelseptumdefekt bei einem Patienten, der kürzlich einen anterioren Myokardinfarkt hatte.
Komplikationen des Myokardinfarkts. Modifiziertes zweidimensionales Echokardiogramm (oben) und Farbfluss-Doppler-Bild (unten). Apikale Vier-Kammer-Ansichten zeigen einen Durchbruch in der Interventrikelseptum und eine freie Kommunikation zwischen den Ventrikeln durch einen großen apikalen Septum-Ventrikelseptumdefekt bei einem Patienten, der kürzlich einen anterioren Myokardinfarkt hatte. Bei Patienten mit VSR zeigt die Rechtsherzkatheteruntersuchung einen Anstieg der Sauerstoffsättigung vom rechten Vorhof zum RV; im Gegensatz dazu tritt bei Patienten mit MR kein Anstieg der Sauerstoffsättigung auf. Das Vorhandensein großer V-Wellen im pulmonalen Kapillarkeil-Tracing unterstützt die Diagnose einer schweren akuten MR.
Die linke Ventrikulographie kann auch zur Identifizierung des Ortes der Ventrikelruptur verwendet werden (siehe Herzkatheteruntersuchung). Diese Untersuchung ist jedoch in der Regel überflüssig, nachdem eine qualitativ hochwertige echokardiographische und Doppler-Untersuchung durchgeführt wurde.
Behandlung der VSR
Der Schlüssel zur Behandlung der VSR ist eine rasche Diagnose und ein aggressiver Ansatz zur hämodynamischen Stabilisierung, Angiographie und Operation. Der optimale Ansatz umfasst die hämodynamische Stabilisierung mit der Verabreichung von Sauerstoff und mechanischer Unterstützung mit einer intra-aortalen Ballonpumpe sowie die Verabreichung von Vasodilatatoren (zur Senkung der Nachlast und damit des LV-Drucks und des Links-Rechts-Shunts), Diuretika und Inotropika.
Eine Herzkatheteruntersuchung ist erforderlich, um die Koronaranatomie zu bestimmen; danach erfolgt eine dringende chirurgische Reparatur.
In einer Studie mit 52 aufeinanderfolgenden Patienten mit Ventrikelseptumruptur nach Infarkt, die chirurgisch repariert wurde, stellten die Forscher fest, dass die 30-Tage-Sterblichkeitsrate 36 % betrug (n = 19). Die meisten Patienten, die weniger als 30 Tage überlebten, hatten einen präoperativen Schockstatus. Die Forscher kommen zu dem Schluss, dass bei Patienten mit Ventrikelseptumruptur eine präoperative Verbesserung des Schockzustands und eine aggressive koronare Revaskularisierung erforderlich sind.
Die medikamentöse Therapie ist nur zur vorübergehenden Stabilisierung vor der Operation gedacht, da sich der Zustand der meisten Patienten rasch verschlechtert und sie ohne chirurgischen Eingriff sterben. In der GUSTO-I-Studie war die 30-Tage-Sterblichkeitsrate bei Patienten mit VSR, die sich einer chirurgischen Reparatur unterzogen, niedriger als bei Patienten, die medikamentös behandelt wurden (47 % gegenüber 94 %), ebenso wie die 1-Jahres-Sterblichkeitsrate (53 % gegenüber 97 %). Lemery et al. berichteten über eine 30-Tage-Überlebensrate von 24 % bei medikamentös behandelten Patienten im Vergleich zu 47 % bei chirurgisch behandelten Patienten.
Die Leitlinien des American College of Cardiology/American Heart Association (ACC/AHA) für die Behandlung von Patienten mit Septumruptur als Komplikation eines akuten Herzinfarkts betonen die Dringlichkeit eines chirurgischen Eingriffs, unabhängig von ihrem klinischen Status. Die chirurgische Behandlung der Septumruptur umfasst die folgenden Elemente:
-
Sofortige Einrichtung eines hypothermen kardiopulmonalen Bypasses
-
Ein Zugang zum Septumriss durch das Infarktgebiet und die Entfernung aller nekrotischen, brüchigen Ränder des Septums und der Ventrikelwände, um Nachblutungen, einen verbleibenden Septumdefekt oder beides zu vermeiden, oder beides
-
Rekonstruktion des Septums und der Ventrikelwände unter Verwendung von Prothesenmaterial und Erhaltung der geometrischen Konfiguration der Ventrikel und der Herzfunktion
Der perkutane Verschluss der Septumruptur ist ein relativ neues Verfahren, das bei ausgewählten Patienten als Alternative zur chirurgischen Reparatur oder zur akuten Stabilisierung kritisch kranker Patienten eingesetzt wird. Allerdings ist der perkutane Verschluss derzeit in vielen Einrichtungen nicht verfügbar, und es liegen keine Daten zu den Langzeitergebnissen vor.
In mehreren Studien konnte kein Zusammenhang zwischen der perioperativen Mortalität und der gleichzeitigen koronaren Revaskularisierung (koronare Bypass-Transplantation) nachgewiesen werden. Patienten mit kardiogenem Schock aufgrund einer Septumruptur haben das schlechteste Ergebnis. In der SHOCK-Studie war die Sterblichkeitsrate im Krankenhaus bei Patienten mit kardiogenem Schock aufgrund einer Septumruptur höher (87,3 %) als bei Patienten mit kardiogenem Schock aus allen anderen Ursachen (59,2 % mit reinem LV-Versagen und 55,1 % mit akuter MR).
Bei Patienten, die eine chirurgische Reparatur überleben, liegt die Rate der rezidivierenden oder residualen Septumdefekte bei etwa 28 %, und die damit verbundene Sterblichkeitsrate ist hoch.
Eine erneute chirurgische Intervention ist bei Patienten mit klinischer Herzinsuffizienz oder einer pulmonal-systemischen Fraktion von mehr als 2 angezeigt.
Akute Mitralinsuffizienz
MR ist eine häufige Komplikation des AMI, die aus einem lokalen und globalen LV-Remodeling resultiert und ein unabhängiger Prädiktor für Herzversagen und Tod ist. Die MR tritt in der Regel 7-10 Tage nach einem AMI auf, wobei dieser Zeitpunkt je nach Mechanismus der MR variieren kann. Eine Papillarmuskelruptur, die zu einer MR führt, tritt innerhalb von 1-14 Tagen auf (Median 1 Tag).
Eine leichte bis mittelschwere MR ist oft klinisch stumm und wird bei der Doppler-Echokardiographie in der Frühphase des AMI entdeckt. In solchen Fällen führt MR nur selten zu einer Beeinträchtigung der Hämodynamik.
Speckle Tracking und 3-dimensionale Echokardiographie haben sich als wichtige bildgebende Verfahren zur Beurteilung des reversen LV-Remodellings nach einer degenerativen Mitralklappenregurgitationsoperation erwiesen. Subtile regionale präoperative Veränderungen der diastolischen Funktion der Septal- und Seitenwand konnten präoperativ identifiziert werden, was zur Optimierung des Überweisungszeitpunkts und zur Erkennung potenzieller Schuldiger als Indikatoren für ein Wiederauftreten der Erkrankung nach einer Mitralreparatur beitrug.
Eine schwere akute MR, die durch die Ruptur der Papillarmuskeln oder der Chordae tendineae entsteht, führt zu einer abrupten hämodynamischen Verschlechterung mit kardiogenem Schock. Eine rasche Diagnose, hämodynamische Stabilisierung und sofortige chirurgische Intervention sind erforderlich, da eine akute schwere MR mit einer hohen Sterblichkeitsrate verbunden ist.
Die gemeldete Inzidenz der MR kann aufgrund verschiedener Faktoren variieren, darunter die verwendeten Diagnosemethoden, das Vorhandensein oder Nichtvorhandensein einer Herzinsuffizienz, der gemeldete Grad der MR, die Art der durchgeführten Therapie und die Zeit vom Infarktbeginn bis zur Untersuchung.
In der GUSTO-I-Studie betrug die Inzidenz der MR bei Patienten, die eine thrombolytische Therapie erhielten, 1,73 %. In der SHOCK-Studie, die MI-Patienten mit kardiogenem Schock einschloss, wurde eine Inzidenz von 39,1 % mittelschwerer bis schwerer MR festgestellt. Kinn et al. berichteten, dass die Reperfusion mit Angioplastie im Vergleich zur Thrombolysetherapie zu einem Rückgang der akuten MR um 82 % führte (0,31 % gegenüber 1,73 %).
Risikofaktoren für eine MR sind fortgeschrittenes Alter, weibliches Geschlecht, ein großer Infarkt, ein früherer AMI, eine wiederkehrende Ischämie, eine koronare Mehrgefäßerkrankung und Herzinsuffizienz.
Es gibt verschiedene Mechanismen, die eine MR nach einem AMI verursachen können. Die Ruptur des Papillarmuskels ist der am häufigsten gemeldete Mechanismus.
Eine solche Ruptur tritt bei 1 % der Patienten mit AMI auf und betrifft häufig den posteromedialen Papillarmuskel und nicht den anterolateralen Papillarmuskel, da der erstere über eine einzige Blutversorgung verfügt, während der letztere doppelt versorgt wird. Eine Ruptur des Papillarmuskels kann zu einem Flattern oder Prolaps der Herzklappen führen, was eine schwere MR zur Folge hat. Eine Dysfunktion des Papillarmuskels aufgrund von Vernarbung oder rezidivierender Ischämie kann ebenfalls zu einer MR in der subakuten und chronischen Phase nach einem MI führen; dieser Zustand kann sich spontan zurückbilden.
Große posteriore Infarkte führen zu einer akuten MR aufgrund einer asymmetrischen ringförmigen Dilatation und einer veränderten Funktion und Geometrie des Papillarmuskels.
Klinische Darstellung der MR
Patienten mit einer funktionellen leichten oder mittelschweren MR sind häufig asymptomatisch. Der Schweregrad der Symptome variiert in Abhängigkeit von der Herzkammerfunktion. Zu den klinischen Merkmalen einer akuten schweren MR gehören Kurzatmigkeit, Müdigkeit, ein neues apikales holosystolisches Geräusch, ein blitzartiges Lungenödem und Schock.
Das neue systolische Geräusch ist möglicherweise nur früh- bis mittelsystolisch, nicht holosystolisch. Es kann leise sein oder sogar fehlen, da der Druck im linken Vorhof abrupt ansteigt, wodurch der Druckgradient zwischen dem linken Vorhof und dem LV im Vergleich zu einer chronischen MR geringer wird. Das Geräusch ist am besten am Apex und nicht am unteren linken Sternumrand zu hören, und es ist selten mit einem Kribbeln verbunden. S3- und S4-Galopps sind zu erwarten.
Diagnose der MR
Der Arzt kann sich nicht auf ein neues holosystolisches Geräusch verlassen, um eine MR zu diagnostizieren oder ihren Schweregrad zu beurteilen, da der hämodynamische Status variabel ist. Bei einem Patienten mit AMI, der sich mit einem neuen apikalen systolischen Geräusch, einem akuten Lungenödem und einem kardiogenen Schock vorstellt, ist ein hoher klinischer Verdacht auf eine schwere MR der Schlüssel zur Diagnose.
Die Röntgenuntersuchung der Brust kann in der akuten Situation Hinweise auf ein Lungenödem zeigen, ohne dass eine klinisch signifikante Herzvergrößerung vorliegt.
Die Echokardiographie mit Farbfluss-Doppler-Bildgebung ist das Standarddiagnoseinstrument zum Nachweis einer MR. Die transthorakale Echokardiographie ist das bevorzugte anfängliche Screening-Instrument, aber die transösophageale Echokardiographie ist von unschätzbarem Wert bei der Bestimmung des Schweregrads und des genauen Mechanismus der akuten MR, insbesondere wenn der Verdacht auf eine Papillarmuskelruptur besteht. Bei allen Patienten sollte eine Herzkatheteruntersuchung durchgeführt werden, um das Ausmaß und den Schweregrad einer koronaren Herzerkrankung festzustellen.
Behandlung der MR
Die Bestimmung der hämodynamischen Stabilität, die Klärung des genauen Mechanismus der akuten MR und eine rasche Therapie sind für ein günstiges Ergebnis erforderlich. Die medikamentöse Behandlung umfasst die Senkung der Nachlast mit Hilfe von Diuretika, Natriumnitroprussid und Nitraten bei Patienten, die nicht hypoton sind.
Bei Patienten, deren Hämodynamik beeinträchtigt ist, sollte rasch eine intraaortale Ballon-Gegenpulsation durchgeführt werden. Dieser Eingriff führt in der Regel zu einer deutlichen Verringerung der Nachlast und des Regurgitatvolumens und damit zu einer Verbesserung des Herzzeitvolumens in Vorbereitung auf eine chirurgische Reparatur. Ohne chirurgische Reparatur führt die alleinige medikamentöse Therapie bei Patienten mit Papillarmuskelruptur zu einer unzureichenden hämodynamischen Verbesserung und einer schlechten Kurzzeitprognose.
Ein chirurgischer Notfalleingriff ist die Behandlung der Wahl bei Papillarmuskelruptur. Der chirurgische Eingriff kann eine Mitralklappenreparatur oder einen Mitralklappenersatz beinhalten. Liegt keine Papillarmuskelnekrose vor, verbessert die Mitralklappenreparatur die Überlebensrate stärker als der Mitralklappenersatz. Dieser Unterschied ist darauf zurückzuführen, dass der subvalvuläre Apparat in der Regel erhalten bleibt. Durch die Mitralklappenreparatur werden auch Komplikationen im Zusammenhang mit einer Fehlfunktion der Prothese vermieden.
Bei Patienten mit ausgedehnten Nekrosen des Papillarmuskels und/oder der freien Kammerwand ist der Mitralklappenersatz die bevorzugte Behandlungsmethode. Eine zum Zeitpunkt der Operation durchgeführte koronare Bypass-Operation (CABG) hat in einer Studie gezeigt, dass sie das kurz- und langfristige Überleben verbessert.
Die einzige Situation, in der eine Notoperation sicher vermieden werden kann, ist der Fall einer intermittierenden MR aufgrund einer rezidivierenden Ischämie. Bei diesen Patienten kann eine erfolgreiche Myokardrevaskularisierung wirksam sein. Dieses Verfahren wird entweder durch Angioplastie oder Koronararterien-Bypass-Transplantation durchgeführt.
Dynamische LVOTO
Ursprünglich dachte man, dass sie nur bei hypertropher Kardiomyopathie auftritt, aber verschiedene Forscher haben über das Vorhandensein einer dynamischen LVOTO als Komplikation eines akuten anterioren MI berichtet. Das Vorhandensein einer dynamischen LVOTO ist auch als eine der Ursachen für eine Myokardruptur postuliert worden.
Dynamische LVOTO wird mechanisch durch eine kompensatorische Hyperkinese der basalen und mittleren Segmente des LV bei Patienten mit distalen LAD-Infarkten verursacht. Prädiktoren für eine verstärkte regionale Wandbewegung in den Nicht-Infarktzonen sind das Fehlen einer Mehrgefäßerkrankung, das weibliche Geschlecht und ein höherer Fluss in dem vom Infarkt betroffenen Gefäß. Die erhöhte kontraktile Kraft des basalen Myokards verursacht über den Venturi-Effekt eine Mitralregurgitation. Dies führt zu einer verstärkten OTO, die bei bereits vorhandener systemischer Hypoperfusion zu einer weiteren Verringerung der LV-Leistung führt.
Diese erhöhte LVOTO bei geschädigtem transmuralem Myokard bildet ein perfektes Umfeld, in dem ein erhöhter end-systolischer intraventrikulärer Druck entsteht, der eine erhöhte Wandbelastung der geschwächten, nekrotischen Infarktzone induziert. Diese häufig tödlich verlaufende Komplikation tritt am häufigsten bei Frauen, älteren Patienten (>70 Jahre) und Patienten ohne vorangegangenen Infarkt auf.
Klinische Darstellung der LVOTO
Betroffene Patienten können die üblichen Symptome eines erhöhten autonomen Symptomenkomplexes wie Atemnot, Diaphorese und kühle, klamme Extremitäten zusätzlich zu den typischen Anzeichen und Symptomen eines AMI aufweisen.
Diese Patienten können schnell in einen kardiogenen Schock mit schwerer Orthopnoe, Dyspnoe und Oligurie übergehen und einen veränderten mentalen Status aufgrund einer zerebralen Hypoperfusion aufweisen. Die Patienten können sich mit einem neuen systolischen Auswurfgeräusch, einem neuen holosystolischen Geräusch mit Ausstrahlung in die Achselhöhle infolge einer systolischen Vorwärtsbewegung (SAM) des Mitralflügels vorstellen. Ein S3-Galopp, pulmonale Rasselgeräusche, Hypotonie und Tachykardie können ebenfalls vorhanden sein; die letztgenannten körperlichen Anzeichen können in der akuten Situation völlig fehlen.
Die transthorakale oder transösophageale Echokardiographie (TTE/TEE) ist der diagnostische Test der Wahl und kann das hyperkinetische Segment, die LVOTO und das SAM des Mitralblatts genau charakterisieren.
Behandlung der LVOTO
Die Hyperkontraktilität des Myokards sollte durch eine vorsichtige Zugabe von Betablockern reduziert werden. Auch eine langsame Volumenreanimation durch Erhöhung der Nachlast (Phenylepherin) kann die Vorlast erhöhen und LVOTO und SAM verringern. Am besten wäre es, nachlaststeigernde Medikamente zu vermeiden. Vasodilatatoren, Inotropika und Ballonpumpen sollten ebenfalls vermieden werden, da sie die LVOTO erhöhen können.
Versagen des RV
Eine leichte RV-Dysfunktion wird häufig im Zusammenhang mit einem inferioren MI beobachtet; in den meisten Fällen ist die Auswirkung auf den LV jedoch minimal.
Eine signifikante RV-Hypokinese tritt auf, wenn ein proximaler Verschluss der rechten Korinararterie mit wenig Kollateralen aus dem linksseitigen Kreislauf besteht. Da das RV dünnwandig ist und einen geringeren Sauerstoffbedarf hat, wird angenommen, dass es während des gesamten Herzzyklus koronar durchblutet wird; daher ist ein ausgedehnter irreversibler Infarkt selten.
Typisches RV-Versagen kann sich mit Hypotonie (aufgrund der fehlenden LV-Vorlast) und Jugularvenendistention bei freiem Lungenfeld präsentieren. Obwohl diese Trias klassischerweise im Zusammenhang mit einem RV-Versagen beschrieben wird, ist sie in ihrer reinen Form in der klinischen Praxis selten anzutreffen. Die meisten Patienten weisen einen kardiogenen Schock mit niedrigem Output oder eine LV-Insuffizienz mit entsprechenden autonomen Symptomen auf.
Das Vorhandensein eines Jugularvenendrucks von über 8 cm H2O und des Kussmaul-Zeichens ist hochsensitiv und spezifisch für ein schweres RV-Versagen.
Gelegentlich verursacht ein Rechts-Links-Shunt über ein offenes Foramen ovale eine anhaltende Hypoxämie. Denken Sie an diese besondere Komplikation.
Elektrokardiographisch zeigen die Patienten eine inferiore ST-Hebung in Verbindung mit einer ST-Hebung in der V4R-Ableitung. Das Röntgenbild des Brustkorbs ist in der Regel unauffällig und zeigt keine Venenerweiterung des Oberlappens.
Diagnose der RV-Insuffizienz
Die zweidimensionale (2D) Echokardiographie und die Magnetresonanztomographie (MRT) sind sehr nützlich. Meistens hilft die Echokardiographie bei der Diagnosestellung.
Swan-Ganz-Katheterbefunde deuten in der Regel auf hohe RA-Drucke mit einem niedrigen PCWP hin.
Behandlung des RV-Versagens
Volumenreanimation, um den PCWP bei oder um 15 mmHg zu halten, könnte vorübergehend helfen, indem die RV-Vorlast vorübergehend erhöht wird. Die endgültige Behandlung besteht jedoch in der Wiederherstellung der koronaren Zirkulation. In seltenen Fällen von schwerem RV-Versagen sollte eine mechanische Kreislaufunterstützung mit RV-Assist-Geräten (AD) entweder vorübergehend oder als Überbrückungstherapie bei ausgedehnter biventrikulärer Beteiligung in Betracht gezogen werden.