Guanosintriphosphat (genauer gesagt Guanosin-5′-Triphosphat oder der Einfachheit halber auch häufig mit GTP abgekürzt) ist ein energiereiches Nukleotid (nicht zu verwechseln mit Nukleosid), das im Zytoplasma vorkommt oder zur Guaninbase polymerisiert.
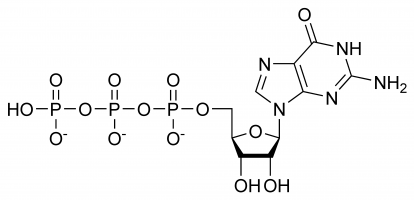
GTP hat selektive Funktionen bei der Bildung von RNA-Strängen, als Energieträgermolekül für die Proteinsynthese, als Coenzym, als Vorläufer von cGMP – einem sekundären Botenmolekül oder als Effektormolekül. Die beiden letztgenannten Funktionen werden in der Regel durch die Modulation von G-Proteinen nachgewiesen. Alle diese Funktionen ergeben sich aus seiner komplexen dreidimensionalen Struktur und der Vielzahl verschiedener chemischer Gruppen, aus denen es besteht. Der Einfachheit halber kann man sich das G-Protein daher als eine Ansammlung verschiedener funktioneller Gruppen vorstellen, die praktisch isoliert verschiedene Funktionen ausüben (auch wenn die Struktur zuweilen eine Rolle spielt, z. B. wenn es mit einem Enzym und einem anderen Substrat interagiert), z. B. ist nur das Triphosphat an der Freisetzung von Energie für die Polymerisation beteiligt, während nur die Guaninbase an der Desaminierung beteiligt ist. Es ist wichtig anzumerken, dass die eingangs aufgeführte Liste nicht die chemischen Interaktionen aufzählt, sondern lediglich die verschiedenen Möglichkeiten aufzeigt.
Im GTP ist der Ribosezucker zentral für die dreidimensionale Anordnung der kovalent gebundenen Guanin- und Triphosphatmoleküle. Dieses Monosaccharid stellt Hydroxylgruppen für Kondensationsreaktionen und nukleophile Angriffe zur Verfügung, die für die Zerstörung von RNA-Molekülen und damit für die Steuerung der Genexpression wichtig sind. Das Guaninmolekül und das Triphosphat bilden kovalente Bindungen an den C’1- bzw. C’5-Atomen, können aber auch andere Hydroxylgruppen verwenden, solange die resultierende Struktur nicht zu Konflikten führt. Aus der Sicht des Purins ist es durch eine Kondensationsreaktion an seinem 9’N gebunden, das zuvor kovalent an ein Wasserstoffatom gebunden war. Da Guanin eine Purinbase ist, wird es zusammen mit Adenintriphosphat (ATP) zu den Purintriphosphaten gezählt und entsteht durch Modifikation von Inosinmonophosphat.
Inhalt
- 1 Missverständnis: GTP, ein Grundbaustein
- 2 Einer von vielen RNA-Basen-Vorläufern
- 3 GTP; ein Cousin des universellen ATP
- 4 Eine Ressource für die Signalübertragung
- 5 Referenzen
Missverständnis: GTP, ein Grundbaustein
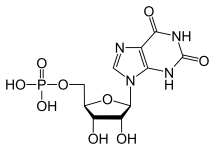
Die Leber ist das wichtigste Organ zur Synthese von Purin- und Pyramidin-Nukleotiden. Purinnukleotide (GTP und ATP) werden synthetisiert, indem zunächst Inosinmonophosphat aus ATP, Glutamin, Glycin, CO2, Aspartat und Formiat gebildet wird. IMP
kann dann modifiziert werden, um eines der beiden Moleküle zu erhalten.
Im Falle der GTP-Bildung wird IMP zunächst durch IMP-Dehydrogenase in XMP umgewandelt. Die daraus resultierende chemische und strukturelle Veränderung ermöglicht die Wirkung der GTP-Synthase, die XMP rasch in GMP umwandelt. Da GMP jedoch kein energiereiches Molekül ist, da es kein Triphosphat besitzt, wird es anschließend von Nukleosidphosphatkinasen phosphoryliert, um zunächst ein Diphosphat und schließlich ein Triphosphat zu bilden.
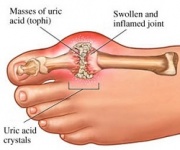
GTP wird normalerweise zu unlöslicher Harnsäure abgebaut, die dann im Urin als Natriumuratkristalle auftreten kann. Dieser Prozess gilt als abnormal, wenn er in den Synovialgelenken stattfindet und Harnsäure entsteht, die dann in schädliches Mononatriumurat oder Calciumpyrophosphat-Dihydrat umgewandelt wird. Das Vorhandensein solcher Chemikalien ermöglicht die Entwicklung von Entzündungen und Arthritis, und die kombinierten Symptome führen zur Einstufung der Krankheit als Gicht. Ein weiteres Beispiel für die Bedeutung eines angemessenen Purinnukleotid-Katabolismus ist die schwere kombinierte Immunschwächekrankheit, die zur Zerstörung lebenswichtiger B- und T-Lymphozyten führt
Einer von vielen RNA-Basen-Vorläufern
Es gibt mehrere Unterschiede zwischen RNA und DNA, aber der Hauptunterschied liegt in der Struktur der Nukleobasen, die jedes Polymer aufbauen. RNA-Nukleobasen enthalten eine 2’OH-Gruppe an ihrem Ribosezucker, wodurch sie chemisch wesentlich reaktiver, katalytischer und instabiler sind. Es ist wichtig zu wissen, dass Guanosintriphosphat nur für die Bildung der Guaninbase in der RNA zuständig ist. Das Analogon des GTP für die Bildung einer Guaninbase in der DNA ist das Desoxyguanosintriphosphat. Dieses Triphosphat enthält einen Desoxyribosezucker ohne eine
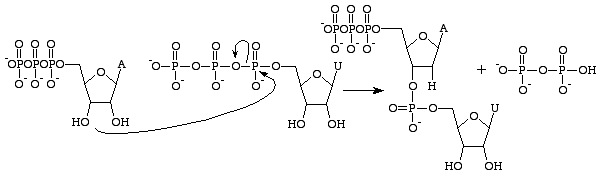
2’OH-Gruppe, was es wesentlich stabiler macht – es verhindert nukleophile Angriffe, die die Phosphodiesterbindungen zwischen den Nukleobasen spalten würden. Dies ist ideal, da die RNA nach der Übersetzung in ein Protein abgebaut werden sollte, während die DNA für die Weitergabe der genetischen Information an die Tochterzelle intakt bleiben muss.
Guanosintriphosphat führt zur Bildung einer Guaninbase durch die Spaltung einer Anhydridbindung und die Freisetzung von Alpha- und Gammaphosphaten als freie Phosphate. GMP bildet dann eine Phosphodiesterbindung mit der nahe gelegenen 3’OH-Gruppe enthaltenden Base und liefert eine 3’OH-Gruppe für die nächste RNA-Base. Diese Reaktion findet nur statt, wenn die gegenüberliegende Base von GMP Cytosin ist, mit dem es Wasserstoffbrückenbindungen bilden kann, und ihre Geschwindigkeit wird durch die RNA-Polymerase erhöht. Die RNA-Polymerase richtet die Triphosphate nicht aus. Sie katalysiert lediglich die Reaktion, die unabhängig davon abläuft. Nach der Katalyse ist das Molekül Teil einer Polynukleotidkette und wird nicht mehr als GTP, sondern als die Base Guanin bezeichnet.
GTP; ein Cousin des universellen ATP
Der zugrundeliegende Mechanismus der Energiegewinnung aus der Spaltung der Anhydridbindung ist bei allen Triphosphaten gleich. Der hohe Energiestatus von Triphosphaten wird durch drei verschiedene Mechanismen erreicht. Der erste ist auf die Abstoßungskräfte
auf jede der Phosphatgruppen zurückzuführen. Dies trägt zu einer hohen Instabilität der gebundenen Triphosphate und einem hohen „Wunsch“ bei, einen niedrigeren Energiestatus zu erreichen. Der zweite Grund liegt in der Resonanzstabilisierung. Wenn GTP
in GDP umgewandelt wird, erhöht sich die Anzahl der möglichen Positionen für die vorhandenen Elektronenpaare, was zu einer größeren Stabilität führt. Dieses Argument wird auch bei der Umwandlung von GDP in GMP bestätigt. Das dritte Argument ist auf den ungünstigen entropischen Effekt zurückzuführen, den eine erhöhte Anzahl von Phosphaten auf die Konformation der Wassermoleküle hat, die das Molekül umgeben.
Da die GTP-Konzentration im Zytoplasma deutlich geringer ist als die von ATP, wird es für spezifische Funktionen im Zellstoffwechsel verwendet.
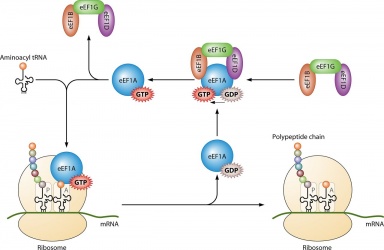
Es wird hauptsächlich bei der Proteinsynthese verwendet, wenn es mit IF2 während der ribosomalen Initiation, mit Ef-Tu und Ef-G während der Dehnung und mit RF3 während der Terminierung gekoppelt ist. Alle GTP-Moleküle, die an die genannten Proteine binden, werden dephosphoryliert, wodurch GDP und ein freies Phosphat entstehen
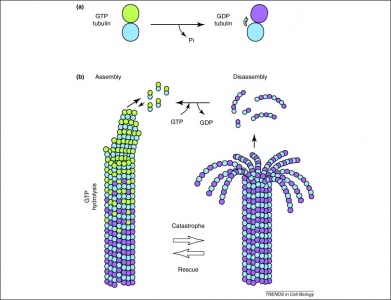
Außerdem wird GTP auch von Tubulin-Dimeren bei der Bildung von Mikrotubuli verwendet. Tubulin-Dimere bestehen aus Alpha- und Beta-Tubulin, die jeweils GTP-Bindungsstellen besitzen. Da sich das Beta-Tubulin am Plus-Ende des Filaments befindet, wird GTP hier immer dann hydrolysiert, wenn ein weiteres Dimer zum sich verlängernden Polymer hinzugefügt wird. Wichtig ist, dass die Hydrolyse von GTP die nicht-kovalenten Wechselwirkungen zwischen den Tubulindimeren schwächt und damit die Fähigkeit, die Mikrotubuli bei Bedarf aufzulösen, erleichtert. Man beachte, dass das GTP des Alpha-Tubulin-Proteins nicht dephosphoryliert wird, so dass es als durch die Mikrotubuli-Struktur hindurch konsistent angesehen werden kann.
Eine Ressource für die Signalübertragung
Der Nutzen der spezifischen Chemie und räumlichen Konformation von GTP wird durch seine Verwendung bei der Übertragung von Signalen effektiv demonstriert. In erster Linie ist es in der Lage, die Aktivität verschiedener Proteine des Signalwegs zu binden und zu regulieren, die in zwei verschiedene Gruppen eingeteilt werden. Die erste Gruppe sind heterotrimere GTP-bindende Proteine (auch als heterotrimere G-Proteine bekannt), die GTP bei der Aktivierung von G-Protein-gekoppelten Rezeptoren nutzen, um die Aktivität anderer Proteine in diesem Signalweg zu verändern. Die zweite Gruppe sind monomere GTP-bindende Proteine (auch als monomere G-Proteine bezeichnet). Diese reagieren auf andere Rezeptoren als G-Protein-gekoppelte Rezeptoren. Ein typisches Beispiel, das bei der Erklärung genannt wird, ist das Ras-Protein. Man beachte, dass sie in der Lage sind, GTP selektiv zu binden, und zwar nicht nur aufgrund seiner spezifischen Chemie, sondern auch aufgrund des Phänomens der induzierten Anpassung. Das gebundene GTP wird dann nach einer bestimmten Zeit hydrolysiert und führt so zu einer Autoinaktivierung des Proteins und zur Verhinderung einer übermäßigen Stimulierung eines Signalweges. Nach der Hydrolyse des GTP bleibt das BIP gebunden, da die Konformationsänderung zu einer Verschiebung der Affinität zum GTP-Molekül und zum BIP-Molekül führt. Dies ist jedoch eine unbeständige Veränderung und kann durch eine anschließende Aktivierung durch den G-Protein-gekoppelten Rezeptor wieder rückgängig gemacht werden.
GTP kann auch als Reaktionspartner zur Herstellung von cGMP verwendet werden, das ein relativ häufig vorkommendes sekundäres Signalmolekül ist. Die Katalyse wird durch die Freisetzung von NO ausgelöst, das die Guanylatzyklase aktiviert, ein Enzym, das cGMP aus GTP herstellt. cGMP kann dann als Effektor gegenüber Proteinkinasen wirken, die bestimmte Proteine phosphorylieren und deren Wirkung verändern.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell und P A Weil. Harper’s Illustrated Biochemistry. 28. Auflage. Beijing, China. 2009.
- J Dow, G Lindsay und J Morrison, Biochemistry: Molecules, Cells and the Body. 1. Auflage. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay und J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay und J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- M W King. The Medical Biochemistry Page. September 2016. Cited: 11:31. 03.12.2016. Verfügbar von: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell und P A Weil. Harper’s Illustrated Biochemistry. 28. Auflage. Beijing, China. 2009.
- M W King. The Medical Biochemistry Page. September 2016. Cited: 11:31. 03.12.2016. Verfügbar von: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. September 2016. Cited: 11:31. 03.12.2016. Verfügbar von: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. September 2016. Cited: 11:31. 03.12.2016. Verfügbar von: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. September 2016. Cited: 11:31. 03.12.2016. Verfügbar aus: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay und J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay und J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Dow, G Lindsay und J Morrison, Biochemistry: Molecules, Cells and the Body. 1st Edition. Wokingham, England. Addison-Wesley. 1996.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto und R Stryer. Biochemistry. Eighth Edition. Stadt und Land Unbekannt. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Eighth Edition. Stadt und Land Unbekannt. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto and R Stryer. Biochemistry. Eighth Edition. Stadt und Land Unbekannt. Freeman and Co. 2015.
- T E Dever and R Green. Die Elongations-, Terminations- und Recyclingphasen in Eukaryoten. CSHPB. July 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6th Edition. New York, USA. Garland Science. 2015.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.
- J Koolman und KH Roehm, Farbatlas der Biochemie, 3. Auflage, Stuttgart, Deutschland. Thieme 2013.