- Key Points
- Einführung
- Methoden
- Ergebnisse
- Stichprobe und Erfahrung der Teilnehmer
- Durchschnittlicher Gesamtschaden
- Unterschied zwischen den Bewertern von Akut- und Rehabilitationskliniken?
- Vergleich mit der letzten europäischen Analyse
- Plausibilitätsprüfung und Sensitivitätstest
- Diskussion
- Fazit
- Erklärung zur Datenverfügbarkeit
- Ethikerklärung
- Autorenbeiträge
- Interessenkonflikt
- Danksagungen
- Ergänzendes Material
Key Points
Illegale Drogen wie Methamphetamin, Heroin und Kokain, aber auch Alkohol wurden als besonders schädlich eingestuft.
Verordnete Drogen, darunter Opioide (im Gegensatz zu den USA, Kanada und Australien) und Nicht-Opioid-Analgetika, darunter Gabapentinoide, wurden als weniger schädlich eingestuft.
Die derzeitigen Gesetze stimmen nicht mit dieser Schadenseinstufung überein.
Einführung
Der Missbrauch von süchtig machenden psychoaktiven Substanzen ist durch negative gesundheitliche und soziale Folgen nicht nur für den Konsumenten, sondern auch für Nicht-Konsumenten in der Gemeinschaft oder Gesellschaft gekennzeichnet (1, 2). Das DSM-5 hat verschiedene spezifische substanzbezogene Abhängigkeits- und Suchtbedingungen definiert (3), und die ICD-10-Kodierung spiegelt verschiedene psychische und Verhaltensstörungen im Zusammenhang mit Alkohol, Tabak, Opiaten, Kokain, Stimulanzien, Halluzinogenen, Sedativa und Hypnotika, Cannabis und Cannabinoiden sowie flüchtigen Lösungsmitteln wider (4).
In den letzten 15 Jahren wurde das relative gesundheitliche und soziale Schadenspotenzial verschiedener Suchtmittel in England (5), den Niederlanden (6), Schottland (7), Frankreich (8) und zuletzt in Australien (9) von medizinischen und nichtmedizinischen Suchtexperten ermittelt. Die durchschnittliche Gesamtschädlichkeit verschiedener Substanzen wird in der Regel in relativen Ranglisten angegeben, die auf Analysen mehrerer Entscheidungen (5, 9) oder auf „Ad-hoc“-Bewertungen (6-8) unter Verwendung validierter gesundheitlicher und sozialer Dimensionen (5) beruhen. Diese Ranglisten stimmen nicht unbedingt mit den Prioritäten des Gesetzgebers und der Strafverfolgungsbehörden bei der relativen Regulierung und Kontrolle von Substanzen überein, wobei Alkohol ein Paradebeispiel für die Dissonanz zwischen den Gesamtschäden und den Kontrollbemühungen ist (5-9). Nutt et al. waren die ersten, die diese Inkongruenz aufzeigten (5).
Im Jahr 2014 kam eine Gruppe von 40 medizinischen und nichtmedizinischen Suchtexperten aus 21 EU-Ländern zu demselben Ergebnis (10). In diese Untersuchung wurden 20 Substanzen einbezogen (10). In der Zwischenzeit haben sich in Deutschland, wie auch in anderen westlichen Ländern, die Muster des Substanzmissbrauchs sowie die politischen Rahmenbedingungen verschoben, insbesondere
– Zunehmender Missbrauch von Methamphetamin vor allem in den Grenzregionen zur Tschechischen Republik (11-13).
– Zunehmendes Auftreten von neuen psychoaktiven Substanzen (NPS), insbesondere eine Fülle von synthetischen Cannabinoiden und Stimulanzien (meist Cathinone) (12-14).
– Zunehmende tödliche Überdosierungen mit Heroin/Morphin, opioidhaltigen und nicht-opioiden Analgetika, synthetischen Opioiden, Narkotika, Amphetamin, Amphetaminderivaten, Methamphetamin und NPS, bei gleichzeitigem Rückgang der Todesfälle durch Überdosierungen mit Medikamenten zur Behandlung der Opioidabhängigkeit wie Methadon und Buprenorphin (11, 15).
– Zunehmende Verfügbarkeit hochpotenter Cannabisprodukte mit erhöhtem Psychose- und Suchtrisiko (11, 13, 16, 17).
– Legalisierung von medizinischem Marihuana und Cannabinoiden zur ärztlichen Verschreibung (18).
Angesichts dieser Entwicklungen haben wir versucht, die Bewertung der gesundheitlichen und sozialen Schäden von Substanzen zu aktualisieren, die in Deutschland und anderswo häufig missbraucht werden, aber auch von Substanzen, die hierzulande weniger häufig missbraucht werden, aber bereits im Kommen sind (11, 12). In diesem Zusammenhang wurden zum ersten Mal synthetische Cannabinoide (14) in das Schadensranking aufgenommen. Wir haben auch Indexerhebungen der Schadensranglisten für Propofol, ein intravenöses Anästhetikum (19), und einige nicht-opioide Analgetika (NOA), d. h. Gabapentinoide, nicht-steroidale Antirheumatika (NSAIDs), Flupirtin und Triptane (20-24), einbezogen. Wir haben uns entschlossen, NOAs zusammen mit Opioid-Analgetika in unsere Bewertungen einzubeziehen, da Gabapentin und Pregabalin (Gabapentinoide) erst kürzlich in den Fokus der Suchtmedizin geraten sind. In den letzten zehn Jahren haben mehrere Pharmakovigilanz-Datenbanken, bevölkerungsbezogene Studien und Fallberichte vor ihrem potenziellen Missbrauch und ihrem mutmaßlichen Beitrag zu tödlichen Überdosierungen gewarnt, insbesondere in Kombination mit Opioiden (22, 23). Obwohl NSAIDs gemeinhin als nicht süchtig machend gelten, gibt es neuere Fallberichte (25, 26) und epidemiologische (27, 28) sowie klinische Daten (24), die einige Sicherheitsbedenken in Bezug auf diese traditionelle Ansicht aufkommen lassen. Auch bei anderen NOAs wurde ein potenzielles Missbrauchs- und Abhängigkeitsrisiko festgestellt, z. B. bei Florpirtin (21) oder Triptanen (20). Daher hielten wir es für klug, die genannten NOAs erstmals auch in eine Studie dieser Art einzubeziehen. Diese Studie ist die erste ihrer Art, die eine vergleichende Schadensbewertung mehrerer neuartiger missbräuchlich genutzter Substanzen, sowohl legaler/verschriebener als auch illegaler Substanzen, beinhaltet.
Methoden
Diese querschnittliche Fragebogenstudie umfasste zwei aufeinanderfolgende Schritte (Befragung 1 und Befragung 2, siehe unten), in denen quantitative Fragebögen in schriftlicher Form an deutsche Suchtmediziner verteilt wurden. Diese Experten wurden auf deutschen Suchtkongressen und -tagungen rekrutiert. Zusätzlich wurden die Fragebögen per E-Mail an 40 Leiter deutscher Suchtberatungsstellen versandt mit der Bitte, diese in ihrem Einflussbereich an andere Suchtmediziner weiterzugeben. Es wurden nur die Fragebögen in die Analyse einbezogen, die von Ärzten ausgefüllt worden waren, die (i) Fachärzte waren, d. h. über zusätzliche Expertise in mindestens einem medizinischen Fachgebiet verfügten, und (ii) länger als 5 Jahre in Krankenhäusern der tertiären Versorgung im Bereich der Behandlung von Substanzkonsumstörungen (SUD) tätig waren. Die Identität der Experten wurde anonym gehalten, mit Ausnahme der Informationen über ihr Alter, ihr Geschlecht, ihre Fachgebiete, ihre langjährige Berufserfahrung, die Jahre ihrer Tätigkeit in der tertiären Versorgung von SUD und den Schwerpunkt ihrer beruflichen Tätigkeit (Akut- oder Rehabilitationskrankenhaus) (Tabelle 1).
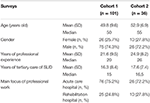
Tabelle 1. Charakteristika der Teilnehmer.
Die erste Erhebung wurde von März 2016 bis September 2017 durchgeführt und bewertete den durchschnittlichen Schaden von 33 Substanzen in 5 Dimensionen (physischer Schaden für Nutzer, psychischer Schaden für Nutzer, sozialer Schaden für Nutzer, physischer und psychischer Schaden für andere und sozialer Schaden für andere). Wie in der ergänzenden Abbildung 1 dargestellt, wurden diese Dimensionen anhand von 16 Kriterien definiert, die in mehreren Studien dieser Art validiert wurden (5, 9, 10) (siehe Abschnitt Ergänzende Materialien – Methoden). Die Gesamtschädigung der Nutzer und die Gesamtschädigung anderer umfasste 3 (physisch, psychisch, sozial) bzw. 2 (physisch & psychisch, sozial) Dimensionen (für Einzelheiten siehe ergänzende Abbildung 1). Die Bewertungen erfolgten anhand von 5-Punkte-Skalen (von „nicht schädlich“ bis „extrem schädlich“).
Der Fragebogen wurde von 122 Ärzten zurückgesandt, von denen 101 ausgewertet wurden, da 21 Experten die Einschlusskriterien nicht erfüllten. Die Ärzte durften selbst entscheiden, ob sie eine Substanz bewerten wollten oder nicht, und sie wurden angewiesen, ihre berufliche Erfahrung („keine/wenig“ oder „mäßig“ oder „viel“) mit jeder von ihnen bewerteten Substanz zu schätzen. Diese Informationen wurden benötigt, um die Validität der Bewertungen zu beurteilen und definierte Ausschlusskriterien zu überprüfen, d.h. eine Substanz mit <60% Bewertungen oder mehr als 60% „keine/wenig Erfahrung“-Bewertungen wurde von der weiteren Analyse ausgeschlossen. Folglich mussten die Substanzen Ayahuasca, Khat und Kratom aus der Schadensbewertung ausgeschlossen werden (ergänzende Abbildungen 2 und 3).
Die zweite Befragung (Gewichtung der Dimensionen zur Ermittlung des Gesamtschadens in Abbildung 1) wurde von September 2017 bis Mai 2018 von der Kohorte 2 durchgeführt, die sich ausschließlich aus den E-Mails an die oben genannten 40 Leiterinnen und Leiter deutscher Suchthilfeeinrichtungen rekrutierte. Diese Folgebefragung wurde nachträglich durchgeführt, da die erste Befragung recht umfangreich war und eine Kombination der beiden Befragungen die Befragten der Kohorte 1 überfordern würde, wodurch die Rücklaufquote sinken würde. In der zweiten Umfrage wurden die Teilnehmer gebeten, das relative Gewicht (als Anteil zwischen 0 und 1) jeder der fünf Dimensionen zu schätzen, die in der ersten Umfrage für die Konstitution des Gesamtschadens durch psychotrope Substanzen verwendet wurden. Alle 36 zurückgesandten Fragebögen wurden berücksichtigt. Für die Berechnung des Gesamtschadens jeder Substanz wurde die mittlere relative Gewichtung der 36 Experten für jede Dimension verwendet (Abbildung 1). Weitere Einzelheiten zur Berechnung des Gesamtschadens der verbleibenden 30 Stoffe und zugehörige Datenanalysen, einschließlich des Vergleichs mit der früheren EU-Rangliste (Abbildung 3), sind in den ergänzenden Materialien enthalten.
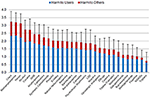
Abbildung 1. Durchschnittliche Gesamtschädlichkeit von 30 Substanzen (Mittelwerte und Standardabweichungen), wie von Kohorte 1 auf einer Skala von 0 („nicht schädlich“) bis 4 („extrem schädlich“) bewertet, dargestellt als schädlich für die Konsumenten und schädlich für andere. Der relative Beitrag der fünf Dimensionen (ergänzende Abbildung 1, ergänzende Tabelle 1) wurde von der Kohorte 2 gewichtet.
Zur Validierung der Rangfolgen wurde zunächst das Ausmaß der Variabilität zwischen der Gesamtschadensbewertung und einer der fünf Komponentendimensionen bewertet. Ein Unterschied zwischen der Gesamtschadensbewertung und einer der 5 separaten Bewertungen in den Dimensionen ≥8 Ränge wurde als signifikant angesehen und erfordert eine Plausibilitätserklärung (Tabelle 2). Ein zusätzlicher Validierungs-/Sensitivitätstest wurde durchgeführt, indem die von unserer Umfrage abgeleiteten mittleren Gewichte durch die konsensbasierten Gewichte der vorangegangenen EU-Studie ersetzt wurden (ergänzende Tabelle 1) und die sich daraus ergebenden Substanz-Rankings der ergänzenden Abbildung 9 mit denen der Abbildung 1 verglichen wurden (ergänzende Tabelle 2).
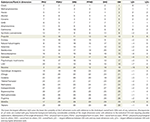
Tabelle 2. Plausibilitätsprüfung der Gesamtschadensgrade.
Ergebnisse
Stichprobe und Erfahrung der Teilnehmer
Die Fachärzte waren im Median 15 Jahre (Kohorte 1) und 16,5 Jahre (Kohorte 2) in der tertiären Versorgung von Patienten mit SUD tätig. Etwa drei von vier Teilnehmern arbeiteten in Akutkrankenhäusern, der Rest in Rehabilitationskliniken (Tabelle 1).
Durchschnittlicher Gesamtschaden
Die Bewertungen der Experten in den fünf verschiedenen Dimensionen sind in den (ergänzenden Abbildungen 4-8) dargestellt. In Bezug auf den Gesamtschaden wurden die traditionellen Drogen, d. h. Kokain (einschließlich „Crack“), Methamphetamin, Heroin und Alkohol, als am schädlichsten eingestuft. Die NPS, d. h. Cathinone und synthetische Cannabinoide, rangierten in der obersten Schadensgruppe auf den hinteren Plätzen. Ketamin, Benzodiazepine, Cannabis, psychotrope Pilze, LSD, Nikotin und opioide Analgetika lagen im Mittelfeld. Methadon und Buprenorphin (beide werden in Deutschland bevorzugt für die Erhaltungstherapie der Opioidabhängigkeit eingesetzt) lagen im unteren Bereich, während Methylphenidat (in Deutschland das bevorzugte Medikament für die ADHS-Behandlung) und NOAs im untersten Bereich des Harm-Rankings lagen. Unter den NOAs wurden Gabapentin und Pregabalin (Gabapentinoide) als schädlicher eingestuft als Flupirtin, NSAIDs und Triptane (Abbildung 1).
Unterschied zwischen den Bewertern von Akut- und Rehabilitationskliniken?
Die Bewertungen der Fachärzte aus Akut- und Rehabilitationskliniken waren sehr ähnlich, wie in Abbildung 2 dargestellt.
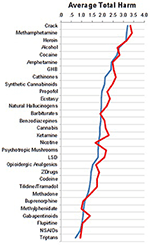
Abbildung 2. Vergleich der Einschätzungen zwischen Fachärzten in Akut- (n = 76, blaue Kurve) vs. Rehabilitationskliniken (n = 25, rote Kurve).
Vergleich mit der letzten europäischen Analyse
Diese aktualisierte deutsche Erhebung bewertete Methadon, Nikotin, Cannabis und Alkohol als weniger schädlich als die EU-Bewerter im Jahr 2014 (10), während psychotrope Pilze, Cathinone, Ecstasy, GHB, Methamphetamin und Crack als schädlicher eingeschätzt wurden – siehe Abbildung 3.
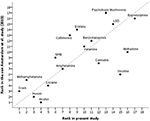
Abbildung 3. Korrelation zwischen der vorliegenden Bewertung und der letzten EU-Bewertung (10) der Gesamtschädlichkeit von Drogenmissbrauch (rs = 0,73). Zur besseren Orientierung zeigt die Winkelhalbierende die perfekte Korrelation an (rs = 1).
Plausibilitätsprüfung und Sensitivitätstest
Die geringsten Diskrepanzen zwischen dem durchschnittlichen Gesamtschadensranking und den 5 Gesundheits- und Sozialdimensionen-Rankings wurden für die traditionellen illegalen Drogen Crack (und anderes Kokain), Heroin, Methamphetamin und auch für Alkohol festgestellt, die auch in Bezug auf den Schaden auf den vordersten Plätzen rangieren. Dasselbe gilt für GHB und NPS, die an der Spitze rangieren, Ketamin im Mittelfeld, Opioide in den unteren Bereichen und die meisten NOAs (Gabapentinoide, Flupirtin, Triptane) in den untersten Bereichen. Auffällige Diskrepanzen wurden bei Propofol, Cannabis, Nikotin und NSAIDs festgestellt (Tabelle 2). Im Falle von Nikotin und NSAIDs ist die Diskrepanz wahrscheinlich größtenteils auf unverhältnismäßige körperliche Schäden zurückzuführen (z. B. Krebs, Schlaganfall, koronare Herzkrankheit, COPD für erstere und Magen-Darm-Blutungen, Nieren- und Herz-Kreislauf-Erkrankungen für letztere). Im Falle von Cannabis spiegelt die deutsche Literatur derzeit eine allgemeine Wahrnehmung relativ geringer körperlicher Schäden und umgekehrt eine Wahrnehmung erhöhter psychosozialer Schäden für die Konsumenten wider, eine Dichotomie, die die Diskrepanz hier noch verstärkt (29-31). Die Diskrepanz bei Nikotin (und vielleicht auch in gewissem Maße bei Propofol) könnte zum Teil auf eine unerwartet niedrige Einstufung der psychischen Schäden für die Konsumenten zurückzuführen sein, die von den empirischen Erkenntnissen abweicht. Diese potenzielle Unterschätzung kann daher die Gültigkeit der Gesamtschadensranglisten dieser spezifischen Substanzen gefährden.
Als wir alternativ die konsensbasierten Gewichtungen der EU-Rating-Studie (10) als Vergleichssensitivitätstest verwendeten, stellten wir fest, dass die sich daraus ergebende Rangfolge der Gesamtschadenswerte (ergänzende Abbildung 9) unserer aus der Umfrage abgeleiteten gewichteten Rangfolge in Abbildung 1 sehr ähnlich war (siehe ergänzende Tabelle 2 zum Vergleich). Dies deutet darauf hin, dass die ausreißerischen/schiefen Gewichtungen einzelner Dimensionen (siehe ergänzende Tabelle 1) die resultierende Gesamtschadensrangliste in unserer Studie nicht entscheidend beeinflussen.
Diskussion
Unsere Daten bestätigen die Situation in vielen anderen Ländern (5-10), in denen es zu einer Diskrepanz zwischen den Schadenspotentialen populärer Drogen und ihrer Regulierung durch die Betäubungsmittelgesetze kommt, was sich am deutlichsten an der Bewertung von Alkohol zeigt, der in unserem Land als eine der schädlichsten Substanzen gilt. Die relativ hohe Prävalenz des Alkoholkonsums/-missbrauchs (im Vergleich zu weniger häufig missbrauchten, aber vielleicht gefährlicheren Substanzen) trägt wahrscheinlich zu seinen dimensionsspezifischen Bewertungen, z. B. der Schädigung anderer, sowie zu seiner Gesamtposition bei. In ähnlicher Weise kann die abnehmende Prävalenz des Nikotinkonsums in Deutschland (da das Rauchen in vielen öffentlichen Bereichen wie Krankenhäusern, Bildungseinrichtungen, öffentlichen Verkehrsmitteln, Restaurants, Kneipen und Diskotheken in den letzten 10 Jahren verboten wurde) zu einer niedrigeren als der erwarteten Schadensbewertung beitragen. Darüber hinaus sollte erwähnt werden, dass der Nikotinkonsum trotz seiner Fähigkeit, eine beträchtliche Verhaltensabhängigkeit zu erzeugen, kaum mit dramatischen psychiatrischen Auswirkungen verbunden ist, z. B. im Gegensatz zum Alkohol- oder Halluzinogenkonsum. Diese Studie war die erste, in der die Schäden verschiedener NOAs mit den Schäden gut charakterisierter Missbrauchssubstanzen verglichen wurden, und wie erwartet sind die Schäden von NOAs deutlich geringer als die der traditionellen Missbrauchssubstanzen. Die vorliegende Studie war auch die erste, die synthetische Cannabinoide und Propofol in ein Gesamtschadensschema einbezog, was für die Psychoedukation von Konsumenten, für regulatorische Überlegungen oder für die Definition von politischen Handlungsfeldern zur Gesundheitsförderung von Nutzen sein kann.
NPS (Cathinone und synthetische Cannabinoide) wurden hier der obersten Schadensstufengruppe zugeordnet. Politische Entscheidungsträger und Kliniker würden von weiteren Daten über das NPS-Phänomen profitieren, z. B. über die damit verbundene Morbidität (32, 33) und Mortalität, die ansteigt (33).
Im Vergleich zur EU-Einstufung aus dem Jahr 2014 (10) wurden Cannabis, Methadon und Nikotin als weniger schädlich eingestuft, während Crack, Methamphetamin, GHB, Cathinone, Ecstasy und psychotrope Pilze als schädlicher angesehen wurden (Abbildung 3). Cannabis und Halluzinogene (d. h. Ketamin, psychotrope Pilze und LSD) wurden als ähnlich schädlich eingestuft wie Benzodiazepine oder Barbiturate. Es sollte erwähnt werden, dass sowohl Psilocybin (in Abbildung 1 als psychotrope Pilze aufgeführt) als auch LSD ein neues therapeutisches Potenzial bei psychiatrischen Erkrankungen haben und in diesem Zusammenhang offenbar ein geringes Missbrauchspotenzial aufweisen (34).
Interessant ist, dass Opioid-Analgetika nicht zu den schädlichsten Drogen gehören. Dies könnte möglicherweise damit zusammenhängen, dass eine „Opioid-Epidemie“ (wie in den USA, Kanada und Australien) in Deutschland oder Westeuropa noch nicht zu beobachten ist (35-38). Die relativ niedrige Schadenseinstufung von verschreibungspflichtigen Opioiden in unserer Studie steht in starkem Kontrast zu der hohen Stigmatisierung von illegalen Opioiden. Diese Ergebnisse decken sich mit der Multi-Decision-Analyse von neun Experten (8 aus dem Vereinigten Königreich und 1 aus den Niederlanden), die zu dem Schluss kommt, dass die Gesamtschädlichkeit von nicht medizinisch konsumierten verschreibungspflichtigen Opioiden weniger als die Hälfte der Schädlichkeit von injiziertem Straßenheroin beträgt (39).
Methadon wurde als weniger schädlich eingestuft als Standard-Opioid-Analgetika, wobei dieser Standpunkt möglicherweise dadurch verzerrt wird, dass Suchtmediziner Methadon in erster Linie als Standard-Erhaltungstherapie für Opioidabhängige ansehen, die in diesem Zusammenhang wiederholt gezeigt hat, dass sie die Morbidität und Mortalität verringert (15). Im Kontext des illegalen Konsums und Missbrauchs sind die Schäden von Methadon (z. B. Todesfälle durch Apnoe und Torsades-de-pointe, Abhängigkeit und Abzweigung) offensichtlich wesentlich höher als die mehrerer anderer Drogen, die vor Methadon stehen. Dies zeigt eine wesentliche Einschränkung von Studien zur Einstufung von Drogenschäden auf, die auf subjektiven Einschätzungen beruhen, da sie möglicherweise keine klare Unterscheidung zwischen den Schäden einer Droge mit therapeutischer Indikation in einem medizinischen Kontext und dem illegalen Gebrauch/Missbrauch außerhalb dieses Kontexts zulassen. Diese Diskrepanzen bei der Einstufung von Analgetika im Vergleich zu anderen Wirkstoffen deuten darauf hin, dass vielleicht auch die Erfahrung der Bewerter auf dem Gebiet der Schmerzmedizin hätte erhoben werden sollen.
Es kann nicht ausgeschlossen werden, dass unsere Bewertungen eher auf die Wahrnehmung von Schäden durch den Substanzkonsum in Großstädten als auf dem Lande zurückzuführen sind; um dies zu klären, wären weitere Untersuchungen in größeren Stichproben erforderlich. Auch ein möglicher geschlechtsspezifischer Einfluss auf die Wahrnehmung von Drogenschäden wurde hier nicht explizit untersucht (40, 41). Da wir die Fragebögen ohne Nachverfolgung aller Empfänger mit der Bitte um Weiterleitung an andere deutsche Suchtmediziner verschickt hatten, können wir keine Angaben über die genaue Anzahl der Experten machen, die unsere Fragebögen schließlich erhalten haben. Eine solche Vorgehensweise ist jedoch für Studien dieser Art nicht ungewöhnlich (5). Zu den weiteren Einschränkungen, ähnlich wie bei früheren Studien (5-10), gehört die Tatsache, dass die vorliegende Arbeit nicht den Anspruch erheben kann, strenge Anforderungen an die Repräsentativität zu erfüllen. Durch die Rekrutierung einer großen und homogenen Studiengruppe (alle Ärzte mit dem Schwerpunkt Suchtmedizin) wollten wir subjektive Verzerrungen reduzieren. Es gibt jedoch keine offizielle Statistik darüber, wie viele Fachärzte mit mehr als 5 Jahren Erfahrung in der tertiären Versorgung von SUD zum Zeitpunkt der Studie in Deutschland tätig waren. Wir schätzen, dass diese Zahl zwischen 250 und 500 Ärzten liegt, so dass unsere Stichprobe möglicherweise eine Minderheitssichtweise darstellt. In Deutschland sind die Experten für Suchtmedizin in der Regel Psychiater oder Allgemeinmediziner. Im Gegensatz zu den englischen (5), europäischen (10) und australischen (9) Studien haben wir keine Konsensus-Feedbacks verwendet. Obwohl dieser zusätzliche Schritt die Wahrscheinlichkeit der Zustimmung der Befragungsteilnehmer erhöht hätte (42), haben wir uns gegen diesen Weg entschieden, da konsensbasierte Entscheidungen per se Subjektivität nicht ausschließen (43) und es keine „one-size-fits-all-Methode“ für die Nutzen-Risiko-Bewertung gibt (44). Darüber hinaus wurden in früheren konsensbasierten Studien kleinere Stichproben verwendet, die aus Suchtexperten unterschiedlicher Berufsgruppen bestanden (5, 9, 10), deren heterogene Erfahrungen in der Behandlung von SUD eher eine konsensbasierte Entscheidungsstrategie erforderten als die unserer homogenen Gruppe. Ähnlich wie die niederländischen (6), schottischen (7) und französischen Forschergruppen (8) führten wir eine „Ad-hoc“-Bewertung durch, bei der wir validierte gesundheitliche und soziale Dimensionen verwendeten, die bereits in früheren (5, 10) und neueren (9) empirischen Studien genutzt wurden. Diese Entscheidung für ein „Ad-hoc“-Format maximierte den Rücklauf der ausgefüllten Fragebögen.
Abgesehen von der neuartigen Einbeziehung von NOAs, synthetischen Cannabinoiden und Propofol gibt es einige Stärken der vorliegenden Studie: (i) die Verwendung einer der größten Stichproben in dieser Art von Studie; (ii) die beträchtliche multidimensionale suchtmedizinische Erfahrung der Teilnehmer, einschließlich derjenigen von Fachärzten in Rehabilitationskliniken (Abbildung 2), die sich in Deutschland stark auf psychosoziale Dimensionen und Ergebnisse konzentriert; (iii) der Vergleich mit dem früheren EU-Rating (Abbildung 3); und (iv) die Ergänzung der aktuellen Literatur um den Vergleich von illegalen und legalen Drogen.
Die Ergebnisse dieser querschnittlichen Fragebogenstudie aktualisieren den durchschnittlichen Gesamtschaden (mit Teilschäden aus verschiedenen gesundheitlichen und sozialen Dimensionen), der sich aus dem Konsum/Missbrauch verschiedener psychoaktiver Substanzen (einschließlich verschreibungspflichtiger Analgetika) aus der Sicht deutscher Suchtmediziner ergibt. Es ist jedoch zu betonen, dass sich diese relativen Gesamtrankings auf Risiken auf Bevölkerungsebene beziehen und je nach individuellem und situativem Kontext sowie der Intensität des individuellen Missbrauchs nahezu jede psychoaktive Substanz sehr gefährlich und schädlich konsumiert werden kann.
Fazit
Die vorliegende Studie liefert ein aktualisiertes Ranking deutscher Suchtmediziner zu den durchschnittlichen Gesamtschäden sowie den Schäden in spezifischen gesundheitlichen und sozialen Dimensionen verschiedener psychoaktiver Substanzen, einschließlich Analgetika. Alkohol wurde als eines der schädlichsten Suchtmittel eingeschätzt, zusammen mit Heroin, Kokain, Methamphetamin, GHB und NPS (d. h. synthetische Cannabinoide, Cathinone). Die erhöhten Risiken von Alkohol stehen im Widerspruch zum deutschen Betäubungsmittelgesetz, ähnlich wie in den meisten Ländern. Cannabis und Ketamin wurden im Mittelfeld eingestuft, gleichauf mit Benzodiazepinen. Therapeutisch eingesetzte Drogen wie Nicht-Opioid-Analgetika, Methylphenidat und Opioide wurden insgesamt als die derzeit am wenigsten schädlichen eingeschätzt. Diese relative Sicherheitswahrnehmung kann sich jedoch ändern, wenn sich die Missbrauchsmuster im Laufe der Zeit ändern (45).
Erklärung zur Datenverfügbarkeit
Die Rohdaten, die die Schlussfolgerungen dieses Artikels untermauern, werden von den Autoren vorbehaltlos zur Verfügung gestellt.
Ethikerklärung
Die Studien mit menschlichen Teilnehmern wurden von der Ethik-Kommission der Medizinischen Fakultät der Universität Duisburg-Essen geprüft und genehmigt. Eine schriftliche Einverständniserklärung zur Teilnahme war für diese Studie in Übereinstimmung mit der nationalen Gesetzgebung und den institutionellen Anforderungen nicht erforderlich.
Autorenbeiträge
UB: Konzeption und Design. MSp: Analyse der Daten. UB und MSp: Erhebung und Interpretation der Daten. UB: Abfassung des Artikels. Alle Autoren: kritische Überarbeitung für wichtigen intellektuellen Inhalt.
Interessenkonflikt
NS hat Honorare für verschiedene Aktivitäten (z.B. Mitgliedschaft im Beirat, Vorträge, Manuskripte) von AbbVie, Camurus, Hexal, Janssen-Cilag, MSD, Medice, Mundipharma, Reckitt-Benckiser/Indivior und Sanofi-Aventis erhalten. In den letzten 3 Jahren hat er an klinischen Studien teilgenommen, die von der Pharmaindustrie finanziert wurden. TA erhielt Honorare (z. B. Beiratsmitgliedschaft) und/oder Ausbildungszuschüsse von Janssen-Cilag, Medice und Otsuka-Lundbeck NW erhielt Honorare für (nicht produktbezogene) Vorträge (Janssen-Cilag, mundipharma und Reckitt-Benckiser/Indivior), In den letzten drei Jahren nahm er an klinischen Studien teil, die von der pharmazeutischen Industrie finanziert wurden, und erhielt öffentliche Mittel (BayStMGP) für die Bewertung von Take-Home Naloxone. TH erhielt Honorare für verschiedene Tätigkeiten (z. B. Mitgliedschaft im Beirat, Vorträge) von Janssen-Cilag, Amomed, Shire, Takeda, Servier MSo war in den letzten 3 Jahren als Berater tätig oder erhielt Honorare für Vorträge von Ammomed, Indivior, Camurus. JR hat Honorare für die Teilnahme an Beratungsgremien, Beratung und Vorträgen von AbbVie, Camurus, Gilead, Hexal, Indivior und Sanofi-Aventis erhalten. JK erhielt Honorare von Bayer, Janssen, Lundbeck, Neuraxpharm, Otsuka Pharma, Schwabe und Servier für Vorträge auf Konferenzen und finanzielle Unterstützung für Reisen. Er hat von der Medtronic GmbH finanzielle Unterstützung für von Prüfärzten initiierte Studien erhalten. HM ist auch mit einer privaten Praxis (Northern Anesthesia; Pain Medicine, LLC, Eagle River, AK, USA) verbunden, die keinen Einfluss auf diese Studie hat.
Die übrigen Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken Jennifer Haverkemper, MSc (Psychologie), herzlich für ihre Unterstützung bei der Entwicklung des Fragebogens für Kohorte 1 und Ann-Christin Kanti, MD, für die Dateneingabe und -pflege. Wir danken auch Gabriele Lührmann, Chefsekretärin der Abteilung für Psychiatrie, Psychotherapie und Psychosomatik am EVK Castrop-Rauxel, für die Organisation der Korrespondenz mit Kollegen. Wir danken auch den vielen Ärzten, die sich freundlicherweise die Zeit genommen haben, an diesem Projekt teilzunehmen.
Ergänzendes Material
Das ergänzende Material zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fpsyt.2020.592199/full#supplementary-material
1. Korpi ER, den Hollander B, Farooq U, Vashchinkina E, Rajkumar R, Nutt DJ, et al. Mechanisms of action and persistent neuroplasticity by drugs of abuse. Pharmacol Rev. (2015) 67:872-1004. doi: 10.1124/pr.115.010967
CrossRef Full Text | Google Scholar
2. Morgen K. Counseling and Professional Identity in the 21st Century. Substance use Disorders and Addictions. Thousand Oaks, CA: Sage Publications, Inc (2017).
Google Scholar
3. APA American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. Washington, DC: APA (2013).
Google Scholar
4. Dilling H, Freyberger H. Taschenführer zur ICD-10-Klassifikation psychischer Störungen. Bern: Huber Verlag (2006).
Google Scholar
5. Nutt DJ, King LA, Phillips LD. Independent Scientific Committee on Drugs. Drug harms in the UK: a multicriteria decision analysis. Lancet. (2010) 376:1558-65. doi: 10.1016/S0140-6736(10)61462-6
CrossRef Full Text | Google Scholar
6. van Amsterdam J, Opperhuizen A, Koeter M, van den Brink W. Ranking the harm of alcohol, tobacco and illicit drugs for the individual and the population. Eur Addict Res. (2010) 16:202-7. doi: 10.1159/000317249
CrossRef Full Text | Google Scholar
7. Taylor M, Mackay K, Murphy J, McIntosh A, McIntosh C, Anderson S, et al. Quantifizierung der Selbst- und Fremdgefährdung durch Substanzmissbrauch: Ergebnisse einer Umfrage unter klinischen Experten in ganz Schottland. BMJ Open. (2012) 2:e000774. doi: 10.1136/bmjopen-2011-000774
CrossRef Full Text | Google Scholar
8. Bourgain C, Falissard B, Blecha L, Benyamina A, Karila L, Reynaud M. A damage/benefit evaluation of addictive product use. Addiction. (2012) 107:441-50. doi: 10.1111/j.1360-0443.2011.03675.x
CrossRef Full Text | Google Scholar
9. Bonomo Y, Norman A, Biondo S, Bruno R, Daglish M, Dawe S, et al. The Australian drug harms ranking study. J Psychopharmacol. (2019) 33:759-68. doi: 10.1177/0269881119841569
CrossRef Full Text | Google Scholar
10. van Amsterdam J, Nutt D, Phillips L, van den Brink W. European rating of drug harms. J Psychopharmacol. (2015) 29:655-60. doi: 10.1177/0269881115581980
CrossRef Full Text | Google Scholar
11. DSB (Drogen und Suchtbericht 2018). Die Drogenbeauftragte der Bundesregierung. (2018). Online verfügbar unter: https://www.drogenbeauftragte.de/fileadmin/dateien-dba/Drogenbeauftragte/Drogen_und_Suchtbericht/pdf/DSB-2018.pdf (Zugriff am 6. Januar 2020).
Google Scholar
12. Atzendorf J, Rauschert C, Seitz N, Lochbühler K, Kraus L. Der Konsum von Alkohol, Tabak, illegalen Drogen und Medikamenten. Eine Schätzung des Konsums und der substanzbezogenen Störungen in Deutschland. Dtsch Arztebl Int. (2019) 116:577-84. doi: 10.3238/arztebl.2019.0577
CrossRef Full Text | Google Scholar
13. Seitz NN, Lochbühler K, Atzendorf J, Rauschert C, Pfeiffer-Gerschel T, Kraus L. Trends in substance use and related disorders-analysis of the epidemiological survey of substance abuse 1995 to 2018. Dtsch Arztebl Int. (2019) 116:585-91. doi: 10.3238/arztebl.2019.0585
CrossRef Full Text | Google Scholar
14. Scherbaum N, Schifano F, Bonnet U. Neue psychoaktive Substanzen (NPS) – eine Herausforderung für die Suchtkrankenhilfe. Pharmacopsychiatry. (2017) 50:116-22. doi: 10.1055/s-0043-102059
CrossRef Full Text | Google Scholar
15. Dematteis M, Auriacombe M, D’Agnone O, Somaini L, Szerman N, Littlewood R, et al. Recommendations for buprenorphine and methadone therapy in opioid use disorder: a European consensus. Expert Opin Pharmacother. (2017) 18:1987-99. doi: 10.1080/14656566.2017.1409722
CrossRef Full Text | Google Scholar
16. Chandra S, Radwan MM, Majumdar CG, Church JC, Freeman TP, ElSohly MA. Neue Trends bei der Cannabispotenz in den USA und Europa während des letzten Jahrzehnts (2008-2017). Eur Arch Psychiatry Clin Neurosci. (2019) 269:5-15. doi: 10.1007/s00406-019-00983-5
CrossRef Full Text | Google Scholar
17. Di Forti M, Quattrone D, Freeman TP, Tripoli G, Gayer-Anderson C, Quigley H, et al. The contribution of cannabis use to variation in the incidence of psychotic disorder across Europe (EU-GEI): a multicentre case-control study. Lancet Psychiatry. (2019) 6:427-36. doi: 10.1016/S2215-0366(19)30048-3
CrossRef Full Text | Google Scholar
18. EMCDDA Europäische Beobachtungsstelle für Drogen und Drogensucht. 2018 Medical use of Cannabis and Cannabinoids: Questions and Answers for Policymaking. Luxemburg: Amt für Veröffentlichungen der Europäischen Union (2018). Online verfügbar unter: http://www.emcdda.europa.eu/system/files/publications/10171/20185584_TD0618186ENN_PDF.pdf (Zugriff am 6. Januar 2020).
Google Scholar
19. Bonnet U. Bewertung des Suchtrisikos von Propofol. Fortschr Neurol Psychiatry. (2011) 79:442-52. doi: 10.1055/s-0031-1273411
CrossRef Full Text | Google Scholar
20. Beau-Salinas F, Jonville-Béra AP, Cissoko H, Bensouda-Grimaldi L, Autret-Leca E. Drug dependence associated with triptans and ergot derivatives: a case/non-case study. Eur J Clin Pharmacol. (2010) 66:413-7. doi: 10.1007/s00228-009-0769-6
CrossRef Full Text | Google Scholar
21. Gahr M, Freudenmann RW, Connemann BJ, Hiemke C, Schönfeldt-Lecuona C. Abuse liability of flupirtine revisited: implications of spontaneous reports of adverse drug reactions. J Clin Pharmacol. (2013) 53:1328-33. doi: 10.1002/jcph.164
CrossRef Full Text | Google Scholar
22. Evoy KE, Morrison MD, Saklad SR. Missbrauch und Fehlgebrauch von Pregabalin und Gabapentin. Drugs. (2017) 77:403-26. doi: 10.1007/s40265-017-0700-x
CrossRef Full Text | Google Scholar
23. Bonnet U, Scherbaum N. How addictive are gabapentin and pregabalin? A systematic review. Eur Neuropsychopharmacol. (2017) 27:1185-2015. doi: 10.1016/j.euroneuro.2017.08.430
CrossRef Full Text | Google Scholar
24. Bonnet U, Strasser JC, Scherbaum N. Screening for physical and behavioral dependence on non-opioid analgesics in a German elderly hospital population. Addict Behav. (2019) 90:265-71. doi: 10.1016/j.addbeh.2018.11.009
CrossRef Full Text | Google Scholar
25. Etcheverrigaray F, Grall-Bronnec M, Blanchet M, Jolliet P, Victorri-Vigneau C. Ibuprofen-Abhängigkeit: ein Fallbericht. Pharmacopsychiatry. (2014) 47:115-7. doi: 10.1055/s-0034-1371868
CrossRef Full Text | Google Scholar
26. Godersky ME, Vercammen LK, Ventura AS, Walley AY, Saitz R. Identification of non-steroidal anti-inflammatory drug use disorder: a case report. Addict Behav. (2017) 70:61-4. doi: 10.1016/j.addbeh.2017.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Cryer B, Barnett MA, Wagner J, Wilcox CM. Overuse and misperceptions of nonsteroidal anti-inflammatory drugs in the United States. Am J Med Sci. (2016) 352:472-80. doi: 10.1016/j.amjms.2016.08.028
CrossRef Full Text | Google Scholar
28. Wójta-Kempa M, Krzyzanowski DM. Korrelate des Missbrauchs von rezeptfreien Schmerzmitteln in der erwachsenen Bevölkerung von Wrocław (Polen). Adv Clin Exp Med. (2016) 25:349-60. doi: 10.17219/acem/58887
CrossRef Full Text | Google Scholar
29. Hölscher F, Bonnet U, Scherbaum N. Nutzung eines ambulanten Behandlungszentrums für Cannabismissbrauch. Nervenarzt. (2008) 79:571-6. doi: 10.1007/s00115-008-2412-7
CrossRef Full Text | Google Scholar
30. Bonnet U, Specka M, Scherbaum N. Häufiger nicht-medizinischer Cannabiskonsum: Gesundheitliche Folgeerscheinungen und Wirksamkeit der Entgiftungsbehandlung. Dtsch Med Wochenschr. (2016) 141:126-31. doi: 10.1055/s-0041-106313
CrossRef Full Text | Google Scholar
31. Schneider D. Konsumfolgen und Behandlungsbedarf von Cannabis-Intensivkonsumenten/innen im ambulanten Setting. Sucht. (2016) 62:23-30. doi: 10.1024/0939-5911/a000405
CrossRef Full Text | Google Scholar
32. Foti F, Marti M, Ossato A, Bilel S, Sangiorgi E, Botrè F, et al. Phenotypic effects of chronic and acute use of methiopropamine in a mouse model. Int J Legal Med. (2019) 133:811-20. doi: 10.1007/s00414-018-1891-8
CrossRef Full Text | Google Scholar
33. Corkery JM, Schifano F, Martinotti G. How deaths can help clinicians and policy-makers understand the risks of novel psychoactive substances. Br J Clin Pharmacol. (2020) 86:482-98. doi: 10.1111/bcp.14183
CrossRef Full Text | Google Scholar
34. Chi T, Gold JA. A review of emerging therapeutic potential of psychedelic drugs in the treatment of psychiatric illnesses. J Neurol Sci. (2020) 411:116715. doi: 10.1016/j.jns.2020.116715
CrossRef Full Text | Google Scholar
35. Häuser W, Schug S, Furlan AD. Die Opioidepidemie und nationale Leitlinien für die Opioidtherapie bei chronischen nicht-krebsbedingten Schmerzen: eine Perspektive aus verschiedenen Kontinenten. Pain Rep. (2017) 2:e599. doi: 10.1097/PR9.0000000000000599
CrossRef Full Text | Google Scholar
36. Kraus L, Seitz NN, Schulte B, Cremer-Schaeffer P, Braun B, Verthein U, et al. Schätzung der Zahl der opioidabhängigen Menschen in Deutschland. Dtsch Arztebl Int. (2019) 116:137-43. doi: 10.3238/arztebl.2019.0137
CrossRef Full Text | Google Scholar
37. Rosner B, Neicun J, Yang JC, Roman-Urrestarazu A. Opioid prescription patterns in germany and the global opioid epidemic: systematic review of available evidence. PLoS ONE. (2019) 14: e0221153. doi: 10.1371/journal.pone.0221153
CrossRef Full Text | Google Scholar
38. Meyer A, LeClair C, McDonald JV. Verschreibungspflichtige Opioide in Westeuropa und den Vereinigten Staaten. R I Med J. (2020) 103:45-8.
Google Scholar
39. van Amsterdam J, Phillips L, Henderson G, Bell J, Bowden-Jones O, Hammersley R, et al. Ranking the harm of non-medically used prescription opioids in the UK. Regul Toxicol Pharmacol. (2015) 73:999-1004. doi: 10.1016/j.yrtph.2015.09.014
CrossRef Full Text | Google Scholar
40. Bodnar RJ, Kest B. Sexual differences in opioid analgesia, hyperalgesia, tolerance and withdrawal: central mechanisms of action and roles of gonadal hormones. Horm Behav. (2010) 58:72-81. doi: 10.1016/j.yhbeh.2009.09.012
CrossRef Full Text | Google Scholar
41. Di Nicola M, Ferri VR, Moccia L, Panaccione I, Strangio AM, Tedeschi D, et al. Gender differences and psychopathological features associated with addictive behaviors in adolescents. Front Psychiatry. (2017) 8:256. doi: 10.3389/fpsyt.2017.00256
PubMed Abstract | Querverweis Volltext | Google Scholar
42. Phillips LD, Banae Costa CA. Transparente Prioritätensetzung, Budgetierung und Ressourcenzuweisung mit multikriterieller Entscheidungsanalyse und Entscheidungskonferenz. Ann Operat Res. (2007) 154:51-68. doi: 10.1007/s10479-007-0183-3
CrossRef Full Text | Google Scholar
43. Rolles S, Measham F. Questioning the method and utility of ranking drug harms in drug policy. Int J Drug Policy. (2011) 22:243-6. doi: 10.1016/j.drugpo.2011.04.004
CrossRef Full Text | Google Scholar
44. Mt-Isa S, Hallgreen CE, Wang N, Callréus T, Genov G, Hirsch I, Hobbiger SF, et al. Balancing benefit and risk of medicines: a systematic review and classification of available methodologies. Pharmacoepidemiol Drug Saf . (2014) 23:667-78. doi: 10.1002/pds.3636
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Martinotti G, de Risio L, Vannini C, Schifano F, Pettorruso M, Di Giannantonio M. Substanzbezogene exogene Psychose: ein postmodernes Syndrom. CNS Spectr. (2020) 1-8. doi: 10.1017/S1092852920001479
CrossRef Full Text | Google Scholar