Einführung: Migräneklinik
Migräne besteht aus einseitigen Kopfschmerzen, die von einer Reihe anderer sensorischer, autonomer und kognitiver Symptome begleitet werden, und wurde von der Global Burden of Disease (GBD)-Studie 2016 als die sechsthäufigste Erkrankung und eine der Hauptursachen für Behinderungen auf der ganzen Welt identifiziert, die häufig im erwerbstätigen Alter und bei jungen Erwachsenen und Frauen mittleren Alters auftritt (Collaborators, 2018). Daher stellt Migräne in Bezug auf die mit Behinderung gelebten Lebensjahre (YLDs) ein sehr ernstes soziales Problem dar und ist die wichtigste Ursache für YLDs im Alter von 15 bis 49 Jahren (siehe Steiner et al., 2018). Die Belastung durch diese Erkrankung wurde bis vor Kurzem nicht erkannt, da: Migräne keine Ursache für dauerhafte Behinderung oder Tod ist; Kopfschmerzen treten gelegentlich in der Allgemeinbevölkerung auf (Collaborators, 2018). Obwohl eine eindeutige Pathogenese für Migräne nicht bekannt ist, ist der extrakranielle Kreislauf beteiligt (Drummond und Lance, 1983). Der klinische Verlauf der Migräne gliedert sich in verschiedene aufeinanderfolgende oder begleitende Phasen: Vorwarnphase, Aura, Kopfschmerz und Postdrom (ähnlich der Vorwarnphase) (Goadsby et al., 2017a). Die prämonitorische Phase umfasst Reizbarkeit, Essenssucht und Nackensteifigkeit und kann 2 bis 72 Stunden vor der Attacke auftreten und setzt sich über die anderen Phasen fort. Nach den Definitionen der International Classification of Headache Disorders third edition (ICHD-3):
– ist die Aura durch ein oder mehrere vorübergehende, reversible neurologische Defizite gekennzeichnet, von denen mindestens eines eine einseitige Lokalisation aufweisen muss, die sich über 5 min oder mehr entwickeln und von denen jedes Defizit zwischen 5 und 60 min andauert;
– besteht die Migräne aus Kopfschmerzattacken, die 4-72 h andauern und von Übelkeit, Photophobie und Phonophobie oder beidem begleitet werden (siehe Goadsby et al., 2017a).
Kutane Allodynie, definiert als die Wahrnehmung von Schmerzen nach nicht-schmerzhaften Reizen, tritt bei mehr als 70 % der Patienten auf (Lambru et al., 2018). Starke Kopfschmerzen lassen in der Postdromphase nach oder hören auf, während andere Symptome wie Asthenie, Somnolenz und Photophobie den Patienten weiterhin beeinträchtigen, was die komplexe neuronale Grundlage der Migräne zeigt (Lambru et al., 2018). Abhängig von den betroffenen Tagen pro Monat wird Migräne als episodisch (weniger als 15 Migräne- oder Kopfschmerztage) oder chronisch (mindestens 15 Tage, davon 8 oder mehr Migränetage) klassifiziert (siehe Goadsby et al., 2017b). Dieser Aspekt beeinflusst in erheblichem Maße die Auswirkungen der Erkrankung und die therapeutischen Möglichkeiten (Giamberardino et al., 2017). Bei 1 bis 3 Anfällen pro Monat ist es möglich, nur abortive symptomatische Medikamente einzusetzen, während bei 4 bis 14 Anfällen pro Monat zwingend präventive Behandlungen hinzukommen müssen; letztere sind notwendig, um eine Chronifizierung der Erkrankung zu vermeiden (Giamberardino und Martelletti, 2015; Giamberardino et al, 2017) und um das Risiko eines Kopfschmerzes durch Medikamentenübergebrauch und einer refraktären Migräne zu verringern (Martelletti, 2017).
Pathophysiologie der Migräne und Calcitonin Gene-Related Peptide (CGRP)
Die genaue Ursache von Migräneattacken ist noch nicht genau bekannt, aber die aktuelle Forschung hat die Bedeutung von Sensibilisierungsprozessen im trigeminovaskulären System und im gesamten Hirnstamm sowie die Beobachtung einer reduzierten grauen Substanz in schmerzverarbeitenden Bereichen hervorgehoben (siehe Goadsby et al, 2017a). Vom Ganglion trigeminale, das den Zellkörper enthält, synaptieren pseudo-unipolare primäre Afferenzen auf die Blutgefäße und auf den trigeminozervikalen Komplex, von dem aus Fasern zweiter Ordnung auf thalamokortikale Neuronen dritter Ordnung und auf den Locus coeruleus, das periaquäduktale Grau und den Hypothalamus synaptieren (Goadsby et al., 2017a). Die nozizeptiven Fasern aus dem Ganglion trigeminale und den zervikalen Spinalganglien innervieren die Dura mater-Gefäße, und ihre Terminals setzen vasoaktive Neuropeptide wie Calcitonin Gene-Related Peptide (CGRP) frei, die eine Vasodilatation bewirken. Die Expression von CGRP, CLR und RAMP1 in menschlichen Dura-Gefäßen ist in den Abbildungen 1A-C dargestellt. Die autonomen Nervenfasern, die das extrazerebrale Gefäßsystem innervieren, enthalten mehrere vasoaktive Neurotransmitter-Moleküle: Noradrenalin, Serotonin, Acetylcholin, Neuropeptid Y (NPY), vasoaktives intestinales Polypeptid (VIP), Substanz P (SP), Neurokinin A (NU) und CGRP (Goadsby et al., 1990). Die CGRP-Rezeptorantagonisten blockieren die nozizeptiven Informationen aus der Dura mater: Sie werden in den Thalamuskernen verarbeitet, von wo aus sie in die höheren kortikalen Regionen gelangen. Diese Eingänge aus dem trigeminovaskulären System unterliegen der Modulation durch den absteigenden Hirnstamm: Es wird angenommen, dass die 5-Hydroxytryptamin (5HT)1B/1D-Rezeptor-Agonisten, d.h. die Triptane, über dieses System wirken und der aufgetretenen Vasodilatation entgegenwirken. Während Propranolol und Topiramat zur Vorbeugung eingesetzt werden, werden die letztgenannten Medikamente bei akuten Migräneepisoden verwendet. Abgesehen von ihrer gefäßverengenden Wirkung hemmen Triptane, die direkt auf präsynaptische 5HT1B/D-Rezeptoren wirken, insbesondere die Freisetzung von Mediatoren wie CGRP, die an der Nozizeption beteiligt sind. Darüber hinaus wurde experimentell nachgewiesen, dass Sumatriptan den durch Transient-Receptor-Potential-Vanilloid 1 (TRPV1) vermittelten Einwärtsstrom in den Trigeminalganglien hemmt (Evans et al., 2012). CGRP wird bei Migräneanfällen freigesetzt und spielt mehrere Rollen als das vasoaktivste Neuropeptid, dessen kraniovaskuläre Spiegel im Verlauf der Erkrankung ansteigen (Goadsby et al., 1990). Es hat sich gezeigt, dass CGRP auch im Liquor Veränderungen unterliegt (van Dongen et al., 2017). Die Auslöser für die veränderte zentrale Erregbarkeit und den anschließenden Durchbruch von Migräneschmerzepisoden werden seit langem untersucht. Die Stimulation von Nervenfasern kann sowohl orthodrome als auch antidrome Aktionspotenziale auslösen, und insbesondere die Aktivierung von dural-peptidergischen primären sensorischen Afferenzen, die das transiente Rezeptorpotenzial (TRP) exprimieren, kann die Freisetzung verschiedener Moleküle, darunter CGRP, induzieren, die entzündliche Gewebereaktionen auslösen, die als neurogene Entzündung bekannt sind (Xanthos und Sandkühler, 2014). Insbesondere ist CGRP an der kranialen Nozizeption und an dem Epiphänomen der Vasodilatation beteiligt, indem es seine Rezeptoren an meningeale und zerebrale Blutgefäße bindet (Deen et al., 2017). Diese Prozesse fördern die Sensibilisierung der trigeminalen Fasern zweiter Ordnung, die verstärkte Schmerzreize in höhere Regionen wie Thalamus, Hypothalamus und Kortex leiten und so Migräne auslösen (Dussor et al., 2014). TRPs werden als Reaktion auf verschiedene Umweltreize wie Temperatur- und pH-Schwankungen aktiviert, die bei prädisponierten Personen Migräneschmerzen auslösen können. CGRP wird durch gewebespezifisches alternatives Spleißen des Calcitonin-Gens CALC I auf Chromosom 11 gebildet, das auch für Calcitonin kodiert. Im Gegensatz dazu wird β-CGRP vom Gen CALC II produziert, das sich an einer anderen Stelle von Chromosom 11 befindet. Das Neuropeptid α-CGRP kommt im zentralen Nervensystem als α-Isoform mit 37 Aminosäuren vor, und seine Signaltransduktion wird durch zwei Rezeptoren vermittelt.
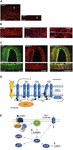
Abbildung 1. CGRP-Vorkommen und -Weg bei Migräne. Expression von CGRP, CLR und RAMP1 in menschlichen Dura-Gefäßen: (A) CGRP-Immunreaktivität findet sich in dünnen Fasern in der Adventitia; (B) Quer- und Längsschnitte zeigen RAMP1-Expression im Zytoplasma glatter Muskelzellen; (C) Koexpression von CLR und RAMP1 in der glatten Muskelzellschicht. (D) Komponenten des CGRP-Rezeptors und wichtige Reste für die Signalisierung und Internalisierung des Rezeptors. Der CGRP-Rezeptor wird durch CLR (blau), RAMP1 (gelb) und RCP (orange) gebildet. Funktionell wichtige Reste sind als Abkürzungen mit einem Buchstaben dargestellt. Die Aminosäurereste sind ab dem Beginn des vorhergesagten N-terminalen Signalpeptids (Swiss-Prot Q16602) nummeriert. Mehrere Aminosäuren innerhalb des C-Terminus des CLR (∼N400-C436) und I312 an der ICL3/TM5-Kreuzung sind für eine effektive CGRP-vermittelte Internalisierung erforderlich. Wichtige Merkmale des CGRP-Rezeptors, einschließlich des TM6-„Knicks“ (P343) und der mutmaßlichen achten Helix (∼G388-W399) in CLR, sind dargestellt. C′, C-terminal; ECL, extrazelluläre Schleife; ICL, intrazelluläre Schleife; N′, N-terminal; TM, Transmembran. (E) CGRP-Rezeptor-vermittelte intrazelluläre Signalisierung: Die Gαs-Signalisierung steigert die AC-Aktivität (grün), wodurch das intrazelluläre cAMP erhöht und PKA und in der Folge viele potenzielle nachgeschaltete Effektoren aktiviert werden. Die Tafeln (A-C) wurden von Eftekhari et al. (2013) und die Tafeln (D,E) von Walker et al. (2010) mit Genehmigung übernommen.
Der erste ist als kanonischer CGRP-Rezeptor bekannt und ist ein Gαs-Protein-gekoppelter Rezeptor, der das rezeptoraktivitätsmodifizierende Protein (RAMP) 1 benötigt, um funktionsfähig zu sein (Goadsby et al., 2017a). Der zweite ist der menschliche Amylin-Subtyp-1-Rezeptor (AMY1): Amylin gehört zur Familie der Calcitonin-Gene und hat eine hormonelle Wirkung. Wenn CGRP an seinen Rezeptor bindet, wird es einer Dynamin/Clathrin-abhängigen Internalisierung unterzogen, nachdem es mit β-Arrestin komplexiert wurde (siehe Walker et al., 2010). Es kommt zu Konformationsänderungen, die eine Aktivierung der Adenylatzyklase (AC), einen Anstieg von cAMP und eine Aktivierung der Proteinkinase A (PKA) bewirken, die eine Vasodilatation durch direkte Aktivierung der endothelialen Stickstoffmonoxid-Synthase und Schmerzreaktionen fördern kann. Der letztgenannte Rezeptor kann an Gαq/11 mit der Aktivierung von Phospholipase C (PLC), an die mitogen-aktivierte Proteinkinase (MAPK) und an die Freisetzung von NO gekoppelt werden (siehe Walker et al., 2010) (siehe Abbildungen 1D und E für eine schematische Darstellung der durch den CGRP-Rezeptor vermittelten intrazellulären Signalübertragung). Die Verabreichung von CGRP an Migränepatienten löst die Anfälle aus, und dieser Nachweis unterstützt seine zentrale Rolle in der Pathogenese der Migräne (Lassen et al., 2002). Ein System zur Beendigung des Signals ist noch nicht identifiziert worden: CGRP wird durch Neprilysin, Insulin-abbauende Enzyme und Endothelin-umwandelndes Enzym-1 abgebaut, und es wurde ein aktives Wiederaufnahme-Transportsystem vermutet (siehe Russell et al., 2014). Wenn der Rezeptor vorübergehend durch CGRP aktiviert wird, wird er außerdem in Endosomen internalisiert und schnell zur Zellmembran zurückgeführt, während eine chronische Stimulation des Rezeptors eine Desensibilisierung und einen lysosomalen Abbau induziert (siehe Russell et al, 2014).
Pharmakologische Interventionen auf dem CGRP-Weg
Migräne ist eine vielschichtige, behindernde neurovaskuläre Störung, und die derzeitige Therapie mit oralen Triptanen ist bei akuten Anfällen wirksam, obwohl etwa 40 % der Patienten behandlungsresistent sind (Ferrari et al., 2001; Edvinsson, 2015). Diese selektiven 5-HT1B/1D-Agonisten, von denen das am häufigsten verwendete Sumatriptan ist, das meist subkutan verabreicht wird, entfalten ihre therapeutische Wirkung durch Vasokonstriktion der kranialen Gefäße und Hemmung des trigeminalen und trigeminozervikalen Systems (siehe Ferrari et al., 2001). Die Vasokonstriktion stellt jedoch eine Grenze für die kardiovaskulären Nebenwirkungen dieser Medikamente dar. Außerdem darf die Behandlung mit Triptanen wegen des Risikos von medikamenteninduzierten Kopfschmerzen nicht länger als 9 Tage pro Monat dauern. Im Jahr 2010 wurde Botulinumtoxin Typ A (BoNT-A) von der Food and Drug Administration (FDA) zur Prävention von Migräne bei chronischen Migränepatienten, die nicht auf das Medikament ansprechen, zugelassen, doch seine komplexe Verabreichung (es muss an 31 Stellen injiziert werden) schränkt die Compliance der Patienten ein. Aufgrund der zentralen Rolle, die CGRP in der Pathophysiologie der Migräne spielt, wurden Antagonisten des CGRP-Rezeptors entwickelt. Diese Medikamente gehören zur Klasse der Gepantien. Telgecepant, das erste orale Gepant, erwies sich bei Migränepatienten mit koronarer Herzkrankheit als gut verträglich (ClinicalTrials.gov NCT00662818, Ho et al., 2012), wies jedoch Hepatotoxizität auf. Daher wurde trotz kontinuierlicher Forschung an diesen kleinen Molekülen ein neuer Ansatz vorgeschlagen, der in der Entwicklung von monoklonalen Antikörpern (mAbs) gegen CGRP (Nezumabs) oder den CGRP-Rezeptor (Numabs) besteht. Man geht davon aus, dass diese Medikamente die Wirkung der zirkulierenden CGRP-Moleküle hemmen, um Migräneanfälle zu verhindern, und da sie aufgrund ihrer Größe die Blut-Hirn-Schranke (BHS) nicht passieren, sollten die Wirkorte im trigeminalen System liegen (Edvinsson, 2015). Insbesondere die Duralgefäße sind nicht in der BHS enthalten. Darüber hinaus passiert CGRP wahrscheinlich nicht die BHS und wirkt als parakriner Modulator, da es von der Hälfte der Neuronen des Trigeminusganglions exprimiert wird, die den CGRP-Rezeptor nicht präsentieren, der von den Satelliten-Gliazellen und den 30 % der Neuronen-Somas des Trigeminusganglions exprimiert wird (siehe Yuan et al., 2017). Derzeit werden vier mAbs – Eptinezumab, Fremanezumab, Galcanezumab und Erenumab – in klinischen Studien zur Behandlung von episodischer und chronischer Migräne untersucht. Bei den ersten drei mAbs handelt es sich um humanisierte Antikörper, die gegen CGRP gerichtet sind, während Erenumab ein humaner Antikörper gegen dessen kanonischen Rezeptor ist. Die Halbwertszeit dieser Medikamente ist recht lang, so dass nicht mehr als eine Verabreichung pro Monat möglich ist, was von Interesse ist, da die mAbs intravenös oder subkutan verabreicht werden müssen. Insbesondere Eptinezumab wird nur intravenös verabreicht (Israel et al., 2018). Die Phase-III-Studie PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) untersuchte die Wirksamkeit von Eptinezumab bei der Prävention häufiger episodischer Migräne. Die Ergebnisse zeigten eine signifikante Reduktion des primären Endpunkts, bestehend aus der Verringerung der monatlichen Migränetage (MMDs) vom mittleren Ausgangswert von 8,5 Tagen über die Wochen 1-12 auf 4,3 MMDs mit der Dosis von 300 mg, 3,9 mit 100 mg und 4,0 mit 30 mg im Vergleich zu 3,2 Tagen unter Placebo (Saper et al., 2018). Zur Bewertung von Eptinezumab in der Prävention von chronischer Migräne wurden 1121 Teilnehmer in die PROMISE 2-Studie (ClinicalTrials.gov NCT02974153) aufgenommen. Die Wirksamkeit von Galcanezumab bei der Vorbeugung von episodischer Migräne wurde in der doppelblinden, randomisierten, placebokontrollierten Phase-3-Studie EVOLVE-1 (ClinicalTrials.gov NCT02614183), die in vier Abschnitte unterteilt war, und in der randomisierten, kontrollierten, doppelblinden, 6-monatigen klinischen Studie EVOLVE-2 (ClinicalTrials.gov NCT02614196) untersucht. In der EVOLVE-1 erreichten beide Dosen von Galcanezumab (120 und 240 mg) den primären Endpunkt einer signifikanten Reduktion der monatlichen Migräne-Kopfschmerztage von 4,7 bzw. 4,6 Tagen im Vergleich zu den 2,8 Tagen des Placebos (Stauffer et al., 2018). In der EVOLVE-2-Studie erhielten die Patienten eine monatliche Injektion von 120 oder 240 mg Galcanezumab. Die mittleren monatlichen Migräne-Kopfschmerztage wurden um 4,3 bzw. 4,2 Tage reduziert, verglichen mit einer Reduktion um 2,3 Tage unter Placebo (p < 0,001) (Skljarevski et al., 2018). Auch die sekundären Endpunkte der Verringerung der funktionellen Beeinträchtigung, die anhand des R-FR-Scores (Role Function-Restrictive) des Migräne-spezifischen Fragebogens zur Lebensqualität (MSQ) bewertet wurde, sowie die Verbesserung des PGI-S-Scores (Patient Global Impression of Severity) und des MIDAS (Migraine Disability Assessment; Zeitpunkt = Monat 6) wurden erreicht (Skljarevski et al., 2018). 147 (65,0 %) und 163 (71,5 %) der mit Galcanezumab, 120 bzw. 240 mg, und 287 (62,3 %) mit Placebo behandelten Patienten traten unerwünschte Ereignisse auf, darunter ein akuter Myokardinfarkt und eine transitorische ischämische Attacke in einer Gruppe von sieben Patienten unter Behandlung mit Galcanezumab 240 mg (Skljarevski et al., 2018). Es gab keine statistisch signifikanten Unterschiede in der mittleren Veränderung gegenüber dem Ausgangswert für den systolischen/diastolischen Blutdruck. Bei 19 (8,6 %), 11 (5,1 %) bzw. 2 (0,5 %) Patienten in der Galcanezumab 120 mg-, Galcanezumab 240 mg- bzw. Placebogruppe wurden behandlungsbedingte Anti-Drug-Antikörper (ADA) festgestellt. In der Phase-III-Studie REGAIN, in der Galcanezumab gegen chronische Migräne untersucht wurde, wurden die MMDs bei der 120-mg-Dosis um 4,8 Tage und bei der 240-mg-Dosis um 4,6 Tage reduziert, verglichen mit 2,7 Tagen bei Placebo (siehe Yuan et al., 2017). Darüber hinaus konnte gezeigt werden, dass die Behandlung mit Galcanezumab mit einer statistisch signifikanten Persistenz des Effekts ausgestattet war (Forderreuther et al., 2018). Fremanezumab wurde in der Phase-III-Studie HALO zur präventiven Behandlung von Migräne untersucht (ClinicalTrials.gov NCT02638103). Es reduzierte die MMD der episodischen Migräne nach 12 Wochen um 3,7 Tage bei 225 mg monatlich über 3 Monate und um 3,4 Tage bei 675 mg einmal im Quartal im Vergleich zu 2,2 Tagen unter Placebo (siehe Yuan et al., 2017). Die Wirksamkeit von Erenumab bei der Prävention episodischer Migräne wurde in der randomisierten, doppelblinden, placebokontrollierten Phase-3-Studie ARISE (ClinicalTrials.gov NCT02483585) untersucht. Die MMDs wurden durch die monatliche subkutane Gabe von 70 mg Erenumab um 2,9 Tage im Vergleich zu 1,8 Tagen unter Placebo reduziert (p < 0,001) und es war wirksam bei den sekundären Endpunkten einer mindestens 50%igen Reduktion der MMDs und der Veränderung der monatlichen migränespezifischen Medikamentenbehandlungstage (MSMD) (Dodick et al., 2018). Der Anteil der Patienten, bei denen unerwünschte Ereignisse auftraten, war zwischen der mit dem mAb behandelten Gruppe und der Placebogruppe ähnlich; 4,3 % wurden bis Woche 12 positiv auf Anti-Zerenumab-bindende Antikörper getestet, einer von ihnen war vorübergehend positiv auf neutralisierende Antikörper, allerdings nur in Woche 4 (Dodick et al., 2018). Auch die klinische Phase-III-Studie STRIVE (ClinicalTrials.gov NCT02456740) untersuchte die Wirksamkeit von Erenumab zur Prävention von episodischer Migräne. Erenumab wurde in einer Dosierung von 70 oder 140 mg monatlich über 6 Monate verabreicht (Goadsby et al., 2017b). Die durchschnittliche Anzahl der MMDs zu Beginn der Studie betrug 8,3, und die 70-mg- und 140-mg-Dosen reduzierten sie um 3,2 bzw. 3,7 Tage im Vergleich zu 1,8 Tagen unter Placebo (mit p < 0,001 für jede Dosis vs. Placebo) (Goadsby et al., 2017b). Auch in den letzten 3 Monaten der Behandlung erfüllte jede Dosis von Erenumab die sekundären Endpunkte einer mindestens 50-prozentigen Verringerung der mittleren Anzahl von Migränetagen pro Monat gegenüber dem Ausgangswert und einer Verringerung der Alltagsaktivitäten (MPFID-EA) und der körperlichen Beeinträchtigung (MPFID-PI) im Migraine Physical Function Impact Diary (MPFID) gegenüber dem Ausgangswert (Goadsby et al., 2017b). Bei den Patienten mit Anti-erenumab-Antikörpern wurde nur einer in der mit 70 mg behandelten Gruppe positiv auf neutralisierende Antikörper getestet, und das mAb wurde insgesamt gut vertragen, was die Kreatininwerte, die Lebertoxizität, die Gesamtneutrophilenzahl und die elektrokardiographische Funktion betrifft (Goadsby et al., 2017b). Laut den Autoren besteht eine der Grenzen dieser Studie darin, dass Patienten ausgeschlossen wurden, die auf mehr als zwei Klassen von Migränepräventionsmitteln nicht therapeutisch angesprochen hatten (Goadsby et al., 2017b). Darüber hinaus gibt es klinische Studien, die die Wirksamkeit von Fremanezumab (NCT02945046 und NCT02964338) und Galcanezumab (NCT 02397473 und NCT02438826) bei der Vorbeugung von Clusterkopfschmerz untersuchen (siehe Israel et al., 2018), d. h. von primärem Kopfschmerz, der durch starke einseitige Schmerzen im periorbitalen Bereich gekennzeichnet ist, begleitet von Tränenfluss, Bindehautrötung und Rhinorrhoe (Vollesen et al., 2018). Tatsächlich konnte gezeigt werden, dass die kontinuierliche intravenöse Infusion von 1,5 μg/min CGRP über eine Infusionspumpe für 20 Minuten (an zwei Tagen im Abstand von mindestens 7 Tagen) bei Patienten mit episodischem (aktiver oder Remissionsphase) oder chronischem Clusterkopfschmerz clusterartige Attacken bei Patienten in der aktiven Phase oder mit chronischem Clusterkopfschmerz auslöste, nicht jedoch in der Remissionsphase (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). Die wichtigsten PK-Vorteile von mAbs sind die lange Eliminationshalbwertszeit, die die Notwendigkeit einer täglichen Verabreichung begrenzt, und die Clearance durch Proteolyse. Aufgrund der Wirkungen von Giften auf die Leber und der gefäßerweiternden Eigenschaften von CGRP bestehen die am meisten gefürchteten Risiken der Hemmung der CGRP-Signalübertragung in der vermuteten Hepatotoxizität und dem theoretischen kardiovaskulären Risiko (Yuan et al., 2017). Die European Headache Federation (EHF) hat Leitlinien zur Verwendung von Anti-CGRP-MAbs erstellt, die sich an der GRADE-Methode (Grading of Recommendation, Assessment, Development and Evaluation) orientieren und sich, wenn dies nicht möglich ist, auf die Meinung eines Expertengremiums stützen (Sacco et al., 2019).
Pharmakokinetik (PK)/Pharmakodynamik (PD) Beziehung von Anti-Migräne-MAbs
Die Entwicklung von mAbs hat einen völlig neuen Ansatz zur Hemmung des CGRP-Signalwegs dargestellt. Die wichtigste PD-Verbesserung, die durch die Verwendung von mAbs anstelle von kleinen Molekülen erzielt wird, besteht darin, dass es einfacher ist, die breite CGRP-Rezeptor-Liganden-Bindungsstelle anzuvisieren (Taylor, 2018). Die wichtigsten PK-Vorteile von mAbs sind die lange Eliminationshalbwertszeit ohne Notwendigkeit einer täglichen Dosierung und die Clearance durch Proteolyse, und die am meisten gefürchteten Risiken der Hemmung der CGRP-Signalübertragung bestehen in der hypothetischen Hepatotoxizität aufgrund der Auswirkungen von Gepants auf die Leber und dem theoretischen kardiovaskulären Risiko aufgrund der gefäßerweiternden Eigenschaften von CGRP. Auf dem Weg dieser mAbs von ihrer Herstellung bis zum Ziel ist jedoch das erste Hindernis, auf das diese Moleküle stoßen, ihre Verabreichung, da sie oral nur begrenzt verfügbar sind. Daher ist ein parenteraler Verabreichungsweg erforderlich, und um die Therapietreue zu fördern, muss die Halbwertszeit lang sein (Taylor, 2018). Immunglobuline (Ig)G1, 2 oder 4 sind die Möglichkeiten (Wang et al., 2008; Taylor, 2018). Abgesehen von der Herkunft des IgG können eine mögliche Kreuzreaktivität und individuelle Modifikationen des Katabolismus die Halbwertszeit beeinflussen (Bonilla, 2008; Taylor, 2018). Die Technologie zur Herstellung von mAbs beruht auf der Verwendung von Hybridomen, die aus sich ständig teilenden Zellen bestehen, die bestimmte Klone eines einzigen Antikörpertyps mit keiner oder geringer Variabilität produzieren (Taylor, 2018). Basierend auf der Herkunft der Aminosäuren, aus denen der mAb besteht, kann man zwischen chimären (Nagetier-Immunisierung; Beibehaltung des Nagetier-Fragments der Antigen-bindenden Region Fab, aber Einführung des menschlichen Fragments der kristallisierbaren Region Fc), humanisierten (Zumabs, mit Maus Complementarity Determining Regions, CDRs, die auf menschliche Fab-Regionen aufgepfropft werden) und humanen (Einführung der gesamten Sequenz des menschlichen Antikörper-Gens in die Maus, die dadurch humanisiert wird, wie zum Beispiel die XenoMouse) mAbs unterscheiden (siehe Taylor, 2018). Die CDRs beeinflussen die Anpassung an das Ziel. Von den 4 mAbs gegen Migräne ist nur Erenumab human, während die aufgepfropften CDRs bei Fremanezumab von der Maus, bei Eptinezumab vom Kaninchen und bei Galcanezumab wahrscheinlich von der Maus stammen (siehe Taylor, 2018). Insbesondere ist das einzige Anti-CGRP-Rezeptor-MAb Erenumab, ein humanes IgG2λ, und die anderen drei mAbs, die gegen CGRP-Stellen gerichtet sind, sind: Eptinezumab, ein gentechnisch hergestelltes humanisiertes IgG1k; Fremanezumab, ein humanisiertes IgG2k; Galcanezumab, ein humanisiertes IgG4 (Edvinsson et al., 2018). Erenumab (Tmax 3-14 Tage) muss monatlich subkutan verabreicht werden, ebenso wie Fremanezumab (Tmax 3-20 Tage) und Galcanezumab (Tmax 7-14 Tage) (Taylor, 2018). Im Gegensatz dazu wird Eptinezumab (Tmax 4,8 h) einmal alle drei Monate intravenös verabreicht; es assoziiert schneller und dissoziiert langsamer als Fremanezumab und Galcanezumab. Da mAbs große Proteine sind, können sie die BHS nicht ohne weiteres passieren. Einige CGRP-Rezeptoren befinden sich außerhalb der BHS und ermöglichen so die Wirkung von Anti-CGRP-MAbs (Edvinsson, 2018). Vor der Bindung gelangt der Antikörper über Pinozytose in vaskuläre Endothelzellen. Große scheinbare Verteilungsvolumina könnten vom Gewebe und der damit verbundenen Bindungsfähigkeit des mAbs abhängen (Lobo et al., 2004; Taylor, 2018). Erenumab ist der neuartigste Ansatz, da es als einziges ein Fusionsprotein der extrazellulären Domänen des humanen G-Protein-gekoppelten Rezeptors Calcitonin-Rezeptor-ähnlicher Rezeptor CALCRL (erforderlich in den Rezeptoren für CGRP und Adrenomedullin) und RAMP1 einschließlich der CGRP-Bindungstasche anvisiert (Edvinsson et al., 2018). Es wurde nachgewiesen, dass es die Bindung von -CGRP an den menschlichen CGRP-Rezeptor in menschlichen Neuroblastomzellen (SK-N-MC) mit einem Ki von 0,02 ± 0,01 nM kompetitiv hemmt (Shi et al., 2016). Erenumab bewirkte einen starken und vollständigen Antagonismus der CGRP-stimulierten cAMP-Akkumulation mit einer IC50 von 2,3 ± 0,9 nM in funktionellen Assays, die in SK-N-MC durchgeführt wurden (Shi et al., 2016). Darüber hinaus war Fremanezumab 5000-fach selektiver für den CGRP-Rezeptor und zeigte bis zur höchsten getesteten Konzentration von 10 μM keine agonistische/antagonistische Wirkung auf andere Rezeptoren der menschlichen Calcitonin-Familie, einschließlich Adrenomedullin-, Calcitonin- und Amylin-Rezeptoren (Shi et al., 2016). Fremanezumab könnte seine Wirkung auf verschiedene Gefäße ausüben; tatsächlich bewirkt es eine konzentrationsabhängige Hemmung der CGRP-induzierten Vasodilatation in vorkontrahierten menschlichen zerebralen, meningealen und peripheren Baucharterien (Ohlsson et al., 2018). Darüber hinaus kann CGRP auch auf Neuronen und Gliazellen sowie auf das glymphatische (lymphatische) System wirken, wobei letzteres an der Ausprägung der Aura beteiligt ist (siehe Messlinger, 2018). Das wahrscheinliche Fehlen eines Metabolismus durch Leberenzyme könnte Wechselwirkungen mit anderen Medikamenten vermeiden. Die Eliminierung erfolgt durch renale Proteolyse von Aminosäuren. Obwohl klinische Studien berichten, dass diese Antikörper insgesamt gut vertragen werden, abgesehen von den hervorgehobenen Schmerzen an der Injektionsstelle, gibt es Bedenken hinsichtlich ihrer Immunogenität durch die Produktion von ADA (Taylor, 2018). In einer doppelblinden, randomisierten, placebokontrollierten klinischen Studie (ClinicalTrials.gov NCT 01337596), in der die Behandlung mit verschiedenen Schemata von Einzel- und Mehrfachdosen von Galcanezumab untersucht wurde, wiesen 11 der behandelten Patienten (26 %) niedrige Titer (1:10 – 1:80) von behandlungsbedingten ADA auf (bei 3 Patienten stiegen die vorbestehenden Antikörper im Titer an), ohne dass eine Dosis-Wirkung und Auswirkungen auf PK und PD festgestellt wurden (Monteith et al., 2017). Die Untersuchung der Immunogenität ist von wesentlicher Bedeutung, da das Vorhandensein von ADA den Abbau des Medikaments beschleunigen oder, schlimmer noch, Endorganschäden begünstigen kann (Taylor, 2018). Die wichtigsten Merkmale der Anti-Migräne-MAbs sind in Tabelle 1 zusammengefasst.

Table 1. Hauptmerkmale von Fremanezumab, Eptinezumab, Galcanezumab und Erenumab.
Schlussfolgerung
Migräne ist eine behindernde und schwächende neurovaskuläre schmerzhafte Erkrankung, die mehr als 90 % der Fälle von wiederkehrenden Kopfschmerzen ausmacht und zu der die Neigung vererbt werden kann (MacGregor, 2017). Divalproex-Natrium, Natriumvalproat, Topiramat, Metoprolol, Propranolol und Timolol haben eine starke Evidenz (Stufe A) für die Migräneprävention gezeigt (American Academy of Neurology und American Headache Society, 2015). Alle klassischen oralen Präventivbehandlungen, einschließlich trizyklischer Antidepressiva, Betablocker, 5-HT2-Antagonisten, Ergot und Antiepileptika, wurden jedoch nicht für Migräne entwickelt und führen nur bei 45 % der Migränepatienten zu einer 50-prozentigen Verringerung der Anzahl der monatlichen Migräneschmerztage (D’Amico und Tepper, 2008), auch wegen der geringen Adhärenz aufgrund der schlechten Verträglichkeit. Die Persistenz und das Absetzen von Medikamenten wurde in einer retrospektiven US-Schadenanalyse untersucht (Hepp et al., 2017), und die Ergebnisse deuten auf eine geringe Persistenz gegenüber dem ursprünglich verwendeten Medikament und eine hohe Absetzrate nach 6 Monaten hin, unabhängig von der Medikamentenklasse. Aufgrund der grundlegenden Rolle von CGRP bei der Aufrechterhaltung der Neuroinflammation und der zentralen Sensibilisierung im Signalweg vom Trigeminalganglion und dem Hirnstamm zu höheren Regionen, die an der Physiopathologie der Migräne beteiligt sind, wurden neue mAbs gegen CGRP und seinen Rezeptor entwickelt. Die ersten niedermolekularen CGRP-Antagonisten zeigten eine Lebertoxizität, aber die mAbs produzierten weder toxische Metaboliten noch kardiovaskuläre Nebenwirkungen aufgrund der Hemmung der Vasodilatation (siehe Deen et al., 2017). Auch zentrale Nebenwirkungen wurden nicht hervorgehoben. Die potenziellen Langzeitwirkungen der CGRP-Blockade müssen noch untersucht werden, aber ein grundlegender Vorteil dieser Antikörper liegt in ihrer langen Halbwertszeit, die monatliche oder weniger häufige Injektionen ermöglicht, was die Therapietreue und die anschließende Wirksamkeit deutlich verbessern kann (Deen et al., 2017). Somit könnten Anti-CGRP-MAbs wirksame Instrumente im therapeutischen Arsenal gegen nicht ansprechende Migräne darstellen; allerdings ist eine gründliche Überwachung der Wirksamkeit und Sicherheit (d. h. Produktion toxischer Metaboliten, Immunogenität mit ADA, neutralisierenden Antikörpern und Gewebe-Kreuzreaktivität sowie Nebenwirkungen) unerlässlich (Taylor, 2018). Tatsächlich zeigen Belege aus älteren Biotech-Produkten, dass bei Therapien mit mAbs gegen den Tumornekrosefaktor α (TNFα) ein sekundäres Versagen (im Gegensatz zu primären Non-Respondern) des anfänglichen therapeutischen Ansprechens auftreten kann, da diese Arzneimittel die Produktion von Antikörpern induzieren, die den mAb abbauen, aber auch seine Wirkung neutralisieren können, bevor er an das Ziel bindet (siehe Prado et al., 2017). Die Immunogenität kann durch die Glykosylierung, den Typ des mAb, die Anzahl der Epitope und Verunreinigungen in der Formulierung beeinflusst werden (siehe Prado et al., 2017). Darüber hinaus werden mehrere scheinbar unerklärliche schwere Nebenwirkungen mit der Immunogenität von Anti-TNFα in Verbindung gebracht. Lokale und systemische Überempfindlichkeitsreaktionen, Immunschwäche mit erhöhter Anfälligkeit für Infektionen und Immunkomplexbildung, die sogar zum Tod führen kann, wurden hervorgehoben (siehe Prado et al., 2017). Daher kann der Einsatz von therapeutischer Diagnostik (Theranostik) das Wissen und den richtigen Umgang mit diesen pharmakologischen Mitteln verbessern (Bendtzen, 2013; Prado et al., 2017).
Autorenbeiträge
MTC, LAM, PT und GB konzipierten die Studie. DS sammelte die Studienergebnisse, analysierte die Literatur und schrieb das Manuskript. AA, LR und MN beteiligten sich an der Literaturrecherche. Alle Autoren haben das endgültige Manuskript gelesen und genehmigt.
Conflict of Interest Statement
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
American Academy of Neurology and American Headache Society (2015). Anhang a: Zusammenfassung der evidenzbasierten Leitlinie für Kliniker, Update: pharmakologische Behandlung zur Prävention von episodischer Migräne bei Erwachsenen. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Personalisierte Medizin: Theranostik (therapeutische Diagnostik) als Voraussetzung für den rationalen Einsatz von Tumornekrosefaktor-alpha-Antagonisten. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Pharmakokinetik von intravenös oder subkutan verabreichtem Immunglobulin. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Globale, regionale und nationale Belastung durch Migräne und Kopfschmerzen vom Spannungstyp, 1990-2016: eine systematische Analyse für die Global Burden of Disease Study 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Prophylaxe der Migräne: allgemeine Prinzipien und Patientenakzeptanz. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Die Blockierung von CGRP bei Migränepatienten – ein Überblick über die Vor- und Nachteile. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: eine randomisierte Phase-3-Studie zu Erenumab bei episodischer Migräne. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Extrakranielle Gefäßveränderungen und die Schmerzquelle bei Migränekopfschmerz. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., and Porreca, F. (2014). Zielgerichtete TRP-Kanäle für neue Migränetherapeutika. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). CGRP-Rezeptor-Antagonisten und Antikörper gegen CGRP und seinen Rezeptor in der Migränebehandlung. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract |Ref Full Text | Google Scholar
Edvinsson, L. (2018). Der CGRP-Signalweg bei Migräne als mögliches Ziel für Therapien. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). CGRP als Ziel von neuen Migränetherapien – erfolgreiche Umsetzung von der Forschung in die Klinik. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., and Edvinsson, L. (2013). Differenzierung von Nervenfasern, die CGRP und CGRP-Rezeptoren im peripheren trigeminovaskulären System speichern. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., and Premkumar, L. S. (2012). Sumatriptan hemmt TRPV1-Kanäle in Trigeminusneuronen. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., and Goadsby, P. J. (2001). Orale Triptane (Serotonin-5-HT(1B/1D)-Agonisten) in der akuten Migränebehandlung: eine Meta-Analyse von 53 Studien. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Die präventive Wirkung von Galcanezumab bei erwachsenen Patienten mit episodischer oder chronischer Migräne ist anhaltend: Daten aus den randomisierten, doppelblinden, placebokontrollierten Phase-3-Studien EVOLVE-1, EVOLVE-2 und REGAIN. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). Calcitonin gene-related peptide receptor as a novel target for the management of people with episodic migraine: current evidence and safety profile of erenumab. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). Emerging drugs for migraine treatment. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Die Freisetzung vasoaktiver Peptide im extrazerebralen Kreislauf des Menschen während Migränekopfschmerzen. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). Pathophysiologie der Migräne: eine Störung der sensorischen Verarbeitung. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). A controlled trial of erenumab for episodic migraine. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Persistenz und Wechselmuster von oralen Migräneprophylaxe-Medikamenten bei Patienten mit chronischer Migräne: eine retrospektive Leistungsanalyse. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomisierte, kontrollierte Studie von Telcagepant bei Patienten mit Migräne und koronarer Herzkrankheit. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). Monoklonale CGRP-Antikörper für die präventive Behandlung von Migräne. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). Neu aufkommende Medikamente zur Migränebehandlung: ein Update. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002). CGRP kann eine ursächliche Rolle bei Migräne spielen. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Pharmakokinetik und Pharmakodynamik von Antikörpern. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migraine. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). Die Anwendung von monoklonalen CGRP(r)-Antikörpern im Migränespektrum: Bedürfnisse und Prioritäten. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Die große CGRP-Flut – Quellen, Senken und Signalorte im trigeminovaskulären System. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik des CGRP-bindenden monoklonalen Antikörpers LY2951742 (Galcanezumab) bei gesunden Freiwilligen. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). Fremanezumab blockiert CGRP-induzierte Dilatation in menschlichen zerebralen, mittleren meningealen und abdominalen Arterien. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Biologische Anti-TNF-Medikamente: Immunogenität als Grundlage für Behandlungsversagen und unerwünschte Ereignisse. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Calcitonin gene-related peptide: Physiologie und Pathophysiologie. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Leitlinie der Europäischen Kopfschmerzföderation zur Verwendung von monoklonalen Antikörpern, die auf das Calcitonin-Gen-verwandte Peptid oder dessen Rezeptor wirken, zur Migräneprävention. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primäre Ergebnisse der PROMISE-1 (prevention of migraine via intravenous eptinezumab safety and efficacy-1) trial: a phase 3, randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of eptinezumab for prevention of frequent episodic migraines (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Pharmakologische Charakterisierung von AMG 334, einem potenten und selektiven humanen monoklonalen Antikörper gegen den Calcitonin-Gen-verwandten Peptidrezeptor. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). Wirksamkeit und Sicherheit von Galcanezumab zur Prävention von episodischer Migräne: Ergebnisse der randomisierten kontrollierten klinischen Phase-3-Studie EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). Evaluierung von Galcanezumab zur Prävention von episodischer Migräne: die randomisierte klinische Studie EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). Migräne ist die Hauptursache für Behinderungen bei unter 50-Jährigen: werden die Gesundheitspolitiker jetzt aufhorchen? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, Amylin, Immunologie und Kopfschmerzmedizin. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migräne-Biomarker im Liquor: eine systematische Überprüfung und Meta-Analyse. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Wirkung der Infusion von Calcitonin Gene-Related Peptide auf Clusterkopfschmerzattacken: eine randomisierte klinische Studie. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). Regulierung der Signaltransduktion durch Calcitonin-Gen-verwandte Peptidrezeptoren. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Pharmakokinetik und Pharmakodynamik von monoklonalen Antikörpern. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogene Neuroinflammation: entzündliche ZNS-Reaktionen als Reaktion auf neuronale Aktivität. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). CGRP monoclonal antibodies for migraine: rationale und Fortschritte. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar