
Tragen Sie hier Ihre Beispiele ein.
- 9.1 Signalmoleküle und Zellrezeptoren
- 9.2 Ausbreitung des Signals
- 9.3 Antwort auf das Signal
Stellen Sie sich vor, wie das Leben wäre, wenn Sie und die Menschen um Sie herum nicht kommunizieren könnten. Du könntest anderen weder deine Wünsche mitteilen, noch könntest du Fragen stellen, um mehr über deine Umgebung zu erfahren. Die soziale Organisation hängt von der Kommunikation zwischen den Individuen ab, die diese Gesellschaft bilden.
Wie bei den Menschen ist es für die einzelnen Zellen lebenswichtig, dass sie mit ihrer Umgebung und untereinander interagieren können. Dies gilt unabhängig davon, ob eine Zelle allein in einem Teich wächst oder eine von vielen Zellen ist, die einen größeren Organismus bilden. Um angemessen auf äußere Reize reagieren zu können, haben die Zellen komplexe Kommunikationsmechanismen entwickelt, damit sie eine Nachricht empfangen, die Informationen über die Plasmamembran übertragen und dann als Reaktion auf die Nachricht Veränderungen innerhalb der Zelle bewirken können.
In mehrzelligen Organismen senden und empfangen die Zellen ständig chemische Nachrichten, um die Aktionen anderer Organe, Gewebe und Zellen zu koordinieren. Die Fähigkeit, Nachrichten schnell und effizient zu senden, ermöglicht es den Zellen, ihre Funktionen zu koordinieren und fein abzustimmen. Während die Notwendigkeit der zellulären Kommunikation in größeren Organismen offensichtlich ist, kommunizieren auch Einzeller miteinander. Hefezellen signalisieren sich gegenseitig, um die Paarung zu unterstützen. Einige Bakterienarten koordinieren ihre Handlungen, um große Komplexe zu bilden, die Biofilme genannt werden, oder um die Produktion von Toxinen zu organisieren, um konkurrierende Organismen zu beseitigen. Die Fähigkeit der Zellen, durch chemische Signale zu kommunizieren, hat ihren Ursprung in Einzelzellen und war für die Evolution der mehrzelligen Organismen von entscheidender Bedeutung. Effiziente, fehlerfreie Kommunikation ist für alles Leben unerlässlich.
- 9.1 | Signalmoleküle und zelluläre Rezeptoren
- 9.1.1 Formen der Signaltransduktion
- Parakrine Signalübertragung
- Autokrine Signalgebung
- Endokrine Signalgebung
- Direkte Signalübertragung
- 9.1.2 Arten von Rezeptoren
- Interne Rezeptoren
- Zelloberflächenrezeptoren
- 9.1.3 Signalmoleküle
- Kleine hydrophobe Liganden
- Wasserlösliche Liganden
- 9.2 | Ausbreitung des Signals
- 9.2.1 Signalwege und Signalverstärkung
- 9.2.2 Methoden der intrazellulären Signalübertragung
- Phosphorylierung
- Second Messengers
- 9.3 | Antwort auf das Signal
- 9.3.1 Reaktionen auf den Signalweg
- Genexpression
- Erhöhung des zellulären Stoffwechsels
- Zellwachstum
- Zelltod
- 9.3.2 Beendigung von Signalwegen
9.1 | Signalmoleküle und zelluläre Rezeptoren
Am Ende dieses Abschnitts werden Sie in der Lage sein:
- Beschreiben Sie vier Arten von Signalen, die in vielzelligen Organismen vorkommen.
- Vergleiche interne Rezeptoren mit Zelloberflächenrezeptoren.
- Erkenne die Beziehung zwischen der Chemie eines Liganden und seinem Wirkmechanismus.
In der Welt der lebenden Zellen gibt es zwei Arten der Kommunikation. Die Kommunikation zwischen Zellen wird als interzelluläre Signalübertragung bezeichnet, die Kommunikation innerhalb einer Zelle als intrazelluläre Signalübertragung. Die Unterscheidung lässt sich leicht merken, wenn man sich vergegenwärtigt, dass die Vorsilbe inter- für „zwischen“ steht (eine Autobahn führt durch mehrere Staaten) und intra- für „innerhalb“ (eine Infusion bedeutet intravenös oder „innerhalb der Vene“).
Chemische Signale werden von einer Signalzelle abgegeben und von einer Zielzelle empfangen. Die Zielzellen haben Proteine, die Rezeptoren genannt werden, die an die Signalmoleküle binden und eine Reaktion auslösen. Signalmoleküle, die an Rezeptoren binden, werden Liganden genannt. Liganden und Rezeptoren sind füreinander spezifisch; ein Rezeptor bindet normalerweise nur an seinen spezifischen Liganden. Es gibt jedoch verschiedene Arten von Signaltransduktion.
9.1.1 Formen der Signaltransduktion
Es gibt vier Kategorien von chemischer Signaltransduktion, die in multizellulären Organismen vorkommen: autokrine Signaltransduktion, parakrine Signaltransduktion, endokrine Signaltransduktion und direkte Signaltransduktion über Gap Junctions (Abbildung 9.2). Der Hauptunterschied zwischen den verschiedenen Signalkategorien ist die Entfernung, die das Signal zurücklegt, um die Zielzelle zu erreichen.
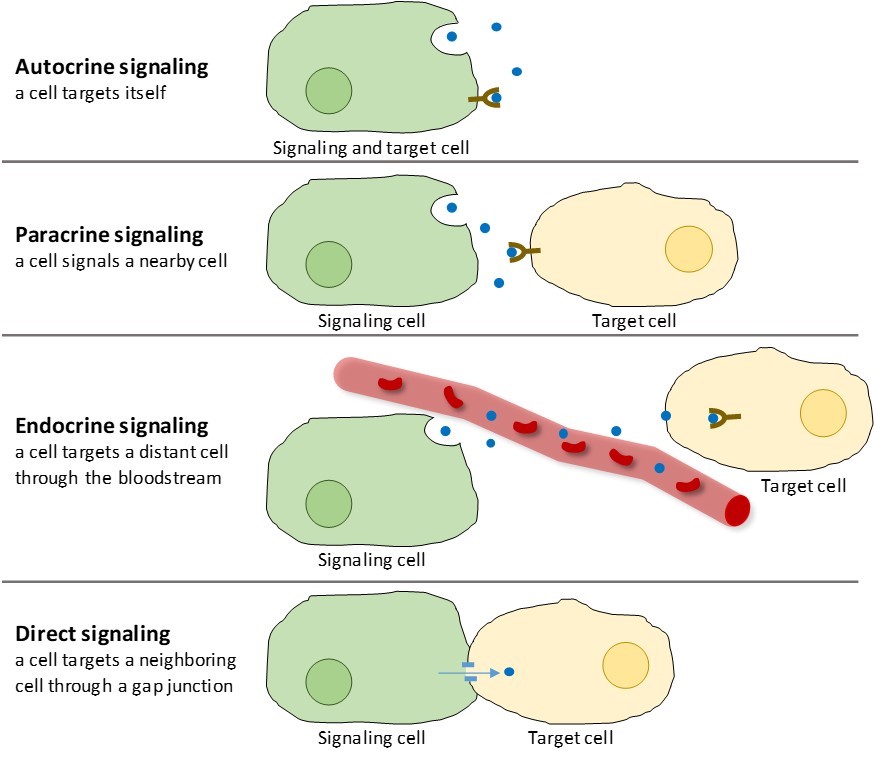
Parakrine Signalübertragung
Signale, die lokal zwischen nahe beieinander liegenden Zellen wirken, werden als parakrine Signale bezeichnet. Parakrine Signale bewegen sich durch Diffusion durch die extrazelluläre Matrix (Abbildung 9.2). Diese Art von Signalen löst in der Regel schnelle Reaktionen aus, die nur kurze Zeit anhalten. Um die Reaktion lokal zu halten, werden parakrine Liganden normalerweise schnell durch Enzyme abgebaut oder von benachbarten Zellen entfernt. Durch die Entfernung der Signale wird der Konzentrationsgradient für das Signalmolekül wiederhergestellt, so dass es bei erneuter Freisetzung schnell durch den intrazellulären Raum diffundieren kann.
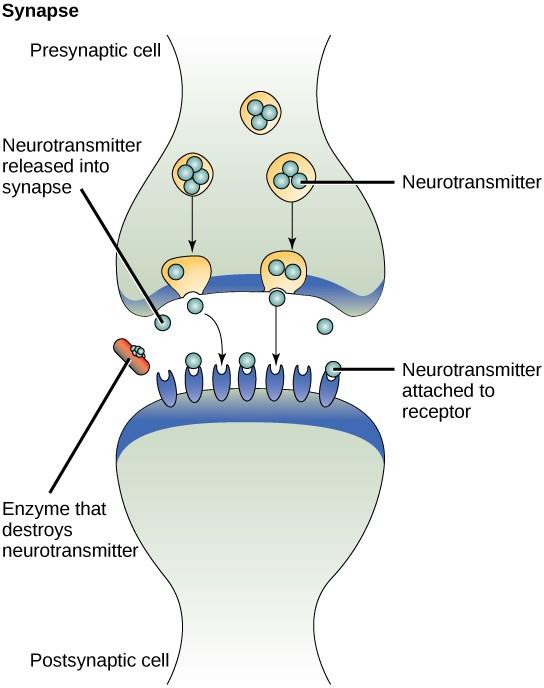
Ein Beispiel für parakrine Signalübertragung ist die Übertragung von Signalen zwischen Nervenzellen. Der winzige Raum zwischen Nervenzellen, in dem die Signalübertragung stattfindet, wird Synapse genannt. Die Signale werden durch schnelle elektrische Impulse entlang der Nervenzellen weitergeleitet. Wenn diese Impulse das Ende einer Nervenzelle erreichen, werden von der präsynaptischen Zelle (der Zelle, die das Signal sendet) chemische Liganden, so genannte Neurotransmitter, in die Synapse abgegeben. Die Neurotransmitter diffundieren durch die Synapse (Abbildung 9.3). Durch den geringen Abstand zwischen den Nervenzellen kann sich das Signal schnell ausbreiten, was eine sofortige Reaktion ermöglicht, z. B. „Nimm die Hand vom Herd!“. Wenn der Neurotransmitter an den Rezeptor auf der Oberfläche der postsynaptischen Zelle bindet, wird der nächste elektrische Impuls ausgelöst. Die Neurotransmitter werden schnell abgebaut oder von der präsynaptischen Zelle wieder aufgenommen, so dass sich die empfangende Nervenzelle schnell erholen kann und darauf vorbereitet ist, schnell auf das nächste synaptische Signal zu reagieren.
Autokrine Signalgebung
Wenn eine Zelle auf ihr eigenes Signalmolekül reagiert, nennt man dies autokrine Signalgebung (auto = „selbst“). Autokrine Signalgebung tritt oft zusammen mit anderen Arten der Signalgebung auf. Wenn zum Beispiel ein parakrines Signal freigesetzt wird, kann die signalgebende Zelle zusammen mit ihren Nachbarn auf das Signal reagieren (Abbildung 9.2).
Autokrine Signalgebung tritt oft während der frühen Entwicklung eines Organismus auf, um sicherzustellen, dass sich die Zellen zu den richtigen Geweben entwickeln. Autokrine Signalübertragung reguliert auch das Schmerzempfinden und Entzündungsreaktionen. Wenn eine Zelle mit einem Virus infiziert ist, kann sie sich selbst signalisieren, den programmierten Zelltod einzuleiten und dabei das Virus abzutöten.
Endokrine Signalgebung
Signale von entfernten Zellen werden als endokrine Signale bezeichnet und stammen von endokrinen Zellen. (Im Körper befinden sich viele endokrine Zellen in endokrinen Drüsen, wie der Schilddrüse, dem Hypothalamus und der Hypophyse.) Diese Arten von Signalen führen in der Regel zu einer langsameren Reaktion, haben aber eine länger anhaltende Wirkung. Die Liganden, die bei der endokrinen Signalgebung freigesetzt werden, werden Hormone genannt, Signalmoleküle, die in einem Teil des Körpers produziert werden, sich aber auf andere, weiter entfernte Körperregionen auswirken (Abbildung 9.2).
Hormone legen die großen Entfernungen zwischen den endokrinen Zellen und ihren Zielzellen über den Blutkreislauf zurück, was ein relativ langsamer Weg ist, um sich durch den Körper zu bewegen. Aufgrund dieser Transportform werden Hormone verdünnt und liegen in geringen Konzentrationen vor, wenn sie auf ihre Zielzellen wirken. Dies unterscheidet sich von der parakrinen Signalübertragung, bei der die lokalen Konzentrationen von Signalmolekülen sehr hoch sein können.
Direkte Signalübertragung
Gap Junctions bei Tieren und Plasmodesmata bei Pflanzen sind Verbindungen zwischen den Plasmamembranen benachbarter Zellen. Durch diese wassergefüllten Kanäle können kleine Signalmoleküle zwischen den beiden Zellen diffundieren. Kleine Moleküle, wie Kalziumionen (Ca2+), können sich zwischen den Zellen bewegen, aber große Moleküle wie Proteine und DNA passen nicht durch die Kanäle. Die Spezifität der Kanäle sorgt dafür, dass die Zellen unabhängig bleiben, aber schnell und einfach Signale übertragen können. Die direkte Signalübertragung ermöglicht es einer Gruppe von Zellen, ihre Reaktion auf ein Signal zu koordinieren, das möglicherweise nur eine von ihnen erhalten hat. In Pflanzen sind Plasmodesmata allgegenwärtig und machen die gesamte Pflanze zu einem riesigen Kommunikationsnetz.
9.1.2 Arten von Rezeptoren
Rezeptoren sind Proteinmoleküle in der Zielzelle oder auf ihrer Oberfläche, die an Liganden binden. Es gibt zwei Arten von Rezeptoren, interne Rezeptoren und Zelloberflächenrezeptoren.
Interne Rezeptoren
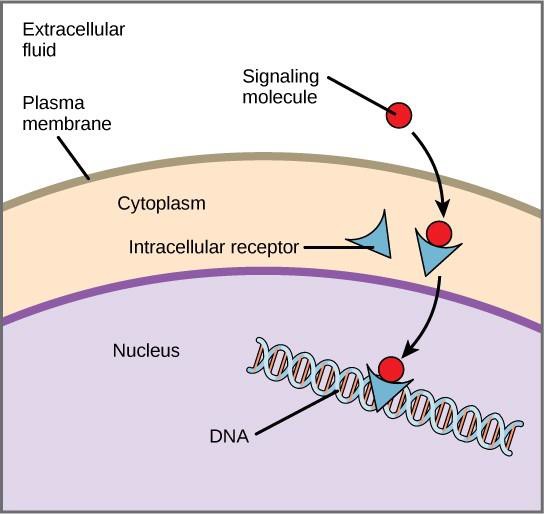
Interne Rezeptoren, die auch als intrazelluläre oder zytoplasmatische Rezeptoren bezeichnet werden, befinden sich im Zytoplasma der Zielzellen und reagieren auf hydrophobe Ligandenmoleküle, die die Plasmamembran passieren können. Sobald sie in der Zelle sind, binden viele dieser Moleküle an Proteine, die als Regulatoren der mRNA-Synthese (Transkription) fungieren, um die Genexpression zu vermitteln.
Genexpression ist der zelluläre Prozess, bei dem die Informationen in der DNA einer Zelle in eine Sequenz von Aminosäuren umgewandelt werden, die schließlich ein Protein bilden. Wenn der Ligand an den internen Rezeptor bindet, wird eine Konformationsänderung ausgelöst, die eine DNA-Bindungsstelle auf dem Rezeptorprotein freilegt. Der Ligand-Rezeptor-Komplex wandert in den Zellkern, bindet dann an bestimmte regulatorische Regionen der chromosomalen DNA und fördert die Einleitung der Transkription (Abbildung 9.4). Die Transkription ist der Prozess des Kopierens der Informationen in der DNA einer Zelle in eine spezielle Form von RNA, die so genannte Boten-RNA (mRNA); die Zelle verwendet die Informationen in der mRNA, um bestimmte Aminosäuren in der richtigen Reihenfolge zu verknüpfen und so ein Protein zu produzieren. Wenn also ein Ligand an einen internen Rezeptor bindet, kann er die Genexpression in der Zielzelle direkt beeinflussen.
Zelloberflächenrezeptoren
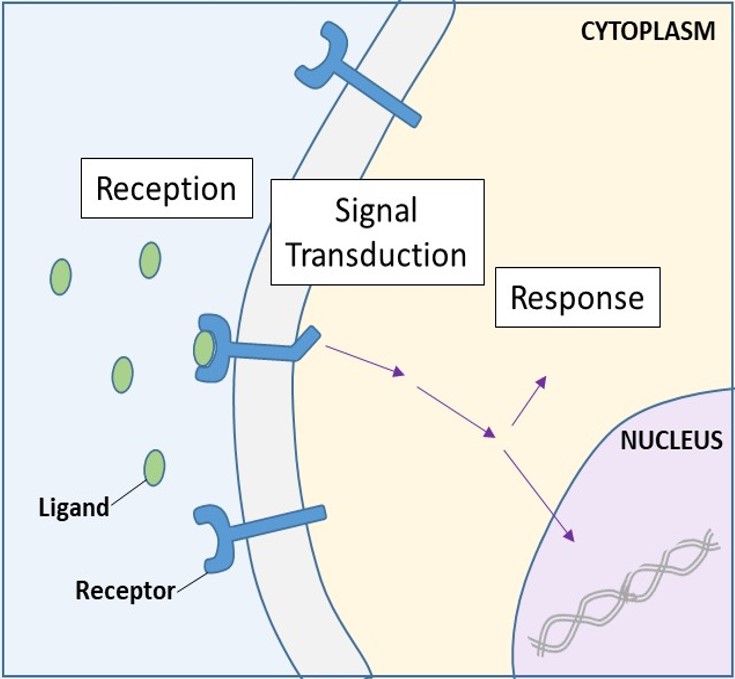
Zelloberflächenrezeptoren, auch als Transmembranrezeptoren bezeichnet, sind integrale Proteine, die an externe Signalmoleküle binden. Diese Rezeptoren überspannen die Plasmamembran und führen eine Signaltransduktion durch, bei der ein extrazelluläres Signal in ein interzelluläres Signal umgewandelt wird. (Abbildung 9.5). Da Rezeptorproteine an der Zelloberfläche für das normale Funktionieren der Zelle von grundlegender Bedeutung sind, sollte es nicht überraschen, dass eine Fehlfunktion bei einem dieser Proteine schwerwiegende Folgen haben kann. Fehler in den Proteinstrukturen bestimmter Rezeptormoleküle spielen nachweislich eine Rolle bei Bluthochdruck, Asthma, Herzkrankheiten und Krebs.
Jeder Zelloberflächenrezeptor hat drei Hauptkomponenten: eine externe ligandenbindende Domäne oder extrazelluläre Domäne, eine hydrophobe membranüberspannende Region und eine intrazelluläre Domäne. Zelloberflächenrezeptoren sind an den meisten Signalübertragungen in multizellulären Organismen beteiligt. Es gibt drei allgemeine Kategorien von Zelloberflächenrezeptoren: enzymgekoppelte Rezeptoren, Ionenkanal-gekoppelte Rezeptoren und G-Protein-gekoppelte Rezeptoren.
Enzymgekoppelte Rezeptoren sind Zelloberflächenrezeptoren mit intrazellulären Domänen, die mit einem Enzym assoziiert sind. In einigen Fällen ist die intrazelluläre Domäne des Rezeptors selbst ein Enzym. Andere enzymgekoppelte Rezeptoren haben eine kleine intrazelluläre Domäne, die direkt mit einem Enzym interagiert. Enzymgekoppelte Rezeptoren haben normalerweise große extrazelluläre und intrazelluläre Domänen, aber die membranüberspannende Region besteht aus einer einzigen Alpha-Helix im Peptidstrang.
Wenn ein Ligand an die extrazelluläre Domäne eines enzymgekoppelten Rezeptors bindet, wird ein Signal durch die Membran übertragen und das Enzym aktiviert. Die Aktivierung des Enzyms setzt eine Kette von Ereignissen in der Zelle in Gang, die schließlich zu einer Reaktion führen.
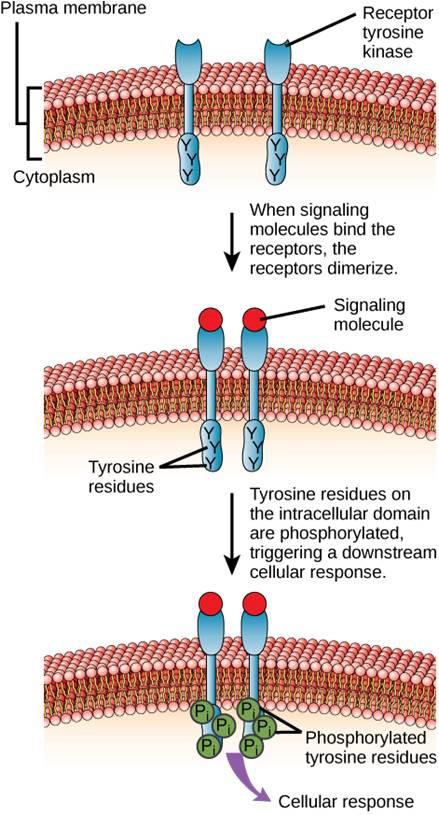
Ein Beispiel für einen enzymgekoppelten Rezeptor ist der Tyrosinkinaserezeptor (Abbildung 9.6). Eine Kinase ist ein Enzym, das Phosphatgruppen von ATP auf ein anderes Protein überträgt. Der Tyrosinkinaserezeptor überträgt Phosphatgruppen auf Tyrosinmoleküle. Zunächst binden Signalmoleküle an die extrazelluläre Domäne von zwei benachbarten Tyrosinkinase-Rezeptoren. Die beiden benachbarten Rezeptoren verbinden sich dann miteinander oder dimerisieren. Anschließend werden Phosphate an Tyrosinreste in der intrazellulären Domäne der Rezeptoren angefügt (Phosphorylierung). Die phosphorylierten Reste können dann das Signal an den nächsten Botenstoff im Zytoplasma weiterleiten.
Epidermale Wachstumsfaktor-Rezeptoren sind ein Beispiel für Rezeptor-Tyrosinkinasen, die diesem Signalisierungsmodus folgen. Defekte in der ErbB-Signalübertragung in dieser Familie können zu neuromuskulären Krankheiten wie Multipler Sklerose und Alzheimer führen.
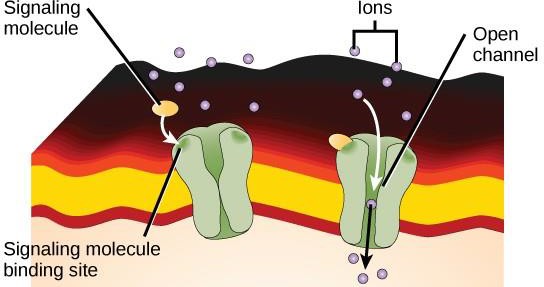
Ionenkanal-verknüpfte Rezeptoren binden an einen Liganden und öffnen einen Kanal durch die Membran, der den Durchgang bestimmter Ionen ermöglicht. Diese Art von Zelloberflächenrezeptoren hat eine ausgedehnte membranumspannende Region mit hydrophoben Aminosäuren. Die Aminosäuren, die das Innere des Kanals auskleiden, sind dagegen hydrophil, um den Durchgang von Ionen zu ermöglichen. Wenn ein Ligand an den extrazellulären Bereich des Kanals bindet, kommt es zu einer Konformationsänderung in der Struktur des Proteins, die den Durchtritt von Ionen wie Natrium, Kalzium, Magnesium oder Wasserstoff ermöglicht (Abbildung 9.7).
G-Protein-verknüpfte Rezeptoren binden an einen Liganden und aktivieren ein assoziiertes G-Protein. Das aktivierte G-Protein interagiert dann mit einem nahe gelegenen Membranprotein, das ein Ionenkanal oder ein Enzym sein kann (Abbildung 9.8). Alle G-Protein-verknüpften Rezeptoren haben sieben Transmembrandomänen, aber jeder Rezeptor hat eine spezifische extrazelluläre Domäne und eine G-Protein-Bindungsstelle.
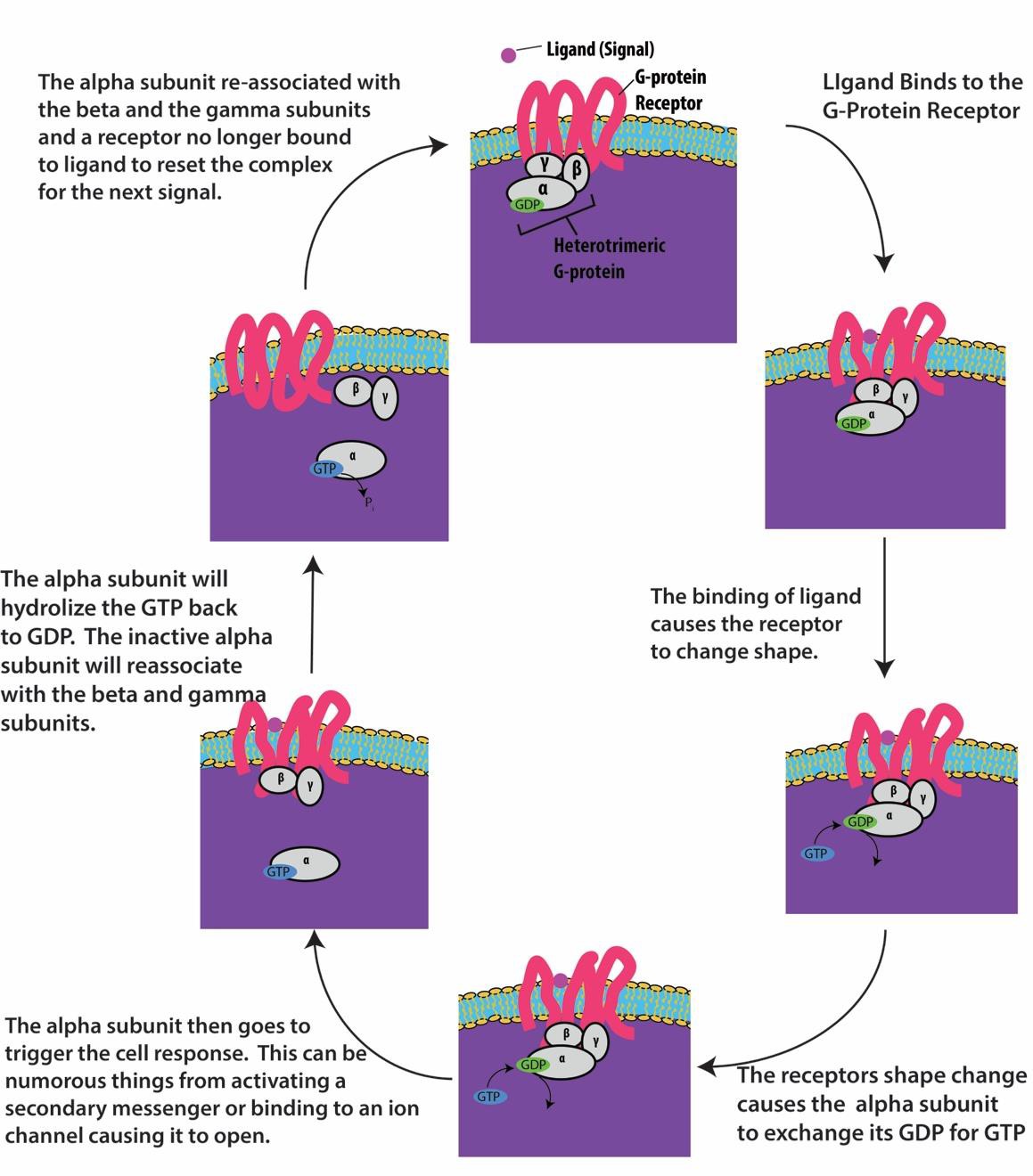
Die Signalübertragung in der Zelle durch G-Protein-verknüpfte Rezeptoren erfolgt in einem Zyklus. Sobald der Ligand an den Rezeptor bindet, aktiviert die daraus resultierende Formveränderung das G-Protein, das GDP freisetzt und GTP aufnimmt. Die Untereinheiten des G-Proteins spalten sich dann in α- und βγ-Untereinheiten. Eines oder beide dieser G-Protein-Fragmente können in der Lage sein, andere Proteine in der Zelle zu aktivieren. Nach einer Weile wird das GTP an der aktiven α-Untereinheit des G-Proteins zu GDP hydrolysiert und die βγ-Untereinheit wird deaktiviert. Die Untereinheiten assoziieren wieder und bilden das inaktive G-Protein, und der Zyklus beginnt von neuem (Abbildung 9.8).
G-Protein-verknüpfte Rezeptoren werden in vielen physiologischen Prozessen verwendet, einschließlich derer für die Sehübertragung, den Geschmack und die Regulierung des Immunsystems und von Entzündungen.

HER2 ist eine Rezeptor-Tyrosin-Kinase. Bei 30 Prozent der menschlichen Brustkrebse ist HER2 dauerhaft aktiviert, was zu einer unregulierten Zellteilung führt. Lapatinib, ein Medikament zur Behandlung von Brustkrebs, hemmt den Prozess, durch den sich der Rezeptor selbst phosphoryliert, und reduziert so das Tumorwachstum um 50 Prozent. Welche der folgenden Schritte würde Lapatinib hemmen?
- Signalmolekülbindung, Dimerisierung und die nachgeschaltete zelluläre Antwort
- Dimerisierung und die nachgeschaltete zelluläre Antwort
- Die nachgeschaltete zelluläre Antwort
- Phosphataseaktivität, Dimerisierung und die nachgeschaltete zelluläre Antwort
9.1.3 Signalmoleküle
Liganden, die von signalgebenden Zellen produziert werden, sind chemische Signale, die zu den Zielzellen gelangen und eine Reaktion hervorrufen. Die Arten von Molekülen, die als Liganden dienen, sind unglaublich vielfältig und reichen von kleinen Proteinen bis zu kleinen Ionen. Liganden werden entweder als kleine hydrophobe Liganden, die Plasmamembranen durchqueren können, oder als wasserlösliche Liganden, die dies nicht können, kategorisiert.
Kleine hydrophobe Liganden
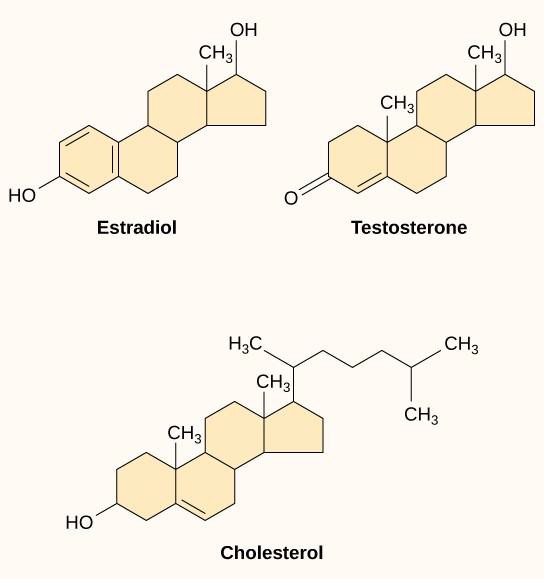
Kleine hydrophobe Liganden, auch lipidlösliche Liganden genannt, können direkt durch die Plasmamembran diffundieren und mit internen Rezeptoren interagieren. Wichtige Vertreter dieser Klasse von Liganden sind die Steroidhormone. Steroide sind Lipide, die ein Kohlenwasserstoffgerüst mit vier verschmolzenen Ringen aufweisen; verschiedene Steroide haben unterschiedliche funktionelle Gruppen, die an das Kohlenstoffgerüst gebunden sind. Zu den Steroidhormonen gehören das weibliche Geschlechtshormon Östradiol, das eine Art Östrogen ist, das männliche Geschlechtshormon Testosteron und Cholesterin, das eine wichtige Strukturkomponente biologischer Membranen und eine Vorstufe der Steroidhormone ist (Abbildung 9.10). Andere hydrophobe Hormone sind Schilddrüsenhormone und Vitamin D. Um im Blut löslich zu sein, müssen hydrophobe Liganden an Trägerproteine binden, während sie durch die Blutbahn transportiert werden.
Wasserlösliche Liganden
Da wasserlösliche Liganden polar sind, können sie die Plasmamembran nicht ohne Hilfe passieren. Manchmal sind sie zu groß, um überhaupt durch die Membran zu gelangen. Stattdessen binden die meisten wasserlöslichen Liganden an die extrazelluläre Domäne von Zelloberflächenrezeptoren (siehe Abbildung 9.5). Diese Gruppe von Liganden ist sehr vielfältig und umfasst kleine Moleküle, Peptide und Proteine.
9.2 | Ausbreitung des Signals
Am Ende dieses Abschnitts werden Sie in der Lage sein:
- zu erklären, wie die Bindung eines Liganden die Signaltransduktion in einer Zelle einleitet.
- Erkennen Sie, dass intrazelluläre Signale durch die Rolle der Phosphorylierung oder der zweiten Botenstoffe übertragen werden.
Wenn ein wasserlöslicher Ligand an seinen Rezeptor bindet, wird das Signal durch die Membran in das Zytoplasma übertragen. Die Fortsetzung eines Signals auf diese Weise wird als Signaltransduktion bezeichnet (Abbildung 9.5). Signaltransduktion findet nur bei Rezeptoren an der Zelloberfläche statt, da interne Rezeptoren in die Zelle eindringen können.
Wenn ein Ligand an seinen Rezeptor bindet, treten Konformationsänderungen auf, die die intrazelluläre Domäne des Rezeptors beeinflussen. Diese Konformationsänderungen führen zu einer Aktivierung der intrazellulären Domäne oder ihrer assoziierten Proteine. In einigen Fällen führt die Bindung des Liganden zur Dimerisierung des Rezeptors, d. h. zwei Rezeptoren binden sich aneinander und bilden einen stabilen Komplex, der als Dimer bezeichnet wird. Ein Dimer ist eine chemische Verbindung, die entsteht, wenn sich zwei (oft identische) Moleküle zusammenschließen. Die Bindung der Rezeptoren auf diese Weise ermöglicht es ihren intrazellulären Domänen, in engen Kontakt zu kommen und sich gegenseitig zu aktivieren.
9.2.1 Signalwege und Signalverstärkung
Obwohl Signalmoleküle oft in sehr geringen Konzentrationen vorkommen, können sie tiefgreifende Wirkungen haben. Nach der Bindung des Liganden an den Zelloberflächenrezeptor setzt die Aktivierung der intrazellulären Komponenten des Rezeptors eine Kette von Ereignissen in Gang, die als Signalweg oder Signalkaskade bezeichnet wird. In einem Signalweg aktivieren Second Messenger, Enzyme und/oder aktivierte Proteine andere Proteine oder Botenstoffe (Abbildung 9.11). Jedes Glied des Signalwegs kann Tausende des nächsten Glieds des Signalwegs in einem Prozess aktivieren, der Signalverstärkung genannt wird. Da das Signal bei jedem Schritt verstärkt wird, kann ein einzelner Rezeptor, der einen Liganden bindet, eine sehr große Reaktion hervorrufen.
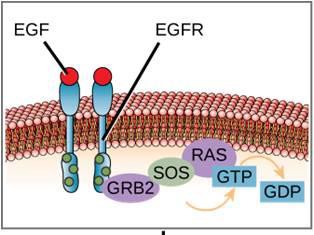
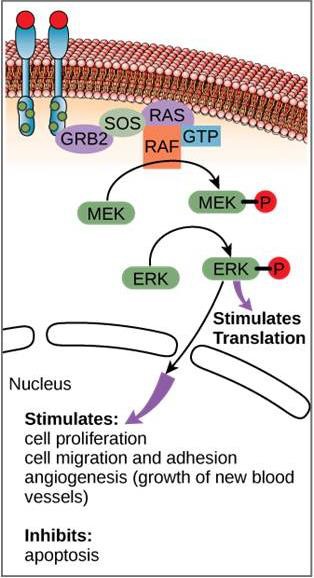
Ein Beispiel für einen Signalweg ist in Abbildung 9.11 dargestellt. Der epidermale Wachstumsfaktor (EGF) ist ein Signalmolekül, das an der Regulierung von Zellwachstum, Wundheilung und Gewebereparatur beteiligt ist. Der Rezeptor für EGF (EGFR) ist eine Tyrosin-Kinase. Eine aktivierte Kinase phosphoryliert und aktiviert viele nachgeschaltete Moleküle. Wenn EGF an den EGFR bindet, signalisiert eine Kaskade nachgeschalteter Phosphorylierungsvorgänge der Zelle, zu wachsen und sich zu teilen. Wenn EGFR zu unpassenden Zeiten aktiviert wird, kann es zu unkontrolliertem Zellwachstum (Krebs) kommen.
Bei bestimmten Krebsarten ist die GTPase-Aktivität des RAS-G-Proteins gehemmt. Das bedeutet, dass das RAS-Protein GTP nicht mehr zu GDP hydrolysieren kann. Welche Auswirkungen hätte dies auf nachgeschaltete zelluläre Ereignisse?
9.2.2 Methoden der intrazellulären Signalübertragung
Die Induktion eines Signalwegs hängt von der Modifikation einer zellulären Komponente durch ein Enzym ab. Es gibt zahlreiche enzymatische Modifikationen, die auftreten können, um die nächste Komponente des Signalwegs zu aktivieren. Im Folgenden werden einige der häufigsten Vorgänge bei der intrazellulären Signalübertragung beschrieben.
Phosphorylierung
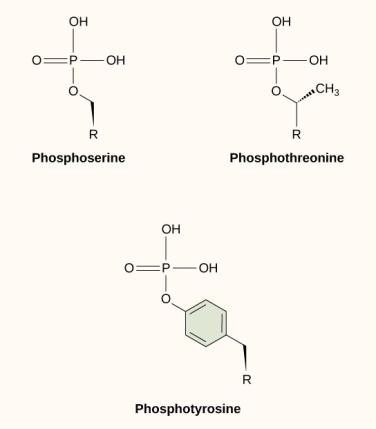
Eine der häufigsten chemischen Modifikationen in Signalwegen ist das Hinzufügen einer Phosphatgruppe zu einem Molekül in einem Prozess, der Phosphorylierung genannt wird. Das Phosphat kann an ein Nukleotid wie GMP angefügt werden, um GDP oder GTP zu bilden. Phosphate werden auch häufig an Serin-, Threonin- und Tyrosinreste von Proteinen angefügt, wo sie die Hydroxylgruppe der Aminosäure ersetzen (Abbildung 9.12). Die Übertragung des Phosphats wird durch ein Enzym, die so genannte Kinase, katalysiert. Die Phosphorylierung kann Enzyme aktivieren oder inaktivieren, und die Umkehrung der Phosphorylierung, die Dephosphorylierung, kehrt die Wirkung um.
Second Messengers
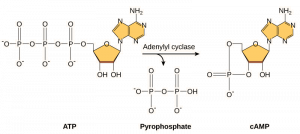
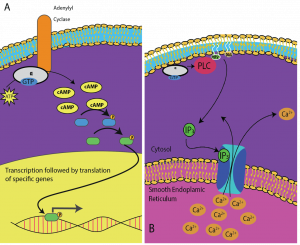
Second messengers sind kleine Moleküle, die ein Signal weiterleiten, nachdem es durch die Bindung des Signalmoleküls an den Rezeptor ausgelöst worden ist. Diese Moleküle tragen dazu bei, ein Signal durch das Zytoplasma zu verbreiten, indem sie das Verhalten bestimmter zellulärer Proteine verändern. Ein zweiter Botenstoff, der von vielen verschiedenen Zelltypen genutzt wird, ist zyklisches AMP (cAMP). Zyklisches AMP wird von dem Enzym Adenylylzyklase aus ATP synthetisiert (Abbildung 9.13). Die Hauptaufgabe von cAMP in Zellen ist die Bindung und Aktivierung eines Enzyms namens cAMP-abhängige Kinase (A-Kinase). Die A-Kinase reguliert viele lebenswichtige Stoffwechselvorgänge: Sie phosphoryliert Serin- und Threoninreste ihrer Zielproteine und aktiviert sie dadurch. A-Kinase kommt in vielen verschiedenen Zelltypen vor, und die Zielproteine sind in jedem Zelltyp unterschiedlich. Ein weiterer sekundärer Botenstoff ist Ca2+, das freigesetzt werden kann, um die Zelle zu überschwemmen.
Die verschiedenen Zellen reagieren unterschiedlich auf cAMP. In Abbildung 9.14 ist die Alpha-Untereinheit eines G-Protein-Rezeptors dargestellt, die zwei verschiedene Arten von Signalen aktiviert. In der ersten Abbildung wird cAMP durch das Enzym Adenylatzyklase produziert, wenn es durch die Alpha-Untereinheit aktiviert wird. cAMP aktiviert dann andere Proteine, die die Gentranskription beeinflussen. Auf dem zweiten Bild löst die Alpha-Untereinheit des G-Proteins eine Kaskade aus, die Ca2+ aus dem glatten endoplasmatischen Retikulum freisetzt. In diesem Fall ist Ca2+ der sekundäre Botenstoff, der die zelluläre Reaktion hervorruft.
9.3 | Antwort auf das Signal
Am Ende dieses Abschnitts werden Sie in der Lage sein:
- zu erkennen, dass Signalwege die Proteinexpression, den Zellstoffwechsel und das Zellwachstum steuern.
- Erkennen Sie die Rolle der Apoptose bei der Entwicklung und Aufrechterhaltung eines gesunden Organismus.
Mit Hilfe von Signaltransduktionswegen erzeugen Rezeptoren in der Plasmamembran eine Vielzahl von Wirkungen in der Zelle. Im Inneren der Zelle binden Liganden an ihre internen Rezeptoren und können so direkt auf die DNA und den Proteinproduktionsapparat der Zelle einwirken. Die Ergebnisse der Signalwege sind äußerst vielfältig und hängen von der Art der betroffenen Zelle sowie von den äußeren und inneren Bedingungen ab. Im Folgenden wird eine kleine Auswahl von Reaktionen beschrieben.
9.3.1 Reaktionen auf den Signalweg
Genexpression
Einige Signaltransduktionswege regulieren die Transkription von RNA. Andere regulieren die Translation von Proteinen.
Erhöhung des zellulären Stoffwechsels
Die Aktivierung von β-adrenergen Rezeptoren in Muskelzellen durch Adrenalin führt zu einem Anstieg des zyklischen AMP in der Zelle. Adrenalin ist ein von der Nebenniere produziertes Hormon, das den Körper auf kurzfristige Notfälle vorbereitet.
Zellwachstum
Die Zellsignalwege spielen auch eine wichtige Rolle bei der Zellteilung. Normalerweise teilen sich Zellen nicht, wenn sie nicht durch Signale anderer Zellen angeregt werden. Die Liganden, die das Zellwachstum fördern, werden Wachstumsfaktoren genannt. Die meisten Wachstumsfaktoren binden an Zelloberflächenrezeptoren, die mit Tyrosinkinasen verbunden sind.
Zelltod
Wenn eine Zelle geschädigt, überflüssig oder potenziell gefährlich für einen Organismus ist, kann eine Zelle einen Mechanismus zur Auslösung des programmierten Zelltods oder der Apoptose in Gang setzen. Die Apoptose ermöglicht das kontrollierte Absterben einer Zelle, wodurch die Freisetzung potenziell schädlicher Moleküle aus dem Inneren der Zelle verhindert wird. In manchen Fällen, wie z. B. bei einer Virusinfektion oder einer unkontrollierten Zellteilung aufgrund von Krebs, versagen jedoch die normalen Kontrollmechanismen der Zelle. Auch externe Signale können die Apoptose auslösen. So verfügen die meisten normalen tierischen Zellen über Rezeptoren, die mit der extrazellulären Matrix interagieren, einem Netz von Glykoproteinen, das den tierischen Zellen strukturelle Unterstützung bietet. Die Bindung der zellulären Rezeptoren an die extrazelluläre Matrix setzt eine Signalkaskade innerhalb der Zelle in Gang. Entfernt sich die Zelle jedoch von der extrazellulären Matrix, wird die Signalübertragung unterbrochen, und die Zelle unterliegt der Apoptose. Dieses System hilft zu verhindern, dass Zellen durch den Körper wandern und sich unkontrolliert vermehren, wie es bei Tumorzellen geschieht, die Metastasen bilden.
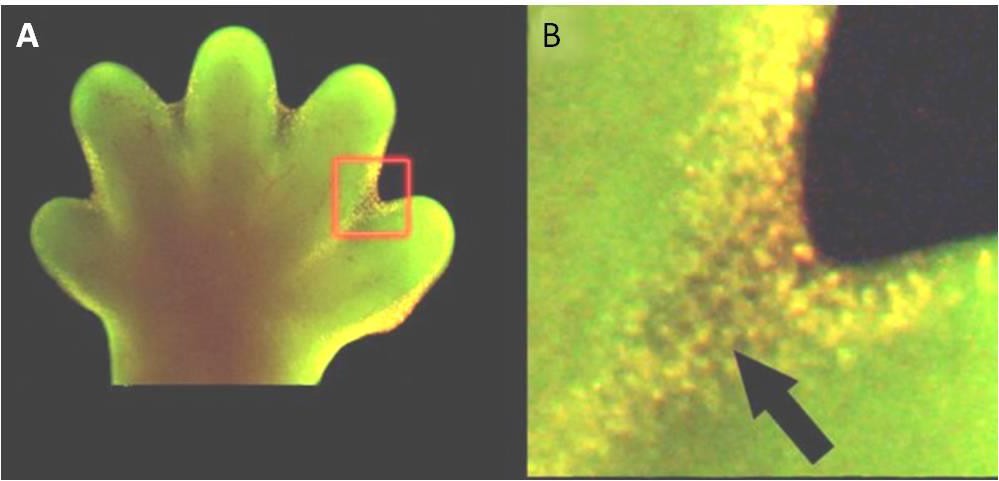
Apoptose ist auch für die normale embryologische Entwicklung wichtig. Bei Wirbeltieren zum Beispiel bilden sich in frühen Entwicklungsstadien netzartige Gewebe zwischen einzelnen Fingern und Zehen (Abbildung 9.15). Im Laufe der normalen Entwicklung müssen diese nicht benötigten Zellen eliminiert werden, damit sich vollständig getrennte Finger und Zehen bilden können. Ein zellulärer Signalmechanismus löst die Apoptose aus, die die Zellen zwischen den sich entwickelnden Zehen zerstört.
9.3.2 Beendigung von Signalwegen
Die in Tumorzellen häufig zu beobachtende abweichende Signalübertragung ist ein Beweis dafür, dass die Beendigung eines Signals zum richtigen Zeitpunkt ebenso wichtig sein kann wie die Einleitung eines Signals. Eine Methode, ein bestimmtes Signal zu stoppen, besteht darin, den Liganden abzubauen oder zu entfernen, so dass er keinen Zugang mehr zu seinem Rezeptor hat. Ein Grund dafür, dass hydrophobe Hormone wie Östrogen und Testosteron lang anhaltende Ereignisse auslösen, ist, dass sie an Trägerproteine binden. Diese Proteine sorgen dafür, dass die unlöslichen Moleküle im Blut löslich sind, aber sie schützen die Hormone auch vor dem Abbau durch zirkulierende Enzyme.
Im Inneren der Zelle machen viele verschiedene Enzyme die zellulären Veränderungen rückgängig, die durch Signalkaskaden entstehen. Zum Beispiel sind Phosphatasen Enzyme, die die Phosphatgruppe, die von Kinasen an Proteine angehängt wird, in einem Prozess entfernen, der Dephosphorylierung genannt wird. cAMP wird von der Phosphodiesterase zu AMP abgebaut, wodurch sein Signal beendet wird. In ähnlicher Weise wird die Freisetzung von Kalziumspeichern durch Ca2+-Pumpen, die sich in Zellmembranen befinden, rückgängig gemacht.