Coenzyme sind kleine organische Moleküle, die an Enzyme gebunden sind und deren Vorhandensein für die Aktivität dieser Enzyme wesentlich ist. Coenzyme gehören zu der größeren Gruppe der so genannten Cofaktoren, zu denen auch Metallionen gehören; Cofaktor ist der allgemeinere Begriff für kleine Moleküle, die für die Aktivität der mit ihnen verbundenen Enzyme erforderlich sind. Die Beziehung zwischen diesen beiden Begriffen ist wie folgt
I. Cofaktoren
- Essentielle Ionen
- Lose gebunden (bilden metallaktivierte Enzyme)
- Fest gebunden (bilden Metalloenzyme
- Coenzyme
- Fest gebundene prosthetische Gruppen
- 2. Lose gebundene Cosubstrate
Viele Coenzyme werden von Vitaminen abgeleitet. In Tabelle 1 sind Vitamine, die von ihnen abgeleiteten Coenzyme, die Art der Reaktionen, an denen sie beteiligt sind, und die Klasse der Coenzyme aufgeführt.
Prosthetische Gruppen sind fest an Enzyme gebunden und nehmen an den katalytischen Zyklen der Enzyme teil. Wie jeder Katalysator verändert sich ein Enzym-Prothesengruppen-Komplex während der Reaktion, aber bevor er eine weitere Reaktion katalysieren kann, muss er in seinen ursprünglichen Zustand zurückkehren.
Flavin-Adenin-Dinukleotid (FAD) ist eine prosthetische Gruppe, die an mehreren intrazellulären Oxidations-Reduktionsreaktionen beteiligt ist. Während des katalytischen Zyklus des Enzyms Succinat-Dehydrogenase nimmt FAD zwei Elektronen von Succinat auf, wodurch Fumarat als Produkt entsteht. Da FAD fest an das Enzym gebunden ist, wird die Reaktion manchmal folgendermaßen dargestellt:
Succinat + E-FAD → Fumarat + E-FADH 2
, wobei E-FAD für das Enzym steht, das fest an die prosthetische Gruppe FAD gebunden ist. Bei dieser Reaktion wird das Coenzym FAD zu FADH 2 reduziert und bleibt dabei fest an das Enzym gebunden. Bevor das Enzym die Oxidation eines weiteren Succinatmoleküls katalysieren kann, müssen die beiden Elektronen, die nun zu E-FADH 2 gehören, auf einen anderen Elektronenakzeptor, Ubichinon, übertragen werden. Der regenerierte E-FAD-Komplex kann dann ein weiteres Succinatmolekül oxidieren.
Kosubstrate sind lose gebundene Coenzyme, die in stöchiometrischen Mengen von Enzymen benötigt werden. Das Molekül Nikotinamid-Adenin-Dinukleotid (NAD) wirkt als Cosubstrat in der Oxidations-Reduktions-Reaktion, die von der Malat-Dehydrogenase, einem der Enzyme des Zitronensäurezyklus, katalysiert wird.
Malat + NAD + → Oxalacetat + NADH
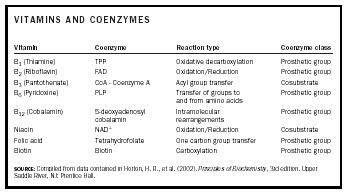
| VITAMINE UND COENZYME | |||
| Vitamin | Coenzym | Reaktionstyp | Coenzymklasse |
| QUELLE: Zusammengestellt aus Daten in Horton, H. R., et al. (2002). Principles of Biochemistry , 3. Auflage. Upper Saddle River, NJ: Prentice Hall. | |||
| B 1 (Thiamin) | TPP | Oxidative Decarboxylierung | Prothesengruppe |
| B 2 (Riboflavin) | FAD | Oxidation/Reduktion | Prosthetische Gruppe |
| B 3 (Pantothenat) | CoA – Coenzym A | Acylgruppenübertragung | Cosubstrat |
| B 6 (Pyridoxin) | PLP | Übertragung von Gruppen auf und von Aminosäuren | Prothesengruppe |
| B 12 (Cobalamin) | 5-Desoxyadenosyl-Cobalamin | Intramolekulare Umlagerungen | Prosthetische Gruppe |
| Niacin | NAD + | Oxidation/Reduktion | Cosubstrat |
| Folsäure | Tetrahydrofolat | Übertragung einer Kohlenstoffgruppe | Prosthetische Gruppe |
| Biotin | Biotin | Carboxylierung | Prosthetische Gruppe |
Bei dieser Reaktion, diffundieren Malat und NAD + in das aktive Zentrum der Malatdehydrogenase. Hier nimmt NAD + zwei Elektronen von Malat auf; Oxalacetat und NADH diffundieren dann aus dem aktiven Zentrum heraus. Das reduzierte NADH muss dann wieder in seine NAD +-Form gebracht werden. Für jeden katalytischen Zyklus wird ein „neues“ NAD +-Molekül benötigt, damit die Reaktion abläuft; es werden also stöchiometrische Mengen des Co-Substrats benötigt. Die reduzierte Form dieses Coenzyms (NADH) wird über eine Reihe von gleichzeitig ablaufenden Prozessen in der Zelle wieder in die oxidierte Form (NAD + ) umgewandelt, und das regenerierte NAD + kann dann an einer weiteren Runde der Katalyse teilnehmen.
Coenzyme sind also eine Art von Kofaktoren. Sie sind kleine organische Moleküle, die fest (prosthetische Gruppen) oder lose (Kosubstrate) an Enzyme binden, während sie an der Katalyse teilnehmen.