Physikalische Eigenschaften von ionischen und kovalenten Verbindungen
Im Allgemeinen haben ionische und kovalente Verbindungen unterschiedliche physikalische Eigenschaften. Ionische Verbindungen bilden harte kristalline Feststoffe, die bei hohen Temperaturen schmelzen und resistent gegen Verdunstung sind. Diese Eigenschaften ergeben sich aus der charakteristischen inneren Struktur eines ionischen Festkörpers, die in Teil (a) in Abbildung 2.7.4 schematisch dargestellt ist. Sie zeigt die dreidimensionale Anordnung von abwechselnd positiven und negativen Ionen, die durch starke elektrostatische Anziehung zusammengehalten werden. Im Gegensatz dazu bestehen die meisten kovalenten Verbindungen, wie in Teil (b) in Abbildung 9.5.1 dargestellt, aus einzelnen Molekülen, die durch vergleichsweise schwache intermolekulare Kräfte (die Kräfte zwischen den Molekülen) zusammengehalten werden, obwohl die Atome innerhalb jedes Moleküls durch starke intramolekulare kovalente Bindungen (die Kräfte innerhalb des Moleküls) zusammengehalten werden. Kovalente Stoffe können bei Raumtemperatur und -druck Gase, Flüssigkeiten oder Feststoffe sein, je nach Stärke der zwischenmolekularen Wechselwirkungen. Kovalente molekulare Feststoffe neigen dazu, weiche Kristalle zu bilden, die bei niedrigen Temperaturen schmelzen und leicht verdampfen.
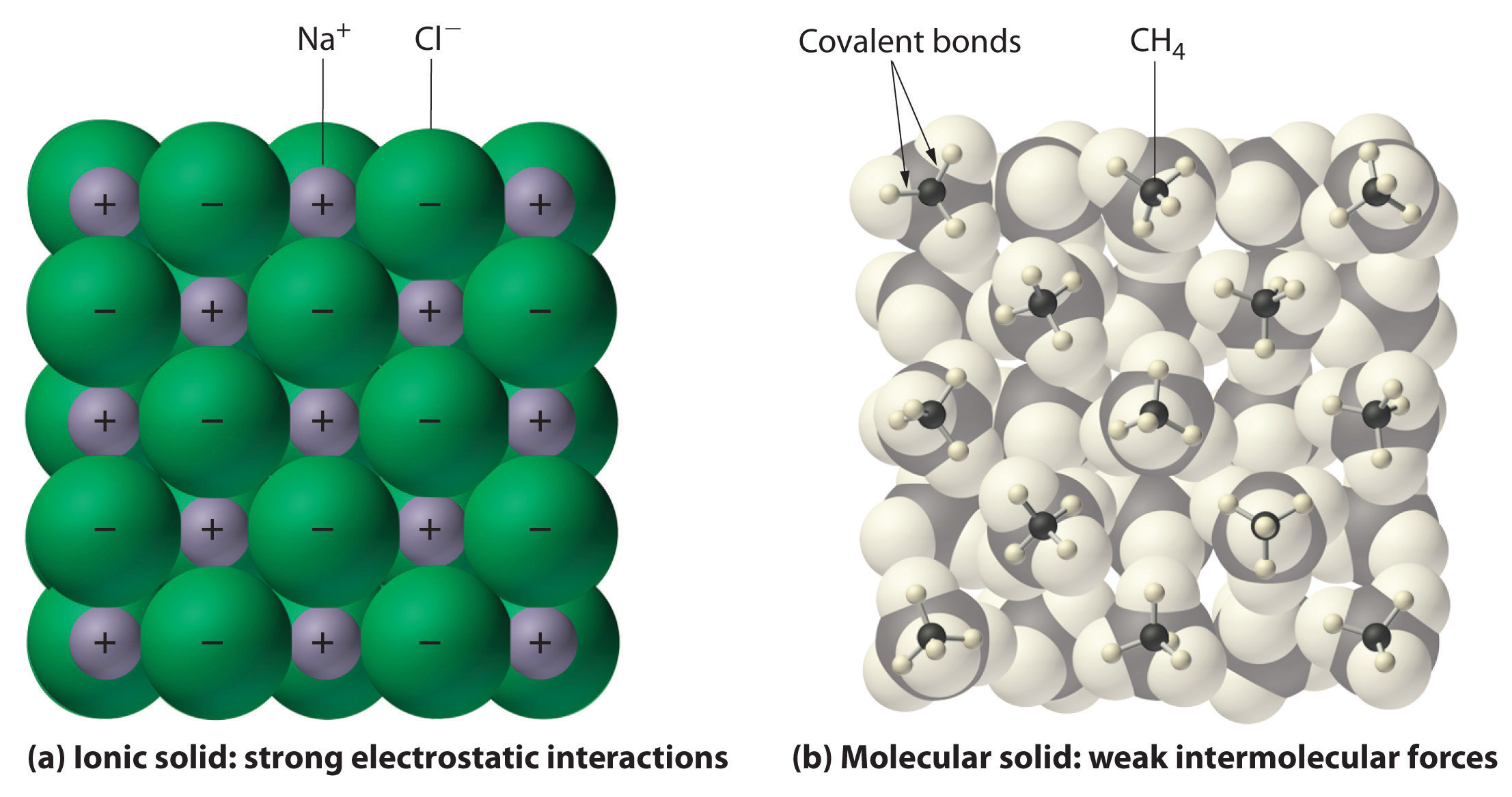
Abbildung 9.5.1: Wechselwirkungen in ionischen und kovalenten Festkörpern. (a) Die positiv und negativ geladenen Ionen in einem ionischen Festkörper wie Natriumchlorid (NaCl) werden durch starke elektrostatische Wechselwirkungen zusammengehalten. (b) In dieser Darstellung der Packung von Methanmolekülen (\(CH_4\)) in festem Methan, einem prototypischen molekularen Festkörper, werden die Methanmoleküle im Festkörper nur durch relativ schwache zwischenmolekulare Kräfte zusammengehalten, obwohl die Atome innerhalb jedes Methanmoleküls durch starke kovalente Bindungen zusammengehalten werden.
Kohlenwasserstoffe
Molekulare Festkörper bestehen aus Atomen oder Molekülen, die durch Dipol-Dipol-Wechselwirkungen, Londoner Dispersionskräfte oder Wasserstoffbrückenbindungen oder eine beliebige Kombination dieser Kräfte zusammengehalten werden. Die Anordnung der Moleküle im festen Benzol ist wie folgt:

Abbildung 9.5.2: Die Struktur von festem Benzol. In festem Benzol sind die Moleküle nicht parallel zueinander angeordnet, sondern in einem Winkel von 90°.
Da die zwischenmolekularen Wechselwirkungen in einem molekularen Festkörper im Vergleich zu ionischen und kovalenten Bindungen relativ schwach sind, neigen molekulare Festkörper dazu, weich zu sein, niedrig zu schmelzen und leicht zu verdampfen (\(ΔH_{fus}\) und \(ΔH_{vap}\) sind niedrig). Bei ähnlichen Stoffen nimmt die Stärke der Londoner Dispersionskräfte mit zunehmender Molekülmasse gleichmäßig zu. So liegen beispielsweise die Schmelzpunkte von Benzol (C6H6), Naphthalin (C10H8) und Anthracen (C14H10) mit einem, zwei bzw. drei kondensierten aromatischen Ringen bei 5,5°C, 80,2°C bzw. 215°C. Auch die Schmelzenthalpien steigen innerhalb der Reihe gleichmäßig an: Benzol (9,95 kJ/mol) < Naphthalin (19,1 kJ/mol) < Anthracen (28,8 kJ/mol). Wenn die Moleküle jedoch Formen aufweisen, die sich nicht effizient im Kristall zusammenfügen lassen, sind die Schmelzpunkte und Schmelzenthalpien tendenziell unerwartet niedrig, weil die Moleküle nicht in der Lage sind, sich so anzuordnen, dass die intermolekularen Wechselwirkungen optimiert werden. So haben Toluol (C6H5CH3) und m-Xylol Schmelzpunkte von -95°C bzw. -48°C, die deutlich unter dem Schmelzpunkt des leichteren, aber symmetrischeren Analogons Benzol liegen.
Selbstheilender Gummi ist ein Beispiel für einen molekularen Feststoff mit dem Potenzial für bedeutende kommerzielle Anwendungen. Das Material kann sich dehnen, aber wenn es in Stücke gerissen wird, kann es sich durch die Wiederherstellung seines Wasserstoffbindungsnetzes wieder zusammenfügen, ohne Anzeichen von Schwäche zu zeigen. Es wird unter anderem für die Verwendung in Klebstoffen und Fahrradreifen, die sich selbst heilen, untersucht.

Abbildung 9.5.3: Toluol und m-Xylol. Die Methylgruppen, die in Toluol und m-Xylol an den Phenylring gebunden sind, verhindern, dass sich die Ringe so gut zusammenfügen wie im festen Benzol.