24-6C Reaktionen von Nitroverbindungen
Nitroverbindungen sind im thermodynamischen Sinne recht instabil; so beträgt z. B. die Zersetzungswärme von Nitromethan nach der folgenden Stöchiometrie \(67.4 \: \text{kcal mol}^{-1}\).
\
Die beträchtlichen Energien und schnellen Geschwindigkeiten solcher Reaktionen werden bei der kommerziellen Verwendung von Nitroverbindungen als Sprengstoff ausgenutzt. Bei einigen Nitroverbindungen, wie z. B. TNT, besteht ein weiterer Vorteil darin, dass sie wenig stoßempfindlich sind.
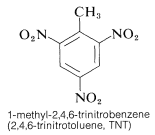
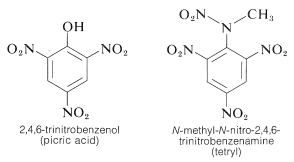
TNT wird nicht leicht durch einen einfachen Schlag zur Detonation gebracht und brennt sogar, ohne zu explodieren. Sobald jedoch die Detonation einsetzt, setzt sich die Zersetzung schnell fort. Die Eigenschaften der angemessenen Handhabungsstabilität und des hohen thermodynamischen Potenzials machen Nitroverbindungen besonders nützlich. Andere Polynitroverbindungen, die sich als Sprengstoffe eignen, sind PETN (Abschnitt 17-3C), Cyclonit (Abschnitt 16-4C), Pikrinsäure und Tetryl:
Ein wichtiges Merkmal aromatischer Polynitroverbindungen ist ihre Fähigkeit, „Ladungsübertragungskomplexe“ mit aromatischen Kohlenwasserstoffen zu bilden, insbesondere mit solchen, die mit Alkylgruppen substituiert sind. Komplexe aus 2,4,6-Trinitrobenzol (Pikrinsäure) und aromatischen Kohlenwasserstoffen sind häufig kristalline Feststoffe, die für die Trennung, Reinigung und Identifizierung von aromatischen Kohlenwasserstoffen nützlich sind. Diese Stoffe werden als „Kohlenwasserstoff-Pikrate“ bezeichnet, aber der Name ist irreführend, da es sich nicht um Salze handelt. Außerdem werden ähnliche Komplexe zwischen aromatischen Kohlenwasserstoffen und Trinitrobenzol gebildet, was zeigt, dass die Nitrogruppen und nicht die Hydroxylgruppe für die Komplexbildung wesentlich sind. Die Bindung in diesen Komplexen ähnelt der in den \(\pi\)-Komplexen von Halogenen mit Alkenen und Benzol (Abschnitte 22-4D und 10-3C) und resultiert aus Anziehungskräften zwischen elektronenreichen und elektronenarmen Substanzen. Der beschreibende Name – Ladungstransferkomplex – deutet darauf hin, dass der Komplex VB-Strukturen aufweist, bei denen ein Elektron vom Donatormolekül (elektronenreich) auf das Akzeptormolekül (elektronenarm) übertragen wird. Die Bezeichnung \(\pi\)-Komplex wird auch verwendet, weil in der Regel mindestens eine Komponente des Komplexes ein \(\pi\)-Elektronensystem aufweist. Ladungstransfer- oder \(\pi\)-Komplexe zwischen Polynitroverbindungen und aromatischen Kohlenwasserstoffen scheinen sandwichartige Strukturen zu ergeben, bei denen die aromatischen Ringe in parallelen Ebenen liegen, wenn auch nicht unbedingt genau übereinander:
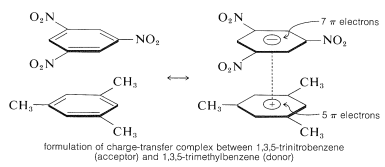
Ladungstransferkomplexe sind fast immer stärker gefärbt als ihre Einzelkomponenten. Ein spektakuläres Beispiel sind Benzol und Tetracyanoethen, die einzeln farblos sind, in der Mischung aber einen leuchtend orangefarbenen Komplex ergeben. Eine Verschiebung hin zu längeren Wellenlängen der Absorption im Vergleich zu ihren Komponenten ist bei Ladungstransferkomplexen zu erwarten, da die Möglichkeit der Stabilisierung des angeregten Zustands durch Elektronen-Delokalisierung, an der beide Komponenten beteiligt sind, erhöht ist.
Die Reduktion von Nitroverbindungen erfolgt leicht mit einer Vielzahl von Reduktionsmitteln und solche Reduktionen ermöglichen eine besonders nützliche Synthese von aromatischen Aminen (Abschnitt 23-12B):
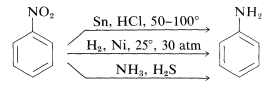
Die Reduktion einer Nitroverbindung zu einem Amin erfordert sechs Äquivalente Reduktionsmittel:
\
Man würde nicht erwarten, dass eine solche Reduktion in einem einzigen Schritt erfolgt. Tatsächlich verläuft die Reduktion schrittweise und über eine Reihe von Zwischenprodukten, die bei starken Reduktionsmitteln in saurer Lösung höchstens eine vorübergehende Existenz haben. Die Zwischenprodukte, die nacheinander aus \(\ce{RNO_2}\) durch Inkremente von zwei Äquivalenten des Reduktionsmittels gebildet werden, sind Nitrosoverbindungen, \(\ce{R-N=O}\), und \(\ce{N}\)-substituierte Azanole (Hydroxylamine), \(\ce{RNHOH}\):
\}{\longrightarrow}} \ce{RN=O} \overset{2 \left}{\longrightarrow} \ce{RNHOH} \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}\]
So können \(\ce{N}\)-Aryl-substituierte Azanole direkt aus den entsprechenden Nitroverbindungen mit Zink und Ammoniumchloridlösung erhalten werden. Mit Zink und Salzsäure hingegen erhält man das Amin:
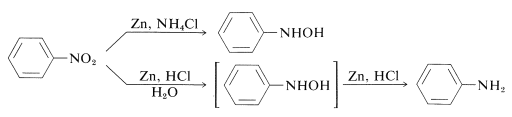
Der Unterschied zwischen diesen Reaktionen liegt in den Reduktionsraten, die mit dem Säuregrad der Lösung zusammenhängen. Ammoniumchlorid ist eine viel schwächere Säure als \(\ce{HCl}\); der pH-Wert von Ammoniumchloridlösungen liegt bei etwa 6.
Die Oxidation der \(\ce{N}\)-Arylazanole unter kontrollierten Bedingungen führt zu Nitrosoverbindungen. Diese Reaktion ist der Oxidation von Alkoholen zu Ketonen (Abschnitt 15-6B) nicht unähnlich:
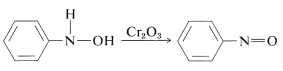
Die Reduktion von Arylnitroverbindungen mit weniger starken Reduktionsmitteln, insbesondere in alkalischen Medien, ergibt ein scheinbar rätselhaftes Konglomerat von bimolekularen Reduktionsprodukten. Mit Nitrobenzol zum Beispiel,
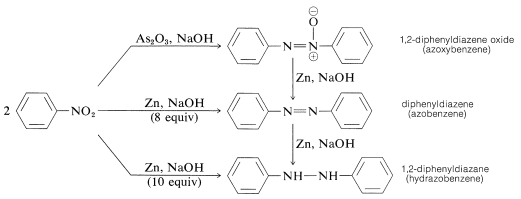
Alle diese Stoffe können mit Zinn und Salzsäure zu Benzolamin reduziert werden. Folglich könnte jede dieser Substanzen ein Zwischenprodukt bei der Reduktion von Nitroverbindungen zu Aminen sein, muss es aber nicht. Die Bildung der bimolekularen Reduktionsprodukte ist das Ergebnis von baseninduzierten Reaktionen zwischen Nitrosoverbindungen und Azanolen oder Aminen und möglicherweise einer weiteren Reduktion der ursprünglich hergestellten Substanzen.
Einige Polynitrobenzolderivate haben wichtige herbizide Anwendungen. Beispiele sind \(\ce{N}^3\), \(\ce{N}^3\)-Diethyl-6-trifluormethyl-2,4-dinitro-1,3-benzoldiamin und \(\ce{N}\),\(\ce{N}\)-Dipropyl-4-trifluormethyl-2,6-dinitrobenzolamin:
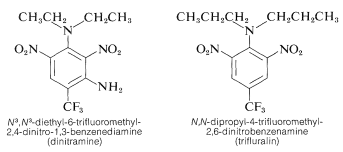
Diese Substanzen töten, wenn sie mit dem Boden vermischt werden, Unkrautkeimlinge, aber keine Kulturpflanzen wie Baumwolle, Sojabohnen und Erdnüsse. Die Aktivität ist hoch; normalerweise ist nur etwa 0,08 \(\text{g m}^{-2}\) für eine gute Unkrautbekämpfung erforderlich.
Die wichtigsten Reaktionen von Nitroalkanen sind diejenigen, an denen die \(\alpha\)-Wasserstoffe der Primär- und Sekundärverbindungen beteiligt sind. Beispielsweise ist Nitromethan ausreichend sauer, um sich in wässrigen Hydroxidlösungen aufzulösen. Das dabei entstehende Anion hat eine dem Nitratanion analoge elektronische Struktur:
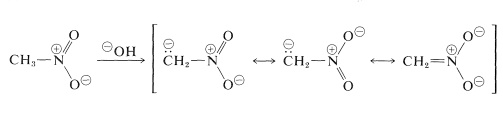
Eine interessante Eigenschaft dieses Ions ist, dass beim Ansäuern von Lösungen ein instabiles, ziemlich stark saures Isomer von Nitromethan (die so genannte Aci-Form) entsteht, das sich langsam in die stabilere Nitro-Form umwandelt:
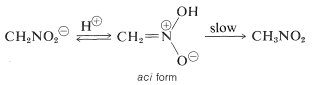
Ähnliche Veränderungen finden bei der Ansäuerung des Enolsalzes einer Carbonylverbindung statt, wobei der Hauptunterschied in der viel längeren Lebensdauer der Aci-Nitroverbindung im Vergleich zu der eines Enols eines einfachen Ketons besteht (siehe Abschnitt 17-1B).
Primäre und sekundäre Nitroverbindungen können mit geeigneten Carbonylverbindungen und basischen Katalysatoren Aldol- und Michael-Additionen eingehen:
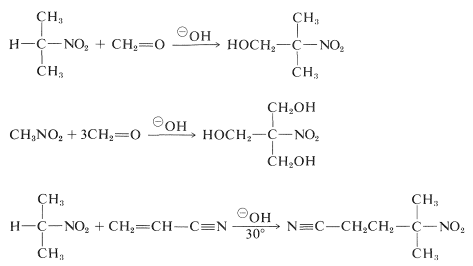
Leider sind Alkylierungsreaktionen analog zur basenkatalysierten Alkylierung von Carbonylverbindungen für die Synthese höherer Nitroverbindungen im Allgemeinen nicht brauchbar, weil die \(\ce{C}\)-Alkylierung der konjugierten Basen primärer Nitroverbindungen langsamer ist als die \(\ce{O}\)-Alkylierung.