Lernziele
- Die wichtigsten Arten von Radioaktivität zu definieren und Beispiele zu nennen.
Atome bestehen aus subatomaren Teilchen – Protonen, Neutronen und Elektronen. Protonen und Neutronen befinden sich im Kern und machen den größten Teil der Masse des Atoms aus, während die Elektronen den Kern in Schalen und Unterschalen umkreisen und für die Größe des Atoms verantwortlich sind. Erinnern Sie sich an die Notation zur kurzen Darstellung eines Isotops eines bestimmten Atoms:
\
Das Element in diesem Beispiel, dargestellt durch das Symbol C, ist Kohlenstoff. Seine Ordnungszahl, 6, ist der untere linke Index des Symbols und gibt die Anzahl der Protonen im Atom an. Die Massenzahl, die hochgestellte Zahl links oben im Symbol, ist die Summe der Anzahl der Protonen und Neutronen im Kern dieses speziellen Isotops. In diesem Fall ist die Massenzahl 12, was bedeutet, dass die Anzahl der Neutronen im Atom 12 – 6 = 6 beträgt (d. h. die Massenzahl des Atoms minus die Anzahl der Protonen im Kern ist gleich der Anzahl der Neutronen). Gelegentlich wird die Ordnungszahl in dieser Schreibweise weggelassen, weil das Symbol des Elements selbst seine charakteristische Ordnungszahl wiedergibt. Die beiden Isotope des Wasserstoffs, 2H und 3H, haben ihre eigenen Namen: Deuterium (D) bzw. Tritium (T). Eine andere Möglichkeit, ein bestimmtes Isotop anzugeben, besteht darin, die Massenzahl hinter dem Elementnamen aufzuführen, wie z. B. Kohlenstoff-12 oder Wasserstoff-3.
Die Atomtheorie des 19. Jahrhunderts ging davon aus, dass die Kerne eine feste Zusammensetzung haben. Doch 1896 stellte der französische Wissenschaftler Henri Becquerel fest, dass eine Uranverbindung, die in der Nähe einer fotografischen Platte platziert wurde, ein Bild auf der Platte erzeugte, selbst wenn die Verbindung in schwarzes Tuch eingewickelt war. Er schloss daraus, dass die Uranverbindung eine Art von Strahlung abgab, die durch das Tuch hindurchging und die fotografische Platte belichtete. Weitere Untersuchungen ergaben, dass es sich bei der Strahlung um eine Kombination aus Teilchen und elektromagnetischen Strahlen handelte, deren Quelle letztlich der Atomkern war. Diese Emanationen wurden schließlich als Radioaktivität bezeichnet.
Es gibt drei Hauptformen radioaktiver Emissionen. Die erste Form ist das Alphateilchen, das durch den griechischen Buchstaben α symbolisiert wird. Ein Alphateilchen besteht aus zwei Protonen und zwei Neutronen und entspricht damit einem Heliumkern. (Wir verwenden oft \(\ce{^{4}_{2}He}\), um ein Alphateilchen darzustellen.) Es hat eine 2+-Ladung. Wenn ein radioaktives Atom ein Alphateilchen aussendet, verringert sich die Ordnungszahl des ursprünglichen Atoms um zwei (wegen des Verlusts von zwei Protonen) und seine Massenzahl um vier (wegen des Verlusts von vier Kernteilchen). Wir können die Emission eines Alphateilchens mit einer chemischen Gleichung darstellen – die Alphateilchenemission von Uran-235 sieht zum Beispiel wie folgt aus:
\
Woher wissen wir, dass ein Produkt der Reaktion \(\ce{^{231}_{90}Th}\) ist? Wir verwenden das Gesetz der Erhaltung der Materie, das besagt, dass Materie weder geschaffen noch zerstört werden kann. Das bedeutet, dass wir auf beiden Seiten der chemischen Gleichung die gleiche Anzahl von Protonen und Neutronen haben müssen. Wenn unser Urankern 2 Protonen verliert, bleiben 90 Protonen übrig, was das Element als Thorium kennzeichnet. Wenn wir außerdem 4 Kernteilchen des ursprünglichen 235 verlieren, bleiben 231 übrig. Wir verwenden also die Subtraktion, um das Isotop des Thoriumatoms zu identifizieren – in diesem Fall \(\ce{^{231}_{90}Th}\).
Chemiker verwenden oft die Bezeichnungen Elternisotop und Tochterisotop, um das ursprüngliche Atom und das Produkt, das nicht das Alphateilchen ist, darzustellen. Im vorherigen Beispiel ist \(\ce{^{235}_{92}U}\) das Ausgangsisotop und \(\ce{^{231}_{90}Th}\) das Tochterisotop. Wenn sich ein Element auf diese Weise in ein anderes verwandelt, macht es einen radioaktiven Zerfall durch.
Beispiel \(\PageIndex{1}\): Radon-222
Schreiben Sie die Kerngleichung, die den radioaktiven Zerfall von Radon-222 durch Alphateilchenemission darstellt, und identifizieren Sie das Tochterisotop.
Lösung
Radon hat die Ordnungszahl 86, also wird das Mutterisotop als \(\ce{^{222}_{86}Rn}\) dargestellt. Wir stellen das Alphateilchen als \(\ce{^{4}_{2}He}\) dar und verwenden die Subtraktion (222 – 4 = 218 und 86 – 2 = 84), um das Tochterisotop als Isotop von Polonium zu identifizieren, \(\mathrm{^{218}_{84}Po}\):
\(\ce{_{86}^{222}Rn\rightarrow \, _2^4He + \, _{84}^{218}Po}\)
Übung \(\PageIndex{1}\): Polonium-209
Schreiben Sie die Kerngleichung, die den radioaktiven Zerfall von Polonium-209 durch Alphateilchenemission darstellt und identifizieren Sie das Tochterisotop.
Antwort
\(\ce{_{84}^{209}Po\rightarrow \, _2^4He + \, _{82}^{205}Pb}\)
Die zweite wichtige Art der radioaktiven Emission wird Betateilchen genannt, symbolisiert durch den griechischen Buchstaben β. Ein Betateilchen ist ein Elektron, das aus dem Kern (nicht aus den Elektronenschalen um den Kern) herausgeschleudert wird und eine 1-Ladung hat. Wir können ein Betateilchen auch als \(\ce{^0_{-1}e}\) oder β- darstellen. Der Nettoeffekt der Betateilchenemission auf einen Kern ist, dass ein Neutron in ein Proton umgewandelt wird. Die Gesamtmassenzahl bleibt gleich, aber da sich die Anzahl der Protonen um eins erhöht, erhöht sich die Ordnungszahl um eins. Kohlenstoff-14 zerfällt unter Aussendung eines Betateilchens:
\
Auch hier ist die Summe der Ordnungszahlen auf beiden Seiten der Gleichung gleich, ebenso die Summe der Massenzahlen. (Man beachte, dass dem Elektron eine „Ordnungszahl“ von 1 zugewiesen wird, die seiner Ladung entspricht.)
Die dritte wichtige Art radioaktiver Emission ist kein Teilchen, sondern eine sehr energiereiche Form elektromagnetischer Strahlung, die Gammastrahlung, symbolisiert durch den griechischen Buchstaben γ. Gammastrahlen selbst tragen keine elektrische Gesamtladung, aber sie können Elektronen aus den Atomen einer Materieprobe herausschlagen und diese elektrisch aufladen (weshalb Gammastrahlen als ionisierende Strahlung bezeichnet werden). Beim radioaktiven Zerfall von Radon-222 werden beispielsweise sowohl Alpha- als auch Gammastrahlen emittiert, wobei letztere eine Energie von 8,2 × 10-14 J pro zerfallenem Kern haben:
\
Das mag nicht viel Energie sein, aber wenn 1 Mol Radonatome zerfallen würde, würde die Gammastrahlenenergie 49 Millionen kJ betragen!
Beispiel \(\PageIndex{2}\): Bor-12
Schreiben Sie die Kerngleichung, die den radioaktiven Zerfall von Bor-12 durch Betateilchenemission darstellt, und bestimmen Sie das Tochterisotop. Gleichzeitig mit dem Betateilchen wird ein Gammastrahl emittiert.
Lösung
Das Ausgangsisotop ist \(\ce{^{12}_{5}B}\), während eines der Produkte ein Elektron ist, \(\ce{^{0}_{-1}e}\). Damit die Massen- und Ordnungszahlen auf beiden Seiten den gleichen Wert haben, muss die Massenzahl des Tochterisotops 12 und seine Ordnungszahl 6 betragen. Das Element mit der Ordnungszahl 6 ist der Kohlenstoff. Die vollständige Kerngleichung lautet also wie folgt:
\
Das Tochterisotop ist \(\ce{^{12}_6 C}\).
Übung \(\PageIndex{2}\): Jod-131
Schreiben Sie die Kerngleichung, die den radioaktiven Zerfall von Jod-131 durch Betateilchenemission darstellt und identifizieren Sie das Tochterisotop. Gleichzeitig mit dem Betateilchen wird ein Gammastrahl emittiert.
Antwort
\
Alpha-, Beta- und Gammastrahlen haben unterschiedliche Fähigkeiten, Materie zu durchdringen. Das relativ große Alphateilchen wird von der Materie leicht aufgehalten (obwohl es der Materie, mit der es in Berührung kommt, eine beträchtliche Menge an Energie zuführen kann). Betateilchen dringen nur geringfügig in Materie ein, vielleicht höchstens ein paar Zentimeter. Gammastrahlen können tief in die Materie eindringen und eine große Menge an Energie in die umgebende Materie abgeben. Tabelle \(\PageIndex{1}\) fasst die Eigenschaften der drei Hauptarten radioaktiver Emissionen zusammen.
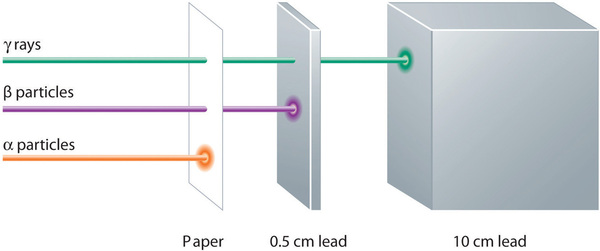
| Charakteristik | Alpha-Teilchen | Beta-Teilchen | Gamma-Strahlen |
|---|---|---|---|
| Symbole | α, \(\mathrm{_{2}^{4}He}\) | β, \(\ce{^{0}_{-1} e}\) | γ |
| Identität | Heliumkern | Elektron | elektromagnetische Strahlung |
| Ladung | 2+ | 1- | keine |
| Massenzahl | 4 | 0 | 0 |
| Durchschlagskraft | minimal (dringt nicht in die Haut ein) | kurz (dringt leicht in die Haut und einige Gewebe ein) | tief (dringt tief in das Gewebe ein) |
gelegentlich, bricht ein Atomkern in einem radioaktiven Prozess, der als spontane Spaltung bezeichnet wird, in kleinere Teile auseinander. Bei den durch die Spaltung erzeugten Tochterisotopen handelt es sich in der Regel um eine bunte Mischung von Produkten und nicht um ein bestimmtes Isotop wie bei der Emission von Alpha- und Betateilchen. Häufig entstehen bei der Spaltung überschüssige Neutronen, die manchmal von anderen Kernen eingefangen werden, was zu weiteren radioaktiven Ereignissen führen kann. Uran-235 unterliegt in geringem Umfang der spontanen Spaltung. Eine typische Reaktion ist
\
, wobei \(\ce{_0^1n}\) ein Neutron ist. Wie bei jedem Kernprozess müssen die Summen der Ordnungszahlen und der Massenzahlen auf beiden Seiten der Gleichung gleich sein. Spontane Spaltung findet nur in großen Kernen statt. Der kleinste Kern, der spontane Spaltung zeigt, ist Blei-208.
Die Spaltung ist der radioaktive Prozess, der in Kernkraftwerken und einer Art von Atombombe verwendet wird.
Key Takeaway
Zu den Haupttypen der Radioaktivität gehören Alphateilchen, Betateilchen und Gammastrahlen.
Übung zur Wiederholung des Konzepts
-
Was sind die Haupttypen der Radioaktivität? Schreibe chemische Gleichungen, die die einzelnen Arten zeigen.
Antwort
-
Die Hauptarten der Radioaktivität sind Alphazerfall, Betazerfall und Gammastrahlung; Alphazerfall mit Gammastrahlung: \(\mathrm{_{86}^{222}Rn \rightarrow \, _{84}^{218}Po + \, ^4_2He + \gamma}\); Betazerfall: \(\ce{_6^{14}C \rightarrow _7^{14}N + ^0_{-1}e}\) (Antworten werden variieren)