Většina léčebných postupů je navržena pro „průměrného pacienta“ jako univerzální přístup, který může být úspěšný pro některé pacienty, ale ne pro jiné. Precizní medicína, někdy označovaná jako „personalizovaná medicína“, je inovativní přístup k přizpůsobení prevence a léčby nemocí, který zohledňuje rozdíly v genech, prostředí a životním stylu lidí. Cílem precizní medicíny je zacílit správnou léčbu na správné pacienty ve správný čas.
Pokroky v precizní medicíně již vedly k novým mocným objevům a léčbě schválené FDA, která je přizpůsobena specifickým vlastnostem jednotlivců, jako je genetická výbava člověka nebo genetický profil nádoru jednotlivce. Pacienti s různými druhy rakoviny běžně podstupují molekulární testování jako součást péče o pacienty, což lékařům umožňuje zvolit léčbu, která zvyšuje šance na přežití a snižuje vystavení nežádoucím účinkům.
- Testy sekvenování nové generace (NGS)
- Úloha FDA při prosazování precizní medicíny
- Zjednodušení regulačního dohledu úřadu FDA nad testy NGS
- Pokyny ke klinickým databázím
- Pokyny pro analytickou validaci
- Bioinformatická platforma FDA
- Dotaz?
- Co říkají úředníci FDA
- NGS Final Guidances
- Zprávy a diskusní dokumenty
- Předchozí schůzky
Testy sekvenování nové generace (NGS)
Přesná péče bude jen tak dobrá, jak dobré budou testy, kterými se řídí diagnostika a léčba. Testy sekvenování nové generace (NGS) jsou schopny rychle identifikovat nebo „sekvenovat“ velké úseky genomu člověka a představují významný pokrok v klinických aplikacích precizní medicíny.
Pacienti, lékaři a výzkumní pracovníci mohou pomocí těchto testů nalézt genetické varianty, které jim pomohou diagnostikovat, léčit a lépe porozumět lidským onemocněním.
Úloha FDA při prosazování precizní medicíny
FDA pracuje na zajištění přesnosti testů NGS, aby pacienti a lékaři mohli dostávat přesné a klinicky významné výsledky testů.
Obrovské množství informací získaných prostřednictvím NGS představuje pro FDA nové regulační problémy. Zatímco současné regulační přístupy jsou vhodné pro konvenční diagnostiku, která zjišťuje jedno onemocnění nebo stav (například hladinu glukózy nebo cholesterolu v krvi), tyto nové sekvenační techniky obsahují ekvivalent milionů testů v jednom. Z tohoto důvodu úřad FDA spolupracoval se zúčastněnými stranami z průmyslu, laboratoří, akademické obce a pacientských a odborných společností na vytvoření flexibilního regulačního přístupu, který by vyhovoval této rychle se rozvíjející technologii a který by využíval konsensuální standardy, hromadně získávaná data a nejmodernější výpočetní technologie s otevřeným zdrojovým kódem na podporu vývoje testů NGS. Tento přístup umožní inovace v testování a výzkumu a urychlí přístup k přesným a spolehlivým genetickým testům.
Zjednodušení regulačního dohledu úřadu FDA nad testy NGS
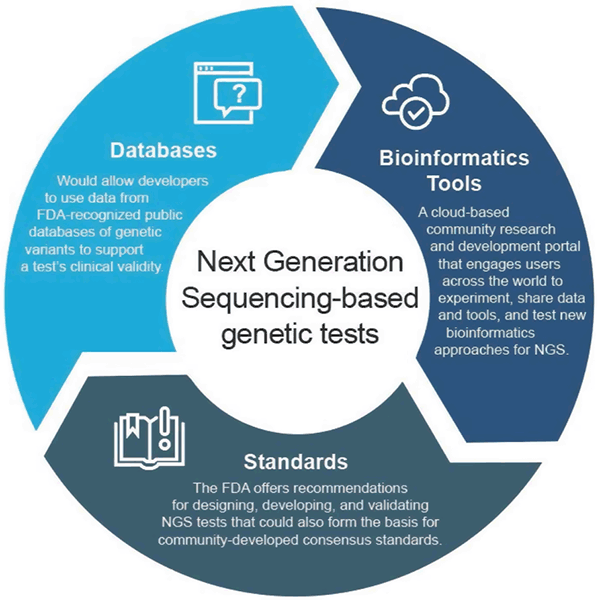
V dubnu 2018 vydal úřad FDA dva konečné pokyny, které doporučují přístupy ke zjednodušení předkládání a přezkumu údajů podporujících klinickou a analytickou validitu testů založených na NGS. Cílem těchto doporučení je zajistit efektivní a flexibilní přístup k regulačnímu dohledu: s rozvojem technologie se mohou standardy rychle vyvíjet a být použity ke stanovení vhodných metrik pro rychle se rozvíjející obory, jako je NGS. Podobně, jak se zlepšují klinické důkazy, mohou být podporována nová tvrzení. Tento adaptivní přístup by v konečném důsledku podpořil inovace mezi vývojáři testů a zlepšil přístup pacientů k těmto novým technologiím.
Pokyny ke klinickým databázím
Konečný pokyn „Využití veřejných databází lidských genetických variant k podpoře klinické platnosti genetických a genomických diagnostik in vitro“ umožňuje vývojářům používat údaje z veřejných databází genetických variant uznávaných úřadem FDA k podpoře klinické platnosti testu a nastiňuje, jak mohou správci databází usilovat o uznání svých databází, pokud splňují určitá kvalitativní doporučení. Tento přístup motivuje ke sdílení dat a poskytuje efektivnější cestu na trh.
Více informací o uznávání databází je k dispozici na webových stránkách FDA Recognition of Public Human Genetic Variants Databases.
Pokyny pro analytickou validaci
Konečný pokyn „Considerations for Design, Vývoj, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases“ nabízí doporučení pro návrh, vývoj a validaci testů NGS. Pokyny rovněž podporují zapojení komunity do vývoje norem souvisejících s NGS prostřednictvím organizací pro tvorbu norem (SDO), protože normy se mohou rychleji vyvíjet spolu se změnami v technologii a znalostech, a lze je proto použít ke stanovení vhodných měřítek, jako jsou specifické prahové hodnoty výkonnosti pro rychle se rozvíjející oblasti, jako je NGS.
Bioinformatická platforma FDA
FDA vytvořila precisionFDA, cloudový komunitní portál pro výzkum a vývoj, který zapojuje uživatele z celého světa do sdílení dat a nástrojů pro testování, pilotování a ověřování stávajících a nových bioinformatických přístupů ke zpracování NGS. Jednotlivci a organizace z genomické komunity mohou najít další informace a přihlásit se k účasti na adrese http://precision.fda.gov.
Dotaz?
V případě jakýchkoli dotazů týkajících se úsilí úřadu FDA v oblasti precizní medicíny nás prosím kontaktujte na adrese [email protected].
Co říkají úředníci FDA
- FDA dokončuje pokyny k urychlení vývoje spolehlivých, přínosných testů založených na sekvenování nové generace
NGS Final Guidances
- Využití veřejných databází lidských genetických variant k podpoře klinické validity pro genetickou a genomickou diagnostiku in vitro – pokyny pro zúčastněné strany a pracovníky Úřadu pro potraviny a léčiva (PDF – 444KB)
- Pohledy na návrh, Development, a analytickou validaci in vitro diagnostik (IVD) založených na sekvenování nové generace (NGS), které mají pomoci při diagnostice podezřelých zárodečných onemocnění – pokyny pro zúčastněné strany a pracovníky Úřadu pro potraviny a léčiva (PDF – 869KB)
Zprávy a diskusní dokumenty
- Optimalizace regulačního dohledu FDA nad diagnostickými testy založené na sekvenování nové generace (PDF – 424KB)
- Zpráva: Paving Way for Personalized Medicine (archivováno)
Předchozí schůzky
- 27.07.2016: Webinář – Návrh pokynů pro sekvenování nové generace (NGS):
- 07/27/16: Webinář – Návrh pokynů pro sekvenování nové generace (NGS): Technické a regulační aspekty
- 13/11/2015: Veřejný seminář – Využití databází pro stanovení klinické relevance lidských genetických variant
- 11/12/2015: Přístup založený na standardech k hodnocení analytické výkonnosti in vitro diagnostických testů založených na sekvenování nové generace
- 02/20/2015: Optimalizace regulačního dohledu FDA nad diagnostickými testy sekvenování nové generace Veřejný seminář