Mezi lidskými neisseriemi a příbuznými druhy redukují dusičnany tři druhy – N. mucosa, M. catarrhalis a K. denitrificans. Dusičnanový redukční test je kritickým testem pro rozlišení N. gonorrhoeae a K. denitrificans, zejména pokud se kmeny K. denitrificans v barvených nátěrech jeví jako gramnegativní diplokoky.
Princip
Bakteriální druhy lze rozlišit na základě jejich schopnosti redukovat dusičnany na dusitany nebo dusíkaté plyny. Z čeledi Neisseriaceae lidského původu redukují dusičnany kmeny Neisseria mucosa, Moraxella catarrhalis a Kingella denitrificans. Kmeny M. catarrhalis a K. denitrificans byly chybně identifikovány jako N. gonorrhoeae. Test redukce dusičnanů umožňuje rozlišit mezi těmito druhy, které jsou nitrát pozitivní, a N. gonorrhoeae (nitrát negativní). Redukce dusičnanů může být u některých druhů spojena s anaerobní respirací.
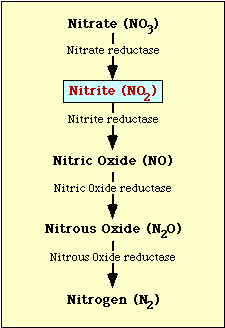
Biochemická cesta, která se podílí na redukci dusičnanů, je znázorněna na obrázku 1. Dusičnany se redukují na dusitany, které se pak mohou redukovat na oxid dusnatý, oxid dusný nebo dusík (obrázek 1).
Obrázek l. Dráha redukce dusičnanů.
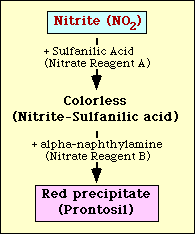
Test redukce dusičnanů je založen na detekci dusitanů v médiu po inkubaci s organismem. Pokud je dusitan v médiu přítomen, reaguje s kyselinou sulfanilovou (dusičnanové činidlo A) za vzniku bezbarvého komplexu (dusitan-sulfanilová kyselina). Tento komplex pak vytvoří červenou sraženinu (prontosil), když se k testu přidá dusičnanové činidlo B (alfa-naftylamin), jak je znázorněno na obrázku 2.
Obrázek 2. Schematické znázornění detekce dusitanů v médiu.
Červené zbarvení se v médiu vytvoří pouze tehdy, když jsou v médiu přítomny dusitany. Absence červeného zbarvení v médiu po přidání kyseliny sulfanilové a alfa-naftylaminu znamená pouze to, že dusitany nejsou v médiu přítomny. Pro toto pozorování mohou existovat dvě vysvětlení.
- Dusičnany nemusely být redukovány; kmen je dusičnanově negativní.
- Dusičnany mohly být redukovány na dusitany, které pak byly zcela redukovány na oxid dusnatý, oxid dusný nebo dusík, který nereaguje s činidly, která reagují s dusitany; kmen je dusičnanově pozitivní.
Každé testovací médium, které po přidání dusičnanových činidel poskytne negativní výsledek, musí být dále testováno, aby se určilo, která z obou interpretací je správná.
Úspěšný test redukce dusičnanů závisí na provedení testu za správných podmínek.
- Reakce proběhne nejlépe, pokud základní médium podporuje růst organismu. Ačkoli však některé druhy Neisserií nerostou dobře v bujónovém médiu, lze test redukce dusičnanů úspěšně provést na médiu, které nepodporuje růst, a to tak, že se médium silně naočkuje, aby se zajistilo dostatečné množství předtvořeného enzymu pro průběh reakce.
- K nitrátové reakci dochází pouze za anaerobních podmínek. Médium obsahující dusičnany se dávkuje do zkumavek tak, aby byl poměr povrchu k hloubce nízký, což omezuje difúzi kyslíku do média, např. 5 ml média se dávkuje do zkumavky o průměru 13 mm. Neisseria a příbuzné druhy využívají kyslík v médiu a rychle vytvářejí anaerobní podmínky, které jsou ideální pro redukci dusičnanů.
Test redukce dusičnanů se provádí v médiu obsahujícím 0,2 % dusičnanu draselného. Médium se silně naočkuje čistou kulturou podezřelého organismu a inkubuje se při teplotě 35 °C až 36,5 °C po dobu 48 hodin v inkubátoru s přídavkem oxidu uhličitého nebo bez něj.
Redukce dusičnanů se zjišťuje pomocí Griessových Llosvayových činidel, kyseliny sulfanilové a alfa-naftylaminu. Kyselina sulfanilová (dusičnanové činidlo A) se přidá do inkubační směsi a vytvoří komplex (dusitan-sulfanilová kyselina) s veškerými dusitany přítomnými v médiu. Když se do inkubovaného média přidá alfa-naftylamin (dusičnanové činidlo B), vytvoří se červená sraženina (prontosil) s jakýmkoli komplexem dusitan-sulfanilové kyseliny přítomným v médiu.
Organismus může být označen jako nitrát-pozitivní, pokud se v médiu po přidání dusičnanových činidel A a B vytvoří červené zbarvení, které naznačuje, že organismus redukoval dusičnany na dusitany.
Nepřítomnost červeného zbarvení po přidání obou činidel neznamená automaticky, že organismus není schopen redukovat dusičnany. Kmeny mohly redukovat dusičnany na dusitany a poté zcela redukovat dusitany na dusíkaté plyny, které nejsou po přidání dusičnanových činidel A a B do média detekovány. Pokud médium po přidání kyseliny sulfanilové a alfa-naftylaminu nezmění barvu, přidá se do inkubovaného média malé množství („hrot nože“) zinkového prachu. Zinkový prach bude chemicky katalyzovat redukci dusičnanů na dusitany. Pokud tedy dusičnany nebyly redukovány organismy, tj. jsou dusičnanově negativní, budou redukovány zinkovým prachem a do 15 minut se v inkubovaném médiu vytvoří červená barva. Pokud se v inkubovaném médiu po přidání zinkového prachu nevyvine žádné zbarvení, organismy nejen zredukovaly dusičnany na dusitany, ale zredukovaly dusitany na dusíkaté plyny; tyto organismy jsou rovněž dusičnany pozitivní.
Ačkoli se dusičnanové médium dodává s obrácenými Durhamovými zkumavkami pro zjištění produkce plynů, produkce plynů se u druhů Neisseria nezaznamenává. Ačkoli některé druhy mohou redukovat dusičnany nad rámec dusitanů na dusíkaté plyny, plyn se ve zkumavce nemusí hromadit. Hromadění plynu závisí na rychlosti jeho produkce. Pokud je plyn produkován velmi pomalu, může se rozpouštět v médiu a nehromadit se v Durhamově zkumavce.
Požadavky na vzorek
Optimální vzorek: Čistá kultura podezřelého gramnegativního, oxidáza-pozitivního diplokoka (Neisseria spp. nebo M. catarrhalis) na čokoládovém agaru inkubovaném v atmosféře obohacené oxidem uhličitým při 35C až 36,5C po dobu 18 až 24 hodin.
Nepřijatelný vzorek:
Kultury izolátů na čokoládovém agaru inkubované v atmosféře obohacené oxidem uhličitým při 35C až 36,5C po dobu delší než 24 h.
Kompromitující faktory ovlivňující výsledky testu:
- Testovací médium musí být inokulováno dostatečně silně, aby mohlo dojít k reakci s předem vytvořenými enzymy. Nedostatečné inokulum nemusí umožnit organismům spotřebovat kyslík a vytvořit anaerobní podmínky, za kterých může dojít k redukci dusičnanů.
- Příliš velké množství zinkového prachu přidaného do inkubované zkumavky může mít za následek velmi rychlou redukci dusičnanů mimo dusitanů na dusíkaté plyny, takže dusitany nejsou detekovány.
Stabilita vzorku: Detekce redukce dusičnanů u Neisseria a příbuzných druhů je závislá na přítomnosti předem vytvořených enzymů.
- Testy by se měly provádět pouze s inokulem odebraným z 24hodinových kultur.
- Nitrátové médium by mělo být inokulováno do 30 min. po vyjmutí kultury z inkubátoru; delší vystavení kultury při pokojové teplotě může mít za následek snížení enzymové aktivity.
Médium/reagencie
Médium: Difco), 25,0 g
Dusičnan draselný, 2,0 g
Destilovaná voda, 1000,0 ml
- Složky rozpusťte v destilované vodě; roztok upravte na pH 7.0.
- Dávkujte 5 ml alikvotů bujónu do zkumavek 16 x 100 mm s plynovými vložkami (Durhamovy zkumavky, 6 x 50 mm).
- Autoklávujte 15 min při 121C.
Uchovávejte médium při teplotě 4C až 10C (v chladu) až do použití. Před inokulací médium předehřejte na pokojovou teplotu.
Reagencie: Roztok kyseliny sulfanilové (dusičnanové činidlo A): 0,8 % v 5N kyselině octové
Chemický název: Kyselina 4-aminobenzensulfonová
Dusičnanové činidlo A skladujte při teplotě 15C až 30C (pokojová teplota) až 3 měsíce ve tmě. Činidla mohou být skladována v tmavě hnědých skleněných nádobách; lahve mohou být zabaleny do hliníkové fólie, aby byla zajištěna tma.
Roztok alfa-naftylaminu (dusičnanové činidlo B): 0,6 % v 5N kyselině octové
Chemický název: N,N-dimethyl-1naftylamin
Dusičnanové činidlo B skladujte při teplotě 2C až 8C (v chladu) až 3 měsíce, ve tmě. Činidla lze skladovat v tmavě hnědých skleněných nádobách; lahvičky lze zabalit do hliníkové fólie, aby byla zajištěna tma.
Prášek zinku, činidlo: Skladujte při pokojové teplotě (15C až 30C)
Upozornění: Kyselina octová je žíravá. Při styku s kůží může způsobit puchýře a popáleniny. V případě kontaktu okamžitě vypláchněte oči a kůži velkým množstvím vody (po dobu nejméně 15 min.)
Kontrola kvality/zkušební postup
QC kmeny:
- Kontrola pozitivní na nitrátreduktázu: Kingella denitrificans, CDC 10,236
- Kontrola negativní pro reduktázu dusičnanů: Neisseria gonorrhoeae, ATCC 43069
QC kmeny se uchovávají při -70C v roztoku tryptického sójového bujónu obsahujícího 20% glycerol. Reakce kontrolních kmenů by měly být potvrzeny v době přípravy zmrazených zásob. Kontrolní kmeny mohou být skladovány při -70C po dobu až 2 let.
Postup:
Kontrolní kmeny se testují stejným způsobem jako klinické izoláty. Kmeny QC by měly být po počáteční kultivaci ze zmrazeného vzorku před provedením testu alespoň jednou subkultivovány. Klinické izoláty mohou být subkultivovány ze selektivního média nebo purifikovaných subkultur. Ujistěte se, že jsou kultury čisté.
- Rozmrazte lahvičky s kontrolními kmeny uchovávanými při -70C.
- Vytáhněte na destičky čokoládového agaru nebo doplněného GC agaru pro izolaci. Inkubujte při 35C až 36,5C v atmosféře obohacené oxidem uhličitým po dobu 18 až 24 h.
-
Pomocí sterilního tamponu připravte těžkou suspenzi dobře izolovaných kolonií z čisté kultury izolátu inkubovaného na čokoládovém médiu při 35C až 36C.5 C v atmosféře obohacené oxidem uhličitým po dobu 18 až 24 h. Naočkujte testovací médium tak, aby vznikl silný zákal.
Poznámka: Kmeny N. gonorrhoeae a některé další Neisseria spp. nemusí na tomto médiu růst. Reakce tedy může být závislá na předem vytvořeném enzymu.
- Inkubujte inokulované médium a kontrolní zkumavku s neinokulovaným médiem při teplotě 35 C až 36,5 C v atmosféře obohacené oxidem uhličitým po dobu 48 h.
-
Po 48 h inkubace přidejte pomocí Pasteurovy pipety do každé zkumavky 5 kapek činidla č. A a následně 5 kapek činidla č. B.
-
Na konci inkubace přidejte do každé zkumavky 5 kapek činidla č. B. Dobře protřepejte zkumavku, aby se činidla promíchala s médiem.
Zkoumejte suspenzi podle růžovočerveného zbarvení, které by se mělo objevit během několika minut, pokud je médium ještě teplé. Reakce může trvat o něco déle, pokud je médium při přidávání činidel studené.
Pokud se suspenze zbarví růžově červeně před přidáním práškového Zn, je rekce pozitivní a test je dokončen. Neprovádějte krok 4.
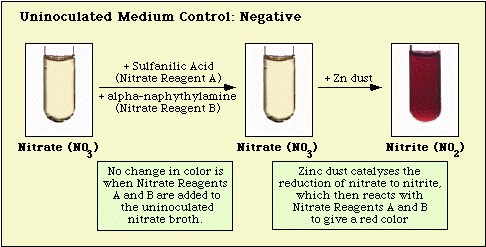
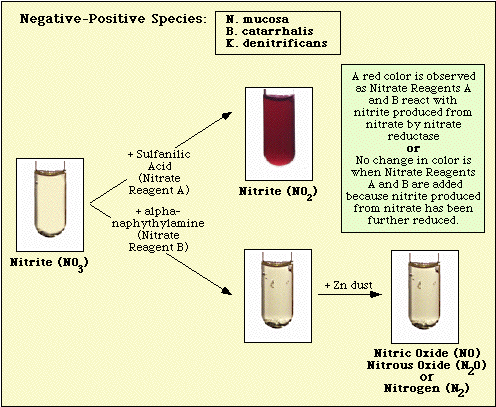
Reakce pozorované s kontrolním neočkovaným médiem a izoláty negativními na dusičnany a pozitivními na dusičnany jsou znázorněny na obrázku 3, obrázku 4 a obrázku 5.
-
Pokud je suspenze po přidání činidel A a B bezbarvá, přidejte do média malé množství (4 až 5 mg; „hrot ostrého nože“) zinkového prachu. Zkumavku silně protřepejte a nechte ji 10-15 min stát při pokojové teplotě.
Pokud médium zůstane po přidání Zn prášku bezbarvé, je výsledek testu pozitivní.
Pokud médium po přidání Zn prášku zrůžoví, je výsledek negativní. - Odečtěte a zaznamenejte výsledky.
Obrázek 3: Výsledek testu je pozitivní. Reakce pozorovaná s neinokulovaným dusičnanovým médiem.
Obrázek 4: Reakce pozorovaná s neinokulovaným dusičnanovým médiem. Reakce pozorovaná s dusičnanově negativními druhy.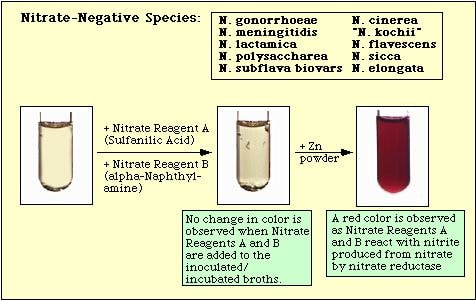
Obrázek 5. Reakce pozorované u nitrát-pozitivních druhů.
Rozpis kontroly kvality:
- Kontrola kvality nitrátreduktázy se provádí každý den, kdy se testují klinické izoláty.
Problémy & Řešení
Test na redukci dusičnanů může dávat falešně negativní nebo falešně pozitivní výsledky, pokud není médium vyrobeno přesně nebo test není proveden přesně. Reakce v tomto testu závisí na řadě faktorů.
- Nezjištění růžového zbarvení v kontrolní zkumavce s neočkovaným médiem po přidání Zn prachu může být způsobeno (1) tím, že médium neobsahuje dusičnany, nebo (2) přidáním příliš velkého množství zinečnatého prachu, který katalyzoval redukci dusičnanů nad dusitany na dusíkaté plyny. Nejjednodušším řešením je získání většího množství dusičnanového média, které zajistí přidání dusičnanů do základního média. Případně naočkujte médium pozitivním kontrolním kmenem, ale testujte reakci po kratší inkubační době; kmeny N. mucosa budou vytvářet pozitivní dusitanovou reakci po několika hodinách inkubace. Pokud se potvrdí, že médium obsahuje dusičnany, opakujte test, dokud neurčíte správné množství zinkového prachu, které je třeba přidat. Je velmi důležité zjistit, kolik zinkového prachu se má do testu přidat. Přidání příliš velkého množství zinkového prachu může mít za následek falešně pozitivní výsledek.
- Pokud je po přidání dusičnanových činidel A a B do média zjištěno růžové zbarvení v kontrole neočkovaného média, je médium kontaminováno dusitany. Jediným řešením je získat novou šarži média, které není kontaminováno dusitany.
- V médiu obsahujícím dusičnany by k selhání pozitivní reakce pozitivního kontrolního kmene Kingella denitrificans došlo pouze v případě, že kmen není K. denitrificans. Překontrolujte identitu pozitivního kontrolního kmene. Vyberte novou kulturu kontrolního kmene a test opakujte. Podobně, pokud je pozitivní nitrátreduktázový test získán s negativním kontrolním kmenem N. gonorrhoeae, buď negativní kontrolní kmen není N. gonorrhoeae, nebo je kultura kontaminována nitrátpozitivním organismem. Překontrolujte čistotu a identitu gonokokového referenčního kmene. Opakujte test s čistou kulturou potvrzené kultury N. gonorrhoeae.
- Dusičnanově redukční reakce ukazuje schopnost organismů redukovat dusičnany, což je reakce, která probíhá pouze za anaerobních podmínek; reakce neprobíhá, pokud organismy dostávají trvalý přísun kyslíku. Reakce tedy nemusí probíhat v nehybných kulturách (zejména pomalu rostoucích druhů), v nichž je médium rozloženo v mělkých vrstvách, které umožňují difúzi kyslíku do média. Zkoušku, zda je v médiu přítomen kyslík, lze provést přidáním kapky oxidačního činidla do média. Pokud se médium zbarví do fialova, obsahuje kyslík a redukční reakce dusičnanů nemusí proběhnout. Pokud médium zůstane bezbarvé, médium neobsahuje kyslík a může dojít k testu redukce dusičnanů. Bylo zjištěno, že buňky N. gonorrhoeae spotřebovávají kyslík rychle, pokud je do média naočkováno dostatečné množství buněk. Pokud se po přibližně 1 až 2 hodinách inkubace přidá oxidační činidlo, zůstane médium čiré. Protože oxidační činidlo zabíjí gonokoky přítomné v médiu, médium postupně zfialoví, počínaje horní částí zkumavky, jak kyslík difunduje do média. Pokud je médium dávkováno do zkumavek jiných než výše navržených rozměrů, zajistěte, aby poměr plochy povrchu a hloubky byl alespoň stejný nebo menší než výše navržené rozměry. Pokud je průměr zkumavky, do které je médium dávkováno, větší, než je popsáno výše, použijte větší objem média, aby byl zachován stejný poměr plochy povrchu a hloubky.
-
Dusičnanové redukční reakce nemusí proběhnout, pokud médium, ve kterém se zkouška provádí, neumožňuje normální růst organismu. Zkouška však může být provedena v médiu, které nepodporuje růst organismů, pokud je inokulum dostatečně husté, aby předem vytvořené enzymy mohly vyčerpat stávající zásobu kyslíku a redukovat dusičnany rychlejším tempem, než jakým kyslík difunduje do média.
Poznámka: Chcete-li zkontrolovat, zda byl kyslík z média odstraněn, přidejte 2 až 3 kapky oxidázového činidla do duplikátu inokulovaného média. Pokud byl kyslík z média dostatečně odstraněn, oxidační činidlo nezfialoví okamžitě. Pokud médium obsahuje rozpuštěný kyslík, oxidázové činidlo zfialoví. Všimněte si také, že zkoušku redukce dusičnanů lze provést v médiu, do kterého bylo přidáno oxidační činidlo.
- Při přidání činidla A do zkušebního média vytvoří dusitany vzniklé v důsledku redukce dusičnanů komplex s kyselinou sulfanilovou, který vytvoří červenou sraženinu s alfa-naftylaminem v činidle B. Přítomnost červeného zbarvení ve zkušebním médiu ukazuje, že dusitany jsou přítomny v důsledku redukce dusičnanů. Nepřítomnost červeného zbarvení po přidání činidel A a B však nemusí nutně znamenat, že dusičnany nebyly redukovány. Nevznik červeného zbarvení může znamenat, že 1) dusičnany nebyly redukovány, nebo 2) že dusitany, které vznikly v důsledku redukce dusičnanů, byly samy redukovány na dusíkaté plyny. Chcete-li zjistit, zda byl dusitan redukován, vložte do inkubační směsi malé množství zinečnatého prachu, pokud je po přidání činidel A a B bezbarvá. Zinečnatý prach katalyzuje redukci dusičnanů na dusitany; v médiu, které stále obsahuje neredukované dusičnany, by se měla vyvinout červená barva. Je však důležité nepřidat příliš mnoho zinečnatého prachu; nadbytek zinečnatého prachu bude katalyzovat redukci dusitanů vzniklých z tohoto dusičnanu, což bude mít za následek bezbarvé médium a nesprávnou interpretaci testu jako pozitivního (falešně pozitivní výsledek).
- Pozitivní dusičnanový reduktázový test získaný s negativním kontrolním kmenem, N. gonorrhoeae, po přidání zinečnatého prachu znamená, že dusičnany byly redukovány nad dusitany, pravděpodobně v důsledku přidání příliš velkého množství zinečnatého prachu do testu. Test opakujte a dbejte na to, abyste přidali jen velmi málo zinkového prachu. Růžové zbarvení, které naznačuje, že organismus neredukoval dusičnany, může trvat 10 až 15 minut. Nepřidávejte více zinkového prachu! Počkejte, až se barva rozvine. Pokud se do 30 min nevyvine žádná barva, interpretujte test jako pozitivní.
Omezení testu
Pokud je test proveden správně a kontrolní kmeny kvality poskytují odpovídající výsledky, neměl by mít tento test žádná omezení. Je třeba dbát na to, aby všechny složky testu byly provedeny správně .
Není možné provést identifikaci rodu nebo druhu pouze na základě testu redukce dusičnanů.
Výsledky, interpretace a hlášení
Isoláty mohou být hlášeny jako nitrát-pozitivní, pokud je v inokulovaném médiu po přidání činidel A a B zjištěn dusitan (růžové zbarvení) nebo pokud po přidání zinkového prachu není v médiu zjištěno žádné zbarvení.
Isoláty lze vykázat jako nitrát-negativní, pokud po přidání činidel A a B není zjištěn dusitan (žádná změna barvy) nebo pokud se po přidání zinkového prachu do inokulovaného média objeví růžové zbarvení.
Bibliografie
Knapp JS, Clark VL. Anaerobní růst Neisseria gonorrhoeae spojený s redukcí dusitanů. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Průvodce určováním rodů bakterií. The Williams & Wilkins Co, Baltimore, MD.
.