Mechanické komplikace akutního infarktu myokardu (AMI) jsou defekt komorového septa (VSD), ruptura nebo dysfunkce papilárního svalu, ruptura volné stěny srdeční, komorové aneuryzma, dynamická obstrukce výtokového traktu (OT) levé komory (LK) a selhání pravé komory (PK). Všechny tyto stavy mohou potenciálně vést k selhání LK s kardiogenním šokem.
Důkladné poznání mechanických komplikací AMI a jejich rizikových faktorů může lékařům pomoci při včasném stanovení diagnózy. Pro příznivé výsledky pacientů je nutná rychlá diagnóza s vhodnou medikamentózní terapií a včasná chirurgická intervence. Mezi důležité faktory nemocniční úmrtnosti na mechanické komplikace IM patří pokročilý věk, kardiogenní šok a kardiorespirační selhání.
Ruptura volné stěny komory
VFWR je nejzávažnější komplikací AMI. VFWR je obvykle spojena s velkými transmurálními infarkty a předchozím rozšířením infarktu. Je nejčastější příčinou úmrtí, druhou po selhání LK, a představuje 15-30 % úmrtí spojených s AMI. Nesporně nejkatastrofálnější z mechanických komplikací, VFWR, vede k akutnímu hemoperikardu a úmrtí na srdeční tamponádu.
Celková incidence VFWR se pohybuje mezi 0,8-6,2 %. Výskyt této komplikace se v průběhu let snížil díky lepší kontrole 24hodinového systolického krevního tlaku; zvýšenému používání reperfuzní léčby, beta-blokátorů a inhibitorů ACE a sníženému používání heparinu .
Údaje z Národního registru infarktu myokardu (NRMI) ukázaly zvýšený výskyt nemocniční mortality u pacientů, kteří dostali trombolytickou léčbu (12,1 %), než u pacientů, kteří ji nedostali (6,1 %). Ve studii Thrombolysis in Myocardial Infarction Phase II (TIMI II) zemřelo 16 % pacientů na srdeční rupturu do 18 hodin od zahájení léčby. U pacientů, kteří podstoupili perkutánní transluminální koronární angioplastiku (PTCA), byl výskyt ruptury volné stěny nižší než u pacientů, kteří dostávali trombolytickou léčbu.
Rizikové faktory pro VFWR zahrnují pokročilý věk nad 70 let, ženské pohlaví, žádný předchozí infarkt, Q vlny na EKG, hypertenzi v počáteční fázi STEMI, užívání kortikosteroidů nebo NSAID a fibrinolytickou léčbu více než 14 hodin po vzniku STEMI. U pacientů s anamnézou anginy pectoris, předchozím AMI, mnohočetným koronárním onemocněním a chronickým srdečním selháním je pravděpodobnost vzniku VFWR LK nižší než u ostatních, protože u nich dochází k rozvoji kolaterál a ischemické prekondicionace.
Klinický obraz VFWR
VFWR jsou dramatické; projevují se akutně nebo příležitostně subakutně jako pseudoaneuryzmata; a nejčastěji postihují přední nebo boční stěnu LK. Většina VFWR se objevuje během prvního týdne po AMI.
Becker et al klasifikovali následující 3 typy VFWRs :
-
Typ I – náhlé štěrbinovité natržení, které je často spojeno s předními infarkty a které se objevuje časně (do 24 hod.)
-
Typ II – přední infarkty. eroze infarktovaného myokardu na hranici mezi infarktem a životaschopným myokardem
-
Typ III – časný vznik aneuryzmatu korelující se staršími a silně rozšířenými infarkty
Typ III se obvykle objevuje později než ruptury typu I nebo typu II. Trombolytická léčba urychluje vznik srdeční ruptury u VFWR typu I a typu II podle Beckera. U těžce rozšířených infarktů (typ III) trombolytická léčba snižuje výskyt srdeční ruptury.
Pseudoaneuryzma vzniká, když přilehlý perikard a hematom uzavírají rupturu nebo perforaci myokardu. Stěna pseudoaneuryzmatu se nejčastěji zobrazuje jako aneuryzmatický výdutě, který komunikuje s dutinou LK pomocí úzkého krčku. Tato stěna je tvořena perikardem a organizovaným trombem a/nebo hematomem. Postrádá myokardiální elementy, zatímco pravé aneuryzma má všechny elementy původní myokardiální stěny a relativně širokou bázi. Pseudoaneuryzma může mít různou velikost a je u něj vysoké riziko ruptury.
Klinické projevy VFWR se liší v závislosti na ostrosti, lokalizaci a velikosti ruptury. U pacientů s akutní VFWR se vyskytuje silná bolest na hrudi, náhlá elektromechanická disociace nebo asystolie, hemodynamický kolaps a případně smrt. Přibližně u třetiny pacientů je průběh subakutní a projevují se u nich příznaky jako synkopa, hypotenze, šok, arytmie a prolongovaná a opakující se bolest na hrudi.
Diagnostika VFWR
Včasná diagnostika VFWR a intervence jsou pro přežití pacientů rozhodující. Vysoký index podezření je nutný, pokud se u pacientů s AMI objeví silná bolest na hrudi, šok nebo arytmie a náhlý rozvoj elektromechanické disociace. EKG známky hrozící VFWR mají omezenou specificitu, ale zahrnují sinusovou tachykardii, defekt intraventrikulárního vedení a přetrvávající nebo opakované elevace úseku ST.
Diagnostickým nástrojem volby je echokardiografie. Klíčovým diagnostickým nálezem je středně velký až velký perikardiální výpotek s klinickými a echokardiografickými známkami hrozící perikardiální tamponády. U pacientů se srdeční tamponádou a elektromechanickou disociací zvyšuje středně velký až velký perikardiální výpotek riziko úmrtí. Pacienti bez počáteční srdeční tamponády by sice měli být sledováni s nižším rizikem úmrtí, ale přesto by u nich mohlo dojít k pozdní ruptuře. Nepřítomnost perikardiálního výpotku na echokardiografii má vysokou negativní prediktivní hodnotu. Pokud je u pacientů podstupujících mechanickou ventilaci omezena možnost získání transtorakálního echokardiogramu, může při potvrzení VFWR pomoci transezofageální echokardiografie.
MRI poskytuje vynikající kvalitu obrazu a umožňuje identifikovat místo a anatomii komorového pseudoaneuryzmatu (tj. prasklé LK zadržované perikardem s uzavřenou sraženinou). MRI má však v akutní situaci omezené využití z důvodu časové náročnosti a nepřenosnosti zobrazovacích jednotek.
Léčba VFWR
Nejdůležitější preventivní strategií je časná reperfuzní léčba, přičemž preferovanou metodou je perkutánní koronární intervence (PCI). Fibrinolytická léčba je spojena s celkovým snížením rizika VFWR; její použití po více než 14 hodinách od vzniku STEMI však může zvýšit riziko časné ruptury.
Standardní léčbou VFWR je urgentní chirurgické řešení po dosažení hemodynamické stability. Pacienti mohou nejprve potřebovat intravenózní tekutiny, inotropní látky a urgentní perikardiocentézu.
Pifarré a spolupracovníci doporučili nasazení intraaortální balónkové pumpy ke snížení systolického afterloadu a zlepšení diastolické perfuze myokardu.
Bylo použito několik chirurgických technik, včetně infarktomie, přilepení biologickými lepicími záplatami z polyethylentereftalátových polyesterových vláken (Dacron; DuPont, Wilmington, DE) nebo polytetrafluorethylenové fluoropolymerové pryskyřice (Teflon; DuPont); a použití záložních stehů bez infarktomie.
Úmrtnost je značně vysoká a do značné míry závisí na předoperačním hemodynamickém stavu pacienta. Včasná diagnóza, rychlé zavedení výše popsaných opatření k dosažení hemodynamické stability a rychlé chirurgické řešení mohou zlepšit míru přežití. Sledování randomizované studie Acorn prokázalo dlouhodobé zlepšení struktury a funkce levé komory po operaci mitrální chlopně po dobu až 5 let. Tyto údaje poskytují důkazy podporující opravu mitrální chlopně v kombinaci se zařízením Acorn CorCap u pacientů s neischemickým srdečním selháním s těžkou dysfunkcí levé komory, kteří byli medikamentózně optimalizováni, ale přesto zůstávají symptomatičtí s významnou mitrální regurgitací.
Ruptura komorového septa
VSR je vzácnou, ale život ohrožující komplikací AMI. I přes optimální medikamentózní a chirurgickou léčbu mají pacienti s VSR vysokou nemocniční mortalitu. V předtrombolytické éře se VSR vyskytovaly u 1-3 % jedinců s infarktem myokardu. S nástupem trombolytické léčby se incidence snížila (na 0,2-0,34 %) díky zlepšení reperfuze a záchrany myokardu. Bimodální distribuce VSR je charakterizována vysokým výskytem v prvních 24 hodinách, s dalším vrcholem ve dnech 3-5 a zřídka více než 2 týdny po AMI.
U pacientů, kteří dostávali trombolytika, byl medián doby od vzniku příznaků AMI do ruptury septa 1 den ve studii Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) a 16 hodin ve studii Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock? (SHOCK).
Rizikové faktory ruptury septa zahrnují pokročilý věk (>65 let), ženské pohlaví, onemocnění jedné cévy, rozsáhlý infarkt a špatný kolaterální oběh septa. Před příchodem trombolytik byly rizikovými faktory pro VSR hypertenze a absence anamnézy anginy pectoris. Rozsáhlá velikost infarktu a postižení RV jsou dalšími známými rizikovými faktory ruptury septa.
U pacientů s AMI bez reperfuze dochází k rozvoji koagulační nekrózy během 3-5 dnů po infarktu. Neutrofily migrují do nekrotické zóny a podléhají apoptóze, uvolňují lytické enzymy a urychlují rozpad nekrotického myokardu. Někteří pacienti mají infarkty s velkými intramurálními hematomy, které se disekují do tkáně a vedou k časné ruptuře septa. Velikost ruptury septa se pohybuje od několika milimetrů až po několik centimetrů.
VSR se podle délky, průběhu a umístění dělí na jednoduché nebo komplexní. U jednoduché ruptury septa je perforace na stejné úrovni na obou stranách septa a napříč septem je přítomna přímá průchozí komunikace. Komplexní ruptura septa je charakterizována rozsáhlým krvácením s nepravidelnými, serpiginózními cestami v nekrotické tkáni.
Ruptura septa se nejčastěji vyskytuje u pacientů s rozsáhlým předním infarktem v důsledku okluze tepny LAD způsobující rozsáhlé infarkty septa. Tyto infarkty jsou spojeny s elevacemi úseku ST a vlnami Q v dolních svodech (II, III, aVF), a tyto EKG změny jsou proto častěji pozorovány u ruptur septa. Tyto ruptury jsou obvykle apikální a jednoduché.
Ruptura septa u pacientů s dolním infarktem se vyskytuje relativně zřídka. Tyto ruptury zahrnují bazální inferiorní septum a jsou často komplexní.
Klinický obraz VSR
Příznaky VSR komplikující AMI zahrnují bolest na hrudi, dušnost, hypotenzi, biventrikulární selhání a šok během hodin až dnů. U pacientů se často objevuje nový, hlasitý a drsný holosystolický šelest. Tento šelest je nejhlasitější podél dolní levé sternální hranice a je spojen s hmatným parasternálním systolickým vzrušením. RV a LV S3 gallops jsou běžné.
U pacientů s kardiogenním šokem komplikujícím rupturu septa může být obtížné identifikovat šelest a thrill. Naproti tomu pacienti s akutní MR mají často měkký systolický šelest na hrotu bez thrillu.
Diagnostika VSR
Echokardiografie s barevným průtokovým dopplerovským zobrazením je diagnostickým nástrojem volby pro identifikaci VSR. (Viz obrázek níže.) Jeho senzitivita a specificita je uváděna až 100 %. Kromě toho ji lze použít k následujícím účelům:
-
určit místo a velikost ruptury septa
-
zhodnotit LK a RV. funkce
-
Odhadněte systolický tlak v RV
-
Kvantifikujte levo-to-right shunt
K potvrzení diagnózy je obvykle nutná srdeční katetrizace, kvantifikovat stupeň levopravého zkratu, odlišit VSR od jiných stavů (např. mitrální regurgitace) a navíc zobrazit koronární tepny.
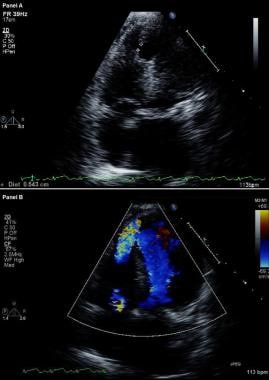 Komplikace infarktu myokardu. Modifikovaný dvourozměrný echokardiogram (nahoře) a barevný průtokový dopplerovský obraz (dole). Apikální čtyřkomorové zobrazení ukazuje porušení interventrikulárního septa a volnou komunikaci mezi komorami přes velký defekt apikálního septa komor u pacienta, který nedávno prodělal přední infarkt myokardu.
Komplikace infarktu myokardu. Modifikovaný dvourozměrný echokardiogram (nahoře) a barevný průtokový dopplerovský obraz (dole). Apikální čtyřkomorové zobrazení ukazuje porušení interventrikulárního septa a volnou komunikaci mezi komorami přes velký defekt apikálního septa komor u pacienta, který nedávno prodělal přední infarkt myokardu. U pacientů s VSR je při katetrizaci pravého srdce patrný vzestup saturace kyslíkem z pravé síně do RV; naproti tomu u pacientů s MR k žádnému vzestupu saturace kyslíkem nedochází. Přítomnost velkých V vln ve stopě plicního kapilárního zaklínění podporuje diagnózu těžké akutní MR.
K identifikaci místa ruptury komory lze použít také levostrannou ventrikulografii (viz Srdeční katetrizace ). Toto vyšetření je však obvykle zbytečné po provedení kvalitního echokardiografického a dopplerovského vyšetření.
Léčba VSR
Klíčem k léčbě VSR je rychlá diagnóza a agresivní přístup k hemodynamické stabilizaci, angiografii a operaci. Optimální přístup zahrnuje hemodynamickou stabilizaci s podáváním kyslíku a mechanickou podporu s použitím intraaortální balónkové pumpy, dále podávání vazodilatancií (ke snížení afterloadu, a tím i tlaku v LK a levopravého zkratu), diuretik a inotropních látek.
K definování koronární anatomie je nutná srdeční katetrizace; po ní následuje urgentní chirurgická oprava.
Ve studii 52 po sobě jdoucích pacientů s postinfarktovou rupturou komorového septa, která byla chirurgicky opravena, vyšetřovatelé zjistili, že 30denní mortalita byla 36 % (n = 19). Většina pacientů, kteří přežili méně než 30 dní, měla předoperační šokový stav. Vyšetřovatelé dospěli k závěru, že u pacientů s rupturou komorového septa je nutné předoperační zlepšení šokového stavu a agresivní koronární revaskularizace.
Medikamentózní léčba je určena pouze k dočasné stabilizaci před operací, protože stav většiny pacientů se rychle zhoršuje a při absenci chirurgického zákroku umírají. Ve studii GUSTO-I byla 30denní mortalita u pacientů s VSR, kteří podstoupili chirurgickou léčbu, nižší než u pacientů léčených medikamentózně (47 % vs 94 %), stejně jako jednoletá mortalita (53 % vs 97 %). Lemery et al uvádějí 30denní míru přežití 24 % u pacientů léčených medikamentózně ve srovnání se 47 % u pacientů léčených chirurgicky.
Pokyny American College of Cardiology/American Heart Association (ACC/AHA) pro léčbu pacientů s rupturou septa komplikující AMI zdůrazňují urgentní chirurgickou intervenci bez ohledu na jejich klinický stav. Chirurgická léčba ruptury septa zahrnuje následující prvky:
-
Prodlené zavedení hypotermického kardiopulmonálního bypassu
-
Přístup k ruptuře septa přes infarktovou oblast a vyříznutí všech nekrotických, drolivých okrajů septa a stěn komor, aby se zabránilo pooperačnímu krvácení, reziduálnímu defektu septa, nebo obojího
-
Rekonstrukce septa a stěn komor pomocí protetického materiálu a zachování geometrické konfigurace komor a srdeční funkce
Perkutánní uzávěr ruptury septa je relativně nový přístup, který se používá u vybraných pacientů jako alternativa chirurgické opravy nebo pro akutní stabilizaci kriticky nemocných pacientů. Perkutánní uzávěr však v současné době není na mnoha pracovištích dostupný a nejsou k dispozici žádné údaje o dlouhodobých výsledcích.
Několik studií neprokázalo vztah mezi perioperační mortalitou a souběžnou koronární revaskularizací (koronární bypass). Pacienti s kardiogenním šokem v důsledku ruptury septa mají nejhorší výsledky. Ve studii SHOCK byla nemocniční mortalita vyšší u pacientů s kardiogenním šokem v důsledku ruptury septa (87,3 %) než u pacientů s kardiogenním šokem ze všech ostatních příčin (59,2 % s čistým selháním LK a 55,1 % s akutní MR).
U pacientů, kteří přežili chirurgickou opravu, se uvádí, že míra recidivy nebo reziduálního defektu septa je přibližně 28 % a s tím spojená mortalita je vysoká.
Opětný chirurgický zákrok je indikován u pacientů, kteří mají klinické srdeční selhání nebo plicně-systémovou frakci vyšší než 2. U pacientů, kteří přežili chirurgickou opravu, je míra recidivy nebo reziduálního defektu septa vyšší než 2 %.
Akutní mitrální regurgitace
MR je častou komplikací AMI, která je důsledkem lokální a globální remodelace LK a která je nezávislým prediktorem srdečního selhání a úmrtí. MR se obvykle objevuje 7-10 dní po AMI, i když tento nástup se může lišit podle mechanismu vzniku MR. K ruptuře papilárního svalu, která má za následek MR, dochází během 1-14 dnů (medián 1 d).
Mírná až středně těžká MR je často klinicky němá a zjistí se při dopplerovské echokardiografii provedené v časné fázi AMI. V takových případech MR zřídka způsobuje hemodynamickou kompromitaci.
Speckle tracking a trojrozměrná echokardiografie se ukázaly jako důležité zobrazovací nástroje při hodnocení reverzní remodelace LK po operaci degenerativní regurgitace mitrální chlopně. Jemné regionální předoperační změny diastolické funkce septa a laterální stěny mohly být předoperačně identifikovány, což napomohlo optimalizaci načasování odeslání a rozpoznání potenciálních viníků jako ukazatelů recidivy onemocnění po mitrální reparaci.
Závažná akutní MR, která je důsledkem ruptury papilárních svalů nebo chordae tendineae, vede k náhlému zhoršení hemodynamiky s kardiogenním šokem. Je nutná rychlá diagnóza, hemodynamická stabilizace a rychlý chirurgický zákrok, protože akutní závažná MR je spojena s vysokou mírou úmrtnosti.
Uváděný výskyt MR se může lišit v důsledku několika faktorů, včetně použitých diagnostických metod, přítomnosti nebo nepřítomnosti srdečního selhání, uváděného stupně MR, typu poskytnuté léčby a doby od vzniku infarktu do vyšetření.
V průběhu studie GUSTO-I byl výskyt MR u pacientů, kteří dostávali trombolytickou léčbu, 1,73 %. Ve studii SHOCK, která zahrnovala pacienty s infarktem myokardu s kardiogenním šokem, byl zaznamenán 39,1% výskyt středně těžké až těžké MR. Kinn et al uvádějí, že reperfuze pomocí angioplastiky vedla k 82% poklesu výskytu akutní MR ve srovnání s trombolytickou léčbou (0,31 % vs 1,73 %).
Rizikovými faktory pro vznik MR jsou pokročilý věk, ženské pohlaví, velký infarkt, předchozí AMI, recidivující ischemie, mnohočetná ischemická choroba srdeční a srdeční selhání.
Několik mechanismů může způsobit MR po AMI. Nejčastěji uváděným mechanismem je ruptura papilárního svalu.
Tato ruptura se vyskytuje u 1 % pacientů s AMI a často se týká spíše posteromediálního papilárního svalu než anterolaterálního papilárního svalu, protože ten má jediné krevní zásobení oproti dvojímu zásobení. Ruptura papilárního svalu může vést ke klapání nebo prolapsu listů, což má za následek závažnou MR. Dysfunkce papilárního svalu v důsledku jizvení nebo opakované ischemie může rovněž vést k MR v subakutní a chronické fázi po infarktu; tento stav může spontánně odeznít.
Velké zadní infarkty způsobují akutní MR v důsledku asymetrické dilatace prstence a změněné funkce a geometrie papilárního svalu.
Klinický obraz MR
Pacienti s funkční mírnou nebo střední MR jsou často asymptomatičtí. Závažnost příznaků se liší v závislosti na funkci komor. Klinické příznaky akutní těžké MR zahrnují dušnost, únavu, nový apikální holosystolický šelest, bleskový plicní edém a šok.
Nový systolický šelest může být pouze časně až středně systolický, nikoli holosystolický. Může být měkký nebo dokonce chybět kvůli náhlému vzestupu tlaku v levé síni, který ve srovnání s chronickou MR snižuje tlakový gradient mezi levou síní a LK. Šelest je nejlépe slyšet na vrcholu spíše než na dolní levé sternální hranici a nezřídka je spojen s thrillem. Očekává se galop S3 a S4.
Diagnostika MR
Klinik se při diagnostice MR nebo hodnocení její závažnosti nemůže spoléhat na nový holosystolický šelest kvůli proměnlivému hemodynamickému stavu. U pacienta s AMI, který se dostaví s novým apikálním systolickým šelestem, akutním plicním edémem a kardiogenním šokem, je klíčem k diagnóze vysoký index klinického podezření na závažnou MR.
Rentgenografie hrudníku může v akutním stavu prokázat plicní edém bez klinicky významného zvětšení srdce.
Echokardiografie s barevným dopplerovským zobrazením průtoku je standardním diagnostickým nástrojem pro detekci MR. Transtorakální echokardiografie je preferovaným počátečním screeningovým nástrojem, ale transezofageální echokardiografie je neocenitelná při definování závažnosti a přesného mechanismu akutní MR, zejména pokud je podezření na rupturu papilárního svalu vysoké. U všech pacientů by měla být provedena srdeční katetrizace ke stanovení rozsahu a závažnosti onemocnění koronárních tepen.
Léčba MR
Pro příznivý výsledek je nezbytné stanovení hemodynamické stability, objasnění přesného mechanismu akutní MR a účelná léčba. Lékařská léčba zahrnuje snížení afterloadu pomocí diuretik, nitroprusidu sodného a nitrátů u pacientů, kteří nejsou hypotenzní.
U pacientů, kteří mají hemodynamický kompromis, by měla být rychle nasazena intraaortální balónková kontrapulzace. Tato intervence obvykle podstatně snižuje afterload a regurgitační objem a zlepšuje srdeční výdej v rámci přípravy na chirurgickou léčbu. Bez chirurgického řešení vede samotná medikamentózní léčba u pacientů s rupturou papilárního svalu k nedostatečnému hemodynamickému zlepšení a špatné krátkodobé prognóze.
Náhlá chirurgická intervence je léčbou volby u ruptury papilárního svalu. Chirurgické přístupy mohou zahrnovat opravu nebo náhradu mitrální chlopně. Při absenci nekrózy papilárního svalu zlepšuje oprava mitrální chlopně míru přežití více než náhrada mitrální chlopně. Tento rozdíl je dán tím, že subvalvulární aparát je obvykle zachován. Oprava mitrální chlopně také eliminuje komplikace spojené s nesprávnou funkcí protézy.
U pacientů s rozsáhlou nekrózou papilárního svalu a/nebo volné stěny komory je preferovanou metodou náhrada mitrální chlopně. V jedné studii bylo prokázáno, že koronární bypass (CABG) provedený v době operace zlepšuje krátkodobé i dlouhodobé přežití.
Jediná situace, kdy se lze bezpečně vyhnout urgentní operaci, je v případě intermitentní MR v důsledku recidivující ischemie. U těchto pacientů může být účinná úspěšná revaskularizace myokardu. Tento postup se provádí buď pomocí angioplastiky, nebo koronárního bypassu.
Dynamická LVOTO
Původně se předpokládalo, že je přítomna pouze u hypertrofické kardiomyopatie, ale různí badatelé uvádějí přítomnost dynamické LVOTO jako komplikaci akutní přední MR. Přítomnost dynamické LVOTO byla rovněž postulována jako jedna z etiologií ruptury myokardu.
Dynamická LVOTO je mechanicky způsobena kompenzační hyperkinezí bazálního a středního segmentu LK u pacientů s distálními infarkty LAD. Prediktory zvýšeného regionálního pohybu stěn v neinfarktových zónách jsou nepřítomnost vícecívního onemocnění, ženské pohlaví a vyšší průtok v cévě související s infarktem. Zvýšená kontraktilní síla bazálního myokardu způsobuje mitrální regurgitaci prostřednictvím Venturiho efektu. To má za následek zvýšený OTO, což vede k dalšímu snížení výdeje LK při již přítomné systémové hypoperfuzi.
Tento zvýšený LVOTO při poškozeném transmurálním myokardu vytváří dokonalé prostředí, ve kterém dochází ke zvýšení end-systolického intraventrikulárního tlaku, což vyvolává zvýšené napětí stěny oslabené, nekrotické infarktové zóny. Tato často fatální komplikace se nejčastěji vyskytuje u žen, starších pacientů (>70 let) a pacientů bez předchozího infarktu.
Klinický obraz LVOTO
Postižení pacienti mohou mít kromě typických příznaků AMI i obvyklé příznaky zvýšeného komplexu autonomních příznaků, jako jsou respirační tíseň, diaforéza a chladné, lepkavé končetiny.
Tito pacienti mohou rychle progredovat do kardiogenního šoku s těžkou ortopnoí, dušností a oligurií a mohou mít změněný mentální stav z mozkové hypoperfuze. Pacienti mohou mít nový systolický ejekční šelest, nový holosystolický šelest vyzařující do axily v důsledku systolického předního pohybu (SAM) mitrálního listu. Může být také přítomen S3 galop, plicní rales, hypotenze a tachykardie; tyto poslední fyzikální příznaky mohou v akutním stavu zcela chybět.
Transtorakální nebo transezofageální echokardiografie (TTE/TEE) je diagnostickým vyšetřením volby a může přesně charakterizovat hyperkinetický segment, LVOTO a SAM mitrálního lístku.
Léčba LVOTO
Zvažte snížení hyperkontraktility myokardu pomocí opatrného přidání beta blokády. Také pomalá objemová resuscitace pomocí augmentace afterloadu (fenyleferin) může zvýšit preload a snížit LVOTO a SAM. Nejlepší by bylo vyhnout se lékům zvyšujícím afterload. Měli bychom se také vyhnout vazodilatancím, inotropům a balónkovým pumpám, protože mohou zvýšit LVOTO.
Selhání RV
Často se vyskytuje v souvislosti s infarktem myokardu nižšího stupně, po infarktu myokardu je častá mírná dysfunkce RV; ve většině případů je však vliv na LK minimální.
Významná hypokineze RV nastává při proximálním uzávěru pravé kornatální tepny s malou kolaterálou z levostranného oběhu. Předpokládá se, že vzhledem k tomu, že RV je tenkostěnná a má nižší nároky na kyslík, dochází během celého srdečního cyklu ke koronární perfuzi, proto je rozsáhlý ireverzibilní infarkt vzácný.
Typické selhání RV se může projevovat hypotenzí (v důsledku nedostatečného předtížení LK) a distenzí jugulární žíly s volným plicním polem. Ačkoli je tato triáda klasicky popisována při selhání RV, v klinickém prostředí se s ní v čisté podobě setkáváme zřídka. U většiny pacientů je přítomen nízkovýkonový kardiogenní šok nebo selhání LK s přidruženými autonomními příznaky.
Přítomnost jugulárního žilního tlaku nad 8 cm H2O a Kussmaulova příznaku je vysoce senzitivní a specifická pro závažné RV selhání.
Příležitostně způsobuje pravolevé zkratování přes patentní foramen ovale přetrvávající hypoxemii. Mějte tuto zvláštní komplikaci na paměti.
Elektrokardiograficky se pacienti prezentují dolní elevací ST ve spojení s elevací ST ve svodu V4R. Rentgenový snímek hrudníku se obvykle jeví jako nevýrazný, bez žilní distenze horních laloků.
Diagnostika selhání RV
Velmi užitečná je dvojrozměrná (2D) echokardiografie a magnetická rezonance (MRI). Nejčastěji pomůže diagnózu upřesnit echokardiografie.
Swan-Ganzovy katetrizační nálezy obvykle svědčí pro vysoké tlaky v RV s nízkým PCWP.
Léčba selhání RV
Objemová resuscitace k udržení PCWP na úrovni 15 mmHg nebo kolem ní by mohla pomoci dočasně přechodným zvýšením preloadu RV. Ačkoli definitivní léčba zahrnuje obnovení koronárního oběhu. Ve vzácných případech závažného selhání RV je třeba zvážit mechanickou podporu oběhu pomocí asistenčních zařízení pro RV (AD), a to buď dočasně, nebo jako překlenovací léčbu při rozsáhlém biventrikulárním postižení.