Guanosintrifosfát (přesněji guanosin-5′-trifosfát nebo pro zjednodušení také běžně zkráceně GTP) je vysoce energetický nukleotid (nezaměňovat s nukleosidem), který se nachází v cytoplazmě nebo polymeruje za vzniku guaninové báze.
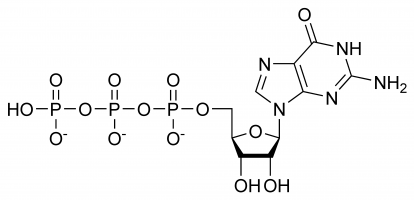
GTP má selektivní úlohy při tvorbě řetězců RNA, funguje jako molekula přenášející energii pro syntézu bílkovin, koenzym, předchůdce cGMP – molekula sekundárního posla nebo jako efektorová molekula. Poslední dvě možnosti se běžně projevují modulací G-proteinů. To vše je důsledkem jeho složité trojrozměrné struktury a množství různých chemických skupin, z nichž se skládá. Pro zjednodušení si ho proto můžeme představit jako malátnost různých funkčních skupin, které prakticky izolovaně vykonávají různé funkce (i když někdy se do toho zapojí i struktura, např. při interakci s enzymem a jiným substrátem), např. pouze trifosfát se podílí na uvolňování energie pro polymeraci, zatímco pouze guaninová báze se podílí na jeho deaminaci. Je důležité poznamenat, že seznam uvedený na začátku nevyčerpává jeho chemické interakce, ale je pouze ukázkou jeho různých schopností.
V GTP je ribózový cukr ústředním prvkem trojrozměrného uspořádání kovalentně vázaných molekul guaninu a trifosfátu. Tento monosacharid poskytuje hydroxylové skupiny pro kondenzační reakce a nukleofilní útoky, z nichž druhý je důležitý pro destrukci molekul RNA, a tedy regulaci genové exprese. Molekula guaninu a trifosfátu tvoří kovalentní vazby na atomech C’1, respektive C’5, je však možné, aby využívaly i jiné hydroxylové skupiny, pokud výsledná struktura nezpůsobuje kolizi. Z hlediska purinu se váže v důsledku kondenzační reakce na jeho 9’N, který byl předtím kovalentně vázán na atom vodíku. Protože guanin je purinová báze, řadí se spolu s adenintrifosfátem (ATP) mezi purinové trifosfáty a vzniká modifikací inosinmonofosfátu.
Obsah
- 1 Mylná představa: GTP, základní stavební prvek
- 2 Jeden z mnoha předchůdců bází RNA
- 3 GTP; bratranec univerzálního ATP
- 4 Zdroj signalizace
- 5 Odkazy
Mylná představa: GTP, základní stavební prvek
Játra jsou hlavním orgánem, který syntetizuje purinové a pyramidinové nukleotidy. Purinové nukleotidy (GTP a ATP) se syntetizují nejprve vytvořením inosinmonofosfátu z ATP, glutaminu, glycinu, CO2, aspartátu a mravenčanu. IMP
může být poté modifikován tak, aby vznikla jedna z molekul.
V případě tvorby GTP je IMP nejprve přeměněn na XMP pomocí IMP dehydrogenázy. Výsledná chemická a strukturní změna umožňuje působení GTP syntázy, která rychle přemění XMP na GMP. GMP však není vysoce energetická molekula, protože nemá trifosfát, takže je poté fosforylován nukleosidfosfátkinázami, čímž vzniká nejprve difosfát a nakonec trifosfát.
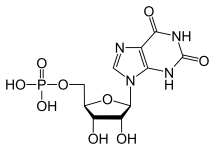
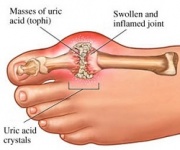
GTP je normálně katabolizován na nerozpustnou kyselinu močovou, která pak může vznikat v moči jako krystalky urátu sodného. Tento proces je považován za abnormální, pokud probíhá v synoviálních kloubech a jeho výsledkem je kyselina močová, která je pak přeměněna na škodlivý urát sodný nebo dihydrát pyrofosforečnanu vápenatého. Přítomnost těchto chemických látek umožňuje rozvoj zánětu a artritidy a kombinované příznaky vedou ke klasifikaci onemocnění jako dna. Dalším příkladem významu vhodného katabolismu purinových nukleotidů je těžká kombinovaná imunodeficience, která vede ke zničení základních B a T lymfocytů
Jeden z mnoha předchůdců bází RNA
Mezi RNA a DNA existuje několik rozdílů, ale hlavní rozdíl je ve struktuře nukleobází, které budují každý polymer. Nukleobáze RNA obsahují na svém ribózovém cukru 2’OH skupinu, která jim umožňuje být výrazně chemicky reaktivnější, katalytičtější a nestabilnější. Je důležité si uvědomit, že guanosintrifosfát se zabývá pouze tvorbou guaninové báze v RNA. Analogem GTP pro tvorbu guaninové báze v DNA je deoxyguanosintrifosfát. Tento trifosfát obsahuje deoxyribózový cukr bez
2’OH skupiny, díky čemuž je výrazně stabilnější – zabraňuje nukleofilním útokům, které by rozštěpily fosfodiesterové vazby mezi nukleobázemi. To je ideální, protože RNA by se měla po překladu do bílkoviny rozpadnout, zatímco DNA musí zůstat neporušená pro přenos genetické informace na dceřinou buňku.
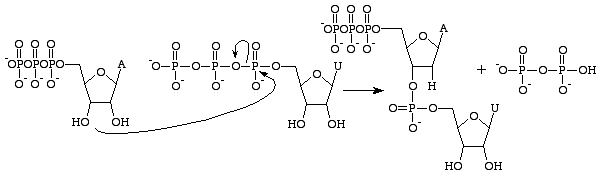
Guanosintrifosfát povede ke vzniku guaninové báze v důsledku rozštěpení anhydridové vazby a uvolnění alfa a gama fosfátů jako volných fosfátů. GMP pak vytvoří fosfodiesterovou vazbu s blízkou bází obsahující 3’OH skupinu a poskytne 3’OH skupinu pro další bázi RNA. K této reakci dochází pouze v případě, že protilehlou bází GMP je cytosin, se kterým může vytvářet vodíkové vazby, a její rychlost zvyšuje RNA polymeráza. RNA polymeráza nesrovnává trifosfáty. Pouze katalyzuje reakci, která nastane poté, co se tak stane nezávisle. Po katalýze je molekula součástí polynukleotidového řetězce a již není známa jako GTP, ale jako báze guanin.
GTP; bratranec univerzálního ATP
Základní mechanismus získávání energie ze štěpení anhydridové vazby je u všech trifosfátů stejný. Vysokého energetického stavu trifosfátů je dosaženo třemi různými mechanismy. První je způsoben odpudivými silami
na každé z fosfátových skupin. To přispívá k vysoké nestabilitě vázaných trifosfátů a vysoké „touze“ dosáhnout nižšího energetického stavu. Druhá příčina spočívá v rezonanční stabilizaci. Když se GTP
přemění na GDP, zvýší se množství možných pozic pro existující elektronové páry, což přispívá k větší stabilitě. Tento argument se potvrdí i při přeměně GDP na GMP. Třetí je způsoben nepříznivým entropickým účinkem, který má zvýšené množství fosfátů na konformaci molekul vody, které molekulu obklopují.
Protože je koncentrace GTP v cytoplazmě výrazně nižší než koncentrace ATP, využívá se pro specifické funkce v metabolických procesech buňky.
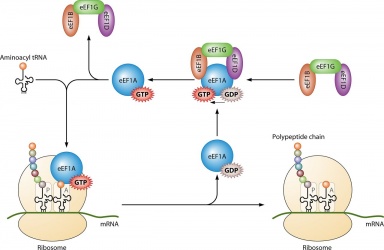
Jeho hlavní využití je při syntéze proteinů, když je spojen s IF2 při ribozomální iniciaci, Ef-Tu a Ef-G při prodlužování a ;RF3 při terminaci. Všechny molekuly GTP, které se spojí s uvedenými proteiny, se defosforylují, přičemž vzniká GDP a volný fosfát
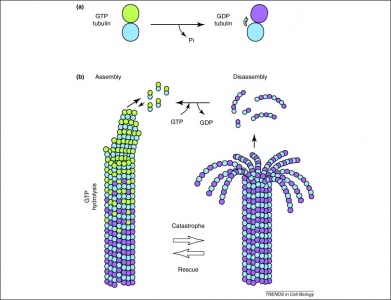
Kromě toho GTP využívají také dimery tubulinu při tvorbě mikrotubulů. Tubulinové dimery se skládají z tubulinu alfa a beta, z nichž každý má vazebná místa pro GTP. Protože beta tubulin existuje na plusovém konci vlákna, GTP je zde vždy hydrolyzován, když je k prodlužujícímu se polymeru přidán další dimer. Důležité je, že hydrolýza GTP oslabuje nekovalentní interakce mezi dimery tubulinu, což má za následek usnadnění schopnosti rozpouštět mikrotubuly v případě potřeby. Všimněte si, že protein alfa tubulinu GTP není defosforylován, takže jej lze považovat za konzistentní v celé struktuře mikrotubulu.
Zdroj signalizace
Využití specifické chemie a prostorové konformace GTP je účinně demonstrováno jeho použitím při přenosu signálů. Především je schopen vázat a regulovat aktivitu různých proteinů signálních drah, které se dělí do dvou různých skupin. První z nich jsou heterotrimerní proteiny vázající GTP (známé také jako heterotrimerní G proteiny), které využívají GTP při aktivaci receptorů spřažených s G proteiny k modifikaci aktivity dalších proteinů v signální dráze. Druhou skupinou jsou monomerní GTP vazebné proteiny (známé také jako monomerní G proteiny). Ty reagují na jiné receptory než receptory spřažené s G proteiny. Typickým příkladem uváděným při jejich výkladu je protein Ras. Všimněte si, že jsou schopny selektivně vázat GTP b nejen díky jeho specifickému chemismu, ale také díky jevu indukovaného přizpůsobení. Navázaný GTP se pak po určité době hydrolyzuje, a tím dojde k autoaktivaci proteinu a zabránění nadměrné stimulaci signální dráhy. Po hydrolyzaci GTP zůstane GDP navázán, protože konformační změna povede k posunu afinity k molekule GTP a molekule GDP. Jedná se však o impernamentní změnu, kterou lze zvrátit následnou aktivací receptorem spřaženým s G proteinem.
GTP lze také použít jako reaktant k výrobě cGMP, což je poměrně běžná sekundární signální molekula. Katalýza je spuštěna uvolněním NO, který aktivuje guanylátcyklázu, enzym, který produkuje cGMP za vzniku GTP. cGMP pak může působit jako efektor vůči proteinkinázám, které fosforylují a modifikují působení specifických proteinů.
- J Koolman a KH Roehm, Color Atlas of Biochemistry, 3. vydání, Stuttgart, Německo. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell a P A Weil. Harperova ilustrovaná biochemie. Vydání 28. Peking, Čína. 2009.
- J Dow, G Lindsay a J Morrison, Biochemistry: Molecules, Cells and the Body (Molekuly, buňky a tělo). Vydání první. Wokingham, Anglie. Addison-Wesley. 1996.
- J Dow, G Lindsay a J Morrison, Biochemistry: Morris, J.: Molecules, Cells and the Body (Molekuly, buňky a tělo). Vydání první. Wokingham, Anglie. Addison-Wesley. 1996.
- J Dow, G Lindsay a J Morrison, Biochemistry: Molecules, Cells and the Body. Vydání první. Wokingham, Anglie. Addison-Wesley. 1996.
- J Koolman a KH Roehm, Barevný atlas biochemie. 3. vydání, Stuttgart, Německo. Thieme 2013.
- J Koolman a KH Roehm, Color Atlas of Biochemistry, 3. vydání, Stuttgart, Německo. Thieme 2013.
- M W King. Stránka lékařské biochemie. Září 2016. Citováno: „Biochemická biochemie v České republice“: 11:31. 03.12.2016. Dostupné z: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell a P A Weil. Harperova ilustrovaná biochemie. Vydání 28. Peking, Čína. 2009.
- M W King. Stránky lékařské biochemie. Září 2016. Citováno: 11:31. 03.12.2016. Dostupné z: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Stránka lékařské biochemie. September 2016. Cit: 11:31. 03.12.2016. Dostupné z: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Stránka lékařské biochemie. September 2016. Cit: 11:31. 03.12.2016. Dostupné z: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Stránka lékařské biochemie. September 2016. Cit: 11:31. 03.12.2016. Dostupné z: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay a J Morrison, Biochemie: Molecules, Cells and the Body. Vydání první. Wokingham, Anglie. Addison-Wesley. 1996.
- J Dow, G Lindsay a J Morrison, Biochemistry: Molecules, Cells and the Body. Vydání první. Wokingham, Anglie. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. Vydání první. Wokingham, Anglie. Addison-Wesley. 1996.
- J Koolman a KH Roehm, Barevný atlas biochemie. 3. vydání, Stuttgart, Německo. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto a R Stryer. Biochemie. Osmé vydání. Město a země neuvedeny. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto a R Stryer. 1. vyd. Biochemie. Osmé vydání. Město a země neuvedeny. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto a R Stryer. 1. vyd. Biochemie. Osmé vydání. Město a země neuvedeny. Freeman and Co. 2015.
- T E Dever a R Green. Elongační, terminační a recyklační fáze u eukaryot. ČSHPB. Červenec 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. Vydání šesté. New York, USA. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. Vydání šesté. New York, USA. Garland Science. 2015.
- J Koolman a KH Roehm, Color Atlas of Biochemistry. 3. vydání, Stuttgart, Německo. Thieme 2013.
- J Koolman a KH Roehm, Color Atlas of Biochemistry, 3. vydání, Stuttgart, Německo. Thieme 2013.
- J Koolman a KH Roehm, Color Atlas of Biochemistry, 3. vydání, Stuttgart, Německo. Thieme 2013.
- J Koolman a KH Roehm, Color Atlas of Biochemistry, 3. vydání, Stuttgart, Německo. Thieme 2013.
.