Úvod: Klinika migrény
Migréna spočívá v jednostranné bolesti hlavy doprovázené shlukem dalších smyslových, autonomních a kognitivních příznaků a podle studie Global burden of disease (GBD) 2016 je šestou nejčastější poruchou a jednou z hlavních příčin invalidity na celém světě, často se vyskytuje v produktivním věku a u mladých dospělých a žen středního věku (Collaborators, 2018). Migréna tedy představuje velmi závažný společenský problém z hlediska počtu let života prožitých se zdravotním postižením (YLD) a nejvýznamnější příčinu YLD ve věku 15 až 49 let (viz Steiner et al., 2018). Zátěž tohoto onemocnění nebyla donedávna identifikována, protože: migréna není příčinou trvalé invalidity nebo úmrtí; bolesti hlavy se občas vyskytují v běžné populaci (Collaborators, 2018). Ačkoli není známa jednoznačná patogeneze migrény, podílí se na ní extrakraniální cirkulace (Drummond a Lance, 1983). Klinický průběh migrény se člení na různé následující nebo souběžné fáze: premonitorní, aura, bolest hlavy a postdrom (podobně jako premonitorní fáze) (Goadsby et al., 2017a). Premonitorní fáze zahrnuje podrážděnost, chuť na jídlo, ztuhlý krk a může se objevit 2 až 72 h před záchvatem a pokračuje přes další fáze. Podle definic Mezinárodní klasifikace bolestí hlavy třetího vydání (ICHD-3):
– aura je charakterizována jedním nebo více přechodnými, reverzibilními neurologickými deficity, z nichž alespoň jeden musí mít jednostrannou lokalizaci, které se rozvíjejí po dobu 5 min nebo déle a z nichž každý deficit trvá 5 až 60 min;
– migréna spočívá v záchvatech bolesti hlavy trvajících 4-72 h doprovázených nauzeou, fotofobií a fonofobií nebo obojím (viz Goadsby et al., 2017a).
Kutánní alodynie, definovaná jako vnímání bolesti po nebolestivých podnětech, se vyskytuje u více než 70 % pacientů (Lambru et al., 2018). Silná bolest hlavy během postdromální fáze zeslábne až ustane, zatímco ostatní příznaky, jako je astenie, somnolence a fotofobie, pacienta nadále postihují, čímž se projevuje komplexní nervový základ, který je základem migrény (Lambru et al., 2018). V závislosti na počtu postižených dnů v měsíci se migréna klasifikuje jako epizodická (méně než 15 dnů s migrénou nebo bolestí hlavy) nebo chronická (nejméně 15 dnů, z toho 8 a více dnů s migrénou) (viz Goadsby et al., 2017b). Tento aspekt pozoruhodně ovlivňuje dopad onemocnění a terapeutické možnosti (Giamberardino et al., 2017). Při 1 až 3 záchvatech za měsíc je možné použít pouze abortivní symptomatické léky, zatímco při výskytu 4 až 14 záchvatů za měsíc je nutné přidat preventivní léčbu; tato léčba je nutná, aby se zabránilo chronifikaci onemocnění (Giamberardino a Martelletti, 2015; Giamberardino et al., 2017) a ke snížení rizika nadužívání léků na bolest hlavy a refrakterní migrény (Martelletti, 2017).
Patofyziologie migrény a peptid spojený s kalcitoninovým genem (CGRP)
Přesná příčina migrenózních záchvatů zatím není dobře známa, ale současný výzkum poukazuje na význam senzibilizačních procesů v trigeminovaskulárním systému a celém mozkovém kmeni a také na pozorování snížené šedé hmoty v oblastech zpracovávajících bolest (viz Goadsby et al., 2017a). Z trigeminálního ganglia obsahujícího buněčné tělo synaptují pseudounipolární primární aferenty na cévy a na trigeminocervikální komplex, z něhož vlákna druhého řádu synaptují na talamokortikální neurony třetího řádu a na locus coeruleus, periakveduktální šeď a hypotalamus (Goadsby et al., 2017a). Niciceptivní vlákna z trigeminálního ganglia a ganglií krčních dorzálních kořenů inervují cévy dura mater a jejich terminály uvolňují vazoaktivní neuropeptidy, jako je peptid související s kalcitoninovým genem (CGRP) vyvolávající vazodilataci. Exprese CGRP, CLR a RAMP1 v lidských dura mater cévách je znázorněna na obrázcích 1A-C. Autonomní nervová vlákna inervující extracerebrální cévy totiž obsahují několik neurotransmiterových vazoaktivních molekul: noradrenalin, serotonin, acetylcholin, neuropeptid Y (NPY), vazoaktivní střevní polypeptid (VIP), substanci P (SP), neurokinin A (NU) a CGRP (Goadsby et al., 1990). Antagonisté receptorů CGRP působí blokádou nociceptivní informace z dura mater: zpracovává se v thalamických jádrech, odkud se dostává do vyšších korových oblastí. Tyto vstupy z trigeminovaskulárního systému podléhají modulaci prostřednictvím sestupné dráhy mozkového kmene: předpokládá se, že agonisté 5-hydroxytryptaminových (5HT)1B/1D receptorů, tj. triptany, působí prostřednictvím tohoto systému a působí proti vzniklé vazodilataci. Zatímco propranolol a topiramát jako preventivní léčba, posledně jmenované léky se používají při akutních epizodách migrény. Kromě vazokonstrikční aktivity triptany přímo působící na 5HT1B/D presynaptické receptory zejména inhibují uvolňování mediátorů, jako je CGRP, které se podílejí na nocicepci. Kromě toho bylo experimentálně prokázáno, že sumatriptan inhibuje vnitřní proud zprostředkovaný transientním receptorovým potenciálem vaniloidu 1 (TRPV1) v trigeminálních gangliích (Evans et al., 2012). CGRP se uvolňuje během záchvatů migrény a vykazuje několik rolí jako nejvíce vazoaktivní neuropeptid, jehož kraniovaskulární hladiny se v průběhu poruchy zvyšují (Goadsby et al., 1990). Bylo prokázáno, že CGRP podléhá změnám také v mozkomíšním moku (van Dongen et al., 2017). Spouštěče změněné centrální excitability a následného průlomu epizod migrenózní bolesti jsou již dlouho zkoumány. Stimulace nervových vláken může podporovat ortodromní i antidromní akční potenciály a zejména aktivace durálních peptidergních primárních senzorických aferentů, které exprimují přechodný receptorový potenciál (TRP), může vyvolat uvolnění několika molekul včetně CGRP, které spouštějí zánětlivé reakce tkání známé jako neurogenní zánět (Xanthos a Sandkuhler, 2014). CGRP se podílí zejména na kraniální nocicepci a na epifenoménu vazodilatace vázající jeho receptory na meningeální a mozkové cévy (Deen et al., 2017). Tyto procesy podporují senzibilizaci trigeminálních vláken druhého řádu, která přenášejí zesílené bolestivé podněty do vyšších oblastí, jako je thalamus, hypotalamus a kůra, a tím vyvolávají migrénu (Dussor et al., 2014). TRPs podléhají aktivaci v reakci na několik dráždivých podnětů z prostředí, jako jsou změny teploty a pH, které u predisponovaných jedinců mohou vyvolat migrenózní bolest. CGRP vzniká tkáňově specifickým alternativním sestřihnutím kalcitoninového genu CALC I na chromozomu 11, který rovněž kóduje kalcitonin. Naopak β CGRP je produkován z genu CALC II umístěného na jiném místě chromozomu 11. Neuropeptid α CGRP je přítomen v centrální nervové soustavě jako izoforma α o 37 aminokyselinách a jeho přenos signálu je zprostředkován dvěma receptory.
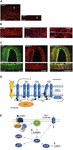
Obrázek 1. CGRP se vyskytuje v centrální nervové soustavě jako izoforma α o 37 aminokyselinách. Výskyt a dráha CGRP u migrény. Exprese CGRP, CLR a RAMP1 v lidských duktálních cévách: (A) imunoreaktivita CGRP se nachází v tenkých vláknech v adventicii; (B) příčné a podélné řezy ukazující expresi RAMP1 v cytoplazmě hladkých svalových buněk; (C) koexprese CLR a RAMP1 ve vrstvě hladkých svalových buněk. (D) Složky receptoru CGRP a zbytky důležité pro signalizaci a internalizaci receptoru. Receptor CGRP je tvořen CLR (modře), RAMP1 (žlutě) a RCP (oranžově). Funkčně důležitá rezidua jsou znázorněna jako jednopísmenné zkratky. Aminokyselinové zbytky jsou číslovány od začátku předpokládaného N-terminálního signálního peptidu (Swiss-Prot Q16602). Několik aminokyselin v C-konci CLR (∼N400-C436) a I312 na spojnici ICL3/TM5 jsou nutné pro účinnou internalizaci zprostředkovanou CGRP. Jsou znázorněny důležité vlastnosti receptoru CGRP, včetně „zalomení“ TM6 (P343) a předpokládané osmé šroubovice (∼G388-W399) v CLR. C′, C-terminál; ECL, extracelulární smyčka; ICL, intracelulární smyčka; N′, N-terminál; TM, transmembrána. (E) Intracelulární signalizace zprostředkovaná receptorem CGRP: Signalizace Gαs zvyšuje aktivitu AC (zeleně), zvyšuje intracelulární cAMP, aktivuje PKA a následně mnoho potenciálních následných efektorů. Panely (A-C) jsou se svolením převzaty z Eftekhari et al. (2013), respektive panely (D,E) z Walker et al. (2010).
První z nich je znám jako kanonický receptor CGRP a jedná se o receptor spřažený s proteinem Gαs, který ke své funkci vyžaduje protein modifikující aktivitu receptoru (RAMP) 1 (Goadsby et al., 2017a). Druhým je lidský receptor pro amylin podtypu 1 (AMY1): amylin patří do rodiny kalcitoninových genů a má hormonální aktivitu. Když se CGRP naváže na svůj receptor, podléhá internalizaci závislé na dynaminu/ klatrinu poté, co byl komplexován s β-arrestinem (viz Walker et al., 2010). Dochází ke konformačním změnám vyvolávajícím aktivaci adenylátcyklázy (AC), zvýšení cAMP a aktivaci proteinkinázy A (PKA), která může podporovat vazodilataci prostřednictvím přímé aktivace endoteliální syntázy oxidu dusnatého a reakce na bolest. Tento druhý receptor může být spojen s Gαq/11 s aktivací fosfolipázy C (PLC), s mitogenem aktivovanou proteinkinázou (MAPK) a s uvolňováním NO (viz Walker et al., 2010) (schematické znázornění intracelulární signalizace zprostředkované receptorem CGRP viz obr. 1D,E). Podávání CGRP migrenikům vyvolává záchvaty a tyto důkazy podporují jeho klíčovou roli v patogenezi migrény (Lassen et al., 2002). Systém ukončení signálu nebyl dosud identifikován: CGRP je metabolizován neprilysinem, enzymem degradujícím inzulin a endotelin-konvertujícím enzymem-1 a předpokládá se aktivní transportní systém zpětného vychytávání (viz Russell et al., 2014). Kromě toho je receptor při přechodné aktivaci CGRP internalizován do endozomů a rychle recyklován zpět do buněčné membrány, zatímco chronická stimulace receptoru vyvolává desenzitizaci a lyzozomální degradaci (viz Russell et al., 2014).
Farmakologické intervence na dráze CGRP
Migréna je mnohostranná invalidizující neurovaskulární porucha a současná léčba perorálními triptany je účinná u akutních záchvatů, i když asi 40 % pacientů je na léčbu rezistentních (Ferrari et al., 2001; Edvinsson, 2015). Tito selektivní agonisté 5-HT1B/1D, z nichž nejčastěji používaný je sumatriptan účinný většinou pro subkutánní cestu, uplatňují svůj terapeutický účinek prostřednictvím vazokonstrikce kraniálních cév a inhibice trigeminového a trigeminocervikálního systému (viz Ferrari et al., 2001). Vazokonstrikce však představuje limit pro kardiovaskulární nežádoucí účinky těchto léčiv. Léčba triptany navíc nemůže trvat déle než 9 dní v měsíci kvůli riziku lékem vyvolané bolesti hlavy. V roce 2010 byl Úřadem pro kontrolu potravin a léčiv (FDA) schválen botulotoxin typu A (BoNT-A) v prevenci migrény u nereagujících chronických migreniků a jeho složité podávání (vyžaduje injekci do 31 míst) omezuje compliance pacientů. Vzhledem ke klíčové roli, kterou hraje CGRP v patofyziologii migrény, byli vyvinuti antagonisté jeho receptoru. Tyto léky patří do skupiny gepantů. Telgecepant, první perorální gepant, byl u migreniků postižených ischemickou chorobou srdeční dobře tolerován (ClinicalTrials.gov NCT00662818, Ho et al., 2012), vykazoval však hepatotoxicitu, a proto byl i přes pokračující výzkum těchto malých molekul navržen nový přístup spočívající ve vývoji monoklonálních protilátek (mAbs) proti CGRP (nezumabs) nebo receptoru CGRP (numabs). Předpokládá se, že tyto léky inhibují působení cirkulujících molekul CGRP, aby zabránily záchvatům migrény, a protože vzhledem ke své velikosti nepřestupují přes krevní mozkovou bariéru (BBB), měla by být místa jejich působení v trigeminálním systému (Edvinsson, 2015). Do BBB nejsou zahrnuty zejména durální cévy. Kromě toho CGRP pravděpodobně nepřekračuje BBB a působí jako parakrinní modulátor, protože je exprimován polovinou neuronů trigeminálního ganglia, které nemají receptor CGRP, exprimovaný satelitními gliovými buňkami a 30 % soma neuronů trigeminálního ganglia (viz Yuan et al., 2017). V současné době jsou v klinických studiích pro léčbu epizodické a chronické migrény studovány čtyři mAbs, eptinezumab, fremanezumab, galcanezumab a erenumab. První tři mAbs jsou humanizované protilátky namířené proti CGRP, zatímco erenumab je humánní protilátka proti jeho kanonickému receptoru. Poločas rozpadu těchto léčiv je poměrně dlouhý, což umožňuje maximálně jedno podání za měsíc, a to je zajímavé, protože mAbs je třeba podávat intravenózně nebo subkutánně. Konkrétně eptinezumab se podává pouze intravenózně (Israel et al., 2018). Studie fáze III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) hodnotila účinnost eptinezumabu na prevenci častých epizodických migrén. Výsledky ukázaly významné snížení primárního cílového ukazatele spočívající ve snížení počtu měsíčních migrenózních dnů (MMD) z průměrné výchozí hodnoty 8,5 dne v průběhu týdnů 1-12 na 4,3 MMD při dávce 300 mg, 3,9 při dávce 100 mg a 4,0 při dávce 30 mg vzhledem k 3,2 dne při podávání placeba (Saper et al., 2018). Pro hodnocení eptinezumabu v prevenci chronické migrény bylo do studie PROMISE 2 (ClinicalTrials.gov NCT02974153) zařazeno 1121 účastníků. Účinnost galcanezumabu v prevenci epizodické migrény byla hodnocena ve dvojitě zaslepené, randomizované, placebem kontrolované studii fáze 3 EVOLVE-1 (ClinicalTrials.gov NCT02614183) rozdělené do 4 období a v randomizované kontrolované dvojitě zaslepené 6měsíční klinické studii fáze 3 EVOLVE-2 (ClinicalTrials.gov NCT02614196). Ve studii EVOLVE-1 splnily obě dávky galcanezumabu (120 a 240 mg) primární výsledek spočívající ve významném snížení počtu dnů měsíční migrenózní bolesti hlavy o 4,7 dne, resp. 4,6 dne ve srovnání s 2,8 dne u placeba (Stauffer et al., 2018). Ve studii EVOLVE-2 dostávali pacienti měsíčně injekci 120 nebo 240 mg galcanezumabu. Průměrná měsíční délka migrenózních bolestí hlavy se snížila o 4,3, resp. 4,2 dne ve srovnání se snížením o 2,3 dne dosaženým při podávání placeba (p < 0,001) (Skljarevski et al., 2018). Byly splněny i sekundární cílové hodnoty, tj. snížení funkčního poškození hodnoceného prostřednictvím skóre domény Role Function-Restrictive (R-FR) dotazníku kvality života specifického pro migrénu (MSQ) a zlepšení skóre PGI-S (Patient Global Impression of Severity) a MIDAS (Migraine Disability Assessment; časový bod = 6. měsíc) (Skljarevski et al., 2018). U 147 (65,0 %) a 163 (71,5 %) pacientů léčených galcanezumabem 120, resp. 240 mg a u 287 (62,3 %) pacientů léčených placebem se vyskytly nežádoucí příhody, mezi nimi akutní infarkt myokardu a přechodná ischemická ataka v rámci skupiny sedmi pacientů léčených galcanezumabem 240 mg (Skljarevski et al., 2018). Nebyly zjištěny statisticky významné rozdíly v průměrné změně oproti výchozí hodnotě systolického/diastolického krevního tlaku. U 19 (8,6 %), 11 (5,1 %) a 2 (0,5 %) pacientů ve skupinách léčených galcanezumabem 120 mg, galcanezumabem 240 mg a placebem byly zjištěny protilátky proti léčivům (ADA), které se objevily při léčbě. Ve studii REGAIN fáze III hodnotící galcanezumab proti chronické migréně došlo ke zkrácení MMD o 4,8 dne u dávky 120 mg a o 4,6 dne u dávky 240 mg ve srovnání s 2,7 dne u placeba (viz Yuan et al., 2017). Navíc bylo prokázáno, že léčba galcanezumabem je obdařena statisticky významným přetrváváním účinku (Forderreuther et al., 2018). Fremanezumab byl zkoumán ve studii fáze III HALO pro preventivní léčbu migrény (ClinicalTrials.gov NCT02638103). Snížil MMD epizodické migrény po 12 týdnech o 3,7 dne při dávce 225 mg měsíčně po dobu 3 měsíců a o 3,4 dne při dávce 675 mg jednou za čtvrt roku v dávkovacím režimu ve srovnání se snížením o 2,2 dne u placeba (viz Yuan et al., 2017). Účinnost erenumabu v prevenci epizodické migrény byla zkoumána v randomizované, dvojitě zaslepené, placebem kontrolované studii fáze 3 ARISE (ClinicalTrials.gov NCT02483585). MMDs se snížily při podávání 70 mg měsíčně subkutánního erenumabu o 2,9 dne ve srovnání s 1,8 dne u placeba (p < 0,001) a byl účinný v sekundárních cílových ukazatelích, kterými jsou nejméně 50% snížení MMDs a změna počtu dnů měsíční medikamentózní léčby migrény (MSMD) (Dodick et al., 2018). Podíl pacientů, u nichž se vyskytly nežádoucí účinky, byl ve skupině léčené mAb a placebem podobný; 4,3 % pacientů mělo do 12. týdne pozitivní testy na protilátky vázající se na erenumab, z toho jeden pacient byl přechodně pozitivní na neutralizační protilátky, ale až ve 4. týdnu (Dodick et al., 2018). Také klinická studie fáze III STRIVE (ClinicalTrials.gov NCT02456740) hodnotila účinnost erenumabu v prevenci epizodické migrény. Erenumab byl podáván v dávce 70 nebo 140 mg měsíčně po dobu 6 měsíců (Goadsby et al., 2017b). Výchozí průměrný počet MMD byl 8,3 a dávky 70 mg a 140 mg jej snížily o 3,2, resp. 3,7 dne ve srovnání s 1,8 dne u placeba (s p < 0,001 pro každou dávku oproti placebu) (Goadsby et al., 2017b). Rovněž v průběhu posledních 3 měsíců léčby splnila každá dávka erenumabu sekundární cílové ukazatele, tj. alespoň 50% snížení průměrného počtu migrenózních dnů za měsíc oproti výchozímu stavu a snížení oproti výchozímu stavu v obou ukazatelích Migraine Physical Function Impact Diary (MPFID) everyday-activities (MPFID-EA) a physical-impairment (MPFID-PI) (Goadsby et al., 2017b). U pacientů s protilátkami proti erenumabu byl pouze jeden ze skupiny léčené 70 mg pozitivní na neutralizační protilátky a mAb byl celkově dobře snášen z hlediska hladiny kreatininu, jaterní toxicity, celkového počtu neutrofilů a elektrokardiografických funkcí (Goadsby et al., 2017b). Podle autorů je jedním z limitů této studie to, že z ní byli vyloučeni pacienti, kteří nevykazovali terapeutickou odpověď na více než dvě třídy léků zabraňujících migréně (Goadsby et al., 2017b). Dále existují klinické studie zkoumající účinnost fremanezumabu (NCT02945046 a NCT02964338) a galcanezumabu (NCT 02397473 a NCT02438826) v prevenci cluster headache (viz Israel et al., 2018), tedy primární bolesti hlavy charakterizované silnou jednostrannou bolestí v periorbitální oblasti doprovázenou slzením, zarudnutím spojivek a rýmou (Vollesen et al., 2018). Bylo totiž prokázáno, že kontinuální intravenózní infuze prostřednictvím infuzní pumpy 1,5 μg/min CGRP po dobu 20 min (ve 2 dnech oddělených nejméně 7 dny) pacientům s epizodickou (aktivní nebo remisní fází) nebo chronickou cluster headache vyvolává záchvaty podobné clusterům u pacientů v aktivní fázi nebo s chronickou cluster headache, nikoli však ve fázi remise (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). Hlavní PK výhody mAbs představují dlouhý eliminační poločas, čímž se omezuje nutnost denního dávkování, a clearance proteolýzou. Vzhledem k účinkům gepantů na játra a vzhledem k vazodilatačním vlastnostem CGRP spočívají nejobávanější rizika inhibice signalizace CGRP v hypotetické hepatotoxicitě a teoretickém kardiovaskulárním riziku (Yuan et al., 2017). Evropská federace pro bolesti hlavy (EHF) vypracovala pokyny pro používání anti-CGRP mAbs s použitím metody GRADE (Grading of Recommendation, Assessment, Development and Evaluation), a pokud to není možné, opírá se o stanovisko panelu odborníků (Sacco et al., 2019).
Farmakokinetický (PK)/farmakodynamický (PD) vztah anti-migrenózních mAbs
Vývoj mAbs představoval zcela nový přístup k inhibici dráhy CGRP. Hlavní zlepšení PD dosažené použitím mAbs namísto malých molekul spočívá v tom, že je snazší zacílit na široké vazebné místo receptoru CGRP (Taylor, 2018). Hlavní PK výhody mAbs představuje dlouhý eliminační poločas bez nutnosti denního dávkování a clearance proteolýzou a nejobávanější rizika inhibice signalizace CGRP spočívají v hypotetické hepato-toxicitě v důsledku účinků gepantů na játra a teoretickém kardiovaskulárním riziku kvůli vazodilatačním vlastnostem CGRP. Po cestě těchto mAbs od jejich výroby k cíli je však první překážkou, se kterou se tyto molekuly setkávají, jejich podávání kvůli jejich malé perorální biologické dostupnosti. Proto je nutná parenterální cesta podání, a aby se podpořila adherence k léčbě, musí být poločas rozpadu dlouhý (Taylor, 2018). V úvahu přicházejí imunoglobuliny (Ig)G1, 2 nebo 4 (Wang et al., 2008; Taylor, 2018). Kromě původu IgG může poločas rozpadu ovlivnit i případná zkřížená reaktivita a individuální modifikace katabolismu (Bonilla, 2008; Taylor, 2018). Technologie používaná k výrobě mAbs spočívá v použití hybridomů složených z buněk v kontinuálním dělení, které produkují determinované klony jednoho typu protilátky, bez variability nebo s nízkou variabilitou (Taylor, 2018). Na základě původu aminokyselin tvořících mAb je možné rozlišovat mezi chimérickými (imunizace hlodavců; zachování hlodavčí Fragment antigen-vázající oblasti Fab, ale zavedení lidské Fragment krystalizovatelné oblasti Fc), humanizovanými (zumabs, s myšími oblastmi určujícími komplementaritu, CDR, naroubovanými na lidské oblasti Fab) a humánními (zavedení celé sekvence genu lidské protilátky u myši, která se stává humanizovanou, jako například XenoMouse) mAb (viz Taylor, 2018). CDR ovlivňují přizpůsobení cíli. Ze 4 mAbs proti migréně je pouze erenumab lidský, zatímco naroubované CDR jsou u fremanezumabu myší, u eptinezumabu králičí a u galcanezumabu pravděpodobně myší (viz Taylor, 2018). Konkrétně jedinou mAb proti receptoru CGRP je erenumab, což je lidský IgG2λ, a další tři mAb namířené proti místům CGRP jsou: eptinezumab, geneticky upravený humanizovaný IgG1k; fremanezumab, humanizovaný IgG2k; galcanezumab, humanizovaný IgG4 (Edvinsson et al., 2018). Erenumab (Tmax 3-14 dní) vyžaduje měsíční subkutánní podání, stejně jako fremanezumab (Tmax 3-20 dní) a galcanezumab (Tmax 7-14 dní) (Taylor, 2018). Naopak eptinezumab (Tmax 4,8 h) se podává intravenózně jednou za 3 měsíce; asociuje se rychleji a disociuje pomaleji než fremanezumab a galcanezumab. Vzhledem k tomu, že mAbs jsou proteiny velkých rozměrů, nemohou snadno procházet BBB. Některé receptory CGRP jsou mimo BBB, což umožňuje působení anti-CGRP mAbs (Edvinsson, 2018). Před navázáním se protilátka dostane do cévních endoteliálních buněk prostřednictvím pinocytózy. Velké zdánlivé distribuční objemy mohou záviset na tkáni a související vazebné kapacitě mAb (Lobo et al., 2004; Taylor, 2018). Erenumab je nejnovějším přístupem, protože jako jediný cílí na fúzní protein extracelulárních domén lidského G proteinem spřaženého receptoru CALCRL podobného receptoru pro kalcitonin (nutný v receptorech pro CGRP a adrenomedulin) a RAMP1 včetně vazebné kapsy pro CGRP (Edvinsson et al., 2018). Bylo prokázáno, že kompetitivně inhibuje vazbu -CGRP na lidský receptor CGRP v lidských neuroblastomových buňkách (SK-N-MC) s Ki 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab působil silný a úplný antagonismus akumulace cAMP stimulované CGRP s IC50 2,3 ± 0,9 nM ve funkčních testech prováděných na SK-N-MC (Shi et al., 2016). Navíc byl 5000krát selektivnější pro receptor CGRP a nevykazoval žádný agonistický/antagonistický účinek na ostatní lidské receptory rodiny kalcitoninu včetně adrenomedulinu, kalcitoninu a amylinových receptorů až do nejvyšší testované koncentrace 10 μM (Shi et al., 2016). Fremanezumab může působit na různé cévy; způsobuje totiž na koncentraci závislou inhibici vazodilatace vyvolané CGRP v předem stažených lidských mozkových, meningeálních a periferních břišních tepnách (Ohlsson et al., 2018). Kromě toho může CGRP působit také na neurony a gliové buňky a na glymfatiku (podobnou lymfě), přičemž posledně jmenovaná se podílí na projevech aury (viz Messlinger, 2018). Pravděpodobná absence metabolismu jaterními enzymy by mohla zabránit interakcím mezi léčivy. K eliminaci dochází prostřednictvím renální proteolýzy aminokyselin. Ačkoli klinické studie uvádějí, že tyto protilátky jsou celkově dobře snášeny, kromě zvýrazněné bolesti v místě injekce existují obavy z jejich imunogenicity prostřednictvím produkce ADA (Taylor, 2018). Během dvojitě zaslepené, randomizované, placebem kontrolované klinické studie (ClinicalTrials.gov NCT 01337596) hodnotící léčbu různými režimy jednorázových a vícenásobných dávek galcanezumabu vykazovalo 11 léčených pacientů (26 %) nízké titry (1:10 – 1:80) léčbou emergentní-ADA (u 3 pacientů se zvýšil titr již existujících protilátek), bez závislosti na dávce a zjištěných účinků na PK a PD (Monteith et al., 2017). Studium imunogenicity je zásadní, protože přítomnost ADA může urychlit odstranění léčiva nebo v horším případě podpořit poškození koncových orgánů (Taylor, 2018). Hlavní charakteristiky antimigrenózních mAbs jsou shrnuty v tabulce 1.

Tabulka 1. Hlavní charakteristiky fremanezumabu, eptinezumabu, galcanezumabu a erenumabu.
Závěr
Migréna je invalidizující a vysilující neurovaskulární bolestivé onemocnění, které představuje více než 90 % případů rekurentní bolesti hlavy a k němuž může být sklon dědičný (MacGregor, 2017). Divalproex sodný, valproát sodný, topiramát, metoprolol, propranolol a timolol mají prokázané silné důkazy úrovně A pro prevenci migrény (American Academy of Neurology a American Headache Society, 2015). Všechny klasické perorální preventivní léky včetně tricyklických antidepresiv, beta-blokátorů, 5-HT2 antagonistů ergoty a antiepileptik však nebyly vyvinuty pro migrénu a poskytují 50% snížení počtu dnů měsíční migrenózní bolesti pouze do 45 % migreniků (D’Amico a Tepper, 2008), a to i z důvodu nízké adherence kvůli mizivé snášenlivosti. Perzistence a přerušení léčby byly zkoumány v retrospektivní analýze nároků v USA (Hepp et al., 2017) a výsledky naznačují nízkou perzistenci na původně užívaném léku a vysoké množství přerušení léčby do 6 měsíců nezávisle na třídě léku. Vzhledem k zásadní roli CGRP při udržování neurozánětu a centrální senzitizace v dráze od trigeminálního ganglia a mozkového kmene do vyšších oblastí zapojených do fyziopatologie migrény byly vyvinuty nové mAbs vůči CGRP a jeho receptoru. Ukázalo se, že první malé molekuly antagonistů CGRP vyvolávají jaterní toxicitu, ale mAbs neprodukují ani toxické metabolity, ani kardiovaskulární vedlejší reakce kvůli inhibici vazodilatace (viz Deen et al., 2017). Nebyly zdůrazněny ani centrální nežádoucí účinky. Potenciální dlouhodobé účinky blokády CGRP je třeba ještě studovat, ale zásadní výhoda těchto protilátek vyplývá z jejich dlouhého poločasu, který umožňuje měsíční nebo méně časté injekce, což může pozoruhodně zlepšit adherenci k léčbě a její následnou účinnost (Deen et al., 2017). Anti-CGRP mAbs by tedy mohly představovat účinný nástroj v terapeutickém arzenálu proti nereagující migréně; povinné je však důkladné sledování účinnosti a bezpečnosti (tj. produkce toxických metabolitů, imunogenicita s ADA, neutralizační protilátky a zkřížená reaktivita tkání a vedlejší účinky) (Taylor, 2018). Důkazy ze starších biotechnologických produktů totiž ukazují, že terapie pomocí mAb proti tumor nekrotizujícímu faktoru α (TNFα) může být vystavena sekundárnímu selhání (na rozdíl od primárních non-respondérů) původní terapeutické odpovědi, protože tyto léky indukují produkci protilátek, které mohou mAb degradovat, ale mohou také neutralizovat její účinek před vazbou na cíl (viz Prado et al., 2017). Imunogenicitu může ovlivnit glykosylace, typ mAb, počet epitopů a nečistoty ve formulaci (viz Prado et al., 2017). S imunogenicitou anti-TNFα je navíc spojeno několik zřejmě nevysvětlitelných závažných nežádoucích účinků. Byly zdůrazněny lokální a systémové reakce přecitlivělosti, imunodeficit se zvýšenou náchylností k infekcím a tvorba imunitních komplexů, které mohou vést až ke smrti (viz Prado et al., 2017). Využití terapeutické diagnostiky (teranostiky) proto může zlepšit znalosti a správný management těchto farmakologických prostředků (Bendtzen, 2013; Prado et al., 2017).
Příspěvky autorů
Studii koncipovali MTC, LAM, PT a GB. DS shromáždil výsledky studie, analyzoval literaturu a napsal rukopis. AA, LR a MN se podíleli na průzkumu literatury. Všichni autoři přečetli a schválili konečnou podobu rukopisu.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být považovány za potenciální střet zájmů.
American Academy of Neurology and American Headache Society (2015). Příloha a: souhrn pokynů založených na důkazech pro lékaře, aktualizace: farmakologická léčba pro prevenci epizodické migrény u dospělých. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Personalizovaná medicína: teranostika (terapeutická diagnostika) nezbytná pro racionální využití antagonistů tumor nekrotizujícího faktoru alfa. Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmakokinetika imunoglobulinu podávaného intravenózní nebo subkutánní cestou. Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Globální, regionální a národní zátěž migrénou a tenzním typem bolesti hlavy, 1990-2016: systematická analýza pro studii Global burden of disease 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Profylaxe migrény: obecné zásady a přijetí pacientem. Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Blokování CGRP u pacientů s migrénou – přehled výhod a nevýhod. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: randomizovaná studie fáze 3 erenumabu pro epizodickou migrénu. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). Extrakraniální cévní změny a zdroj bolesti u migrény. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., and Porreca, F. (2014). Cílení na TRP kanály pro nová terapeutika migrény. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). Antagonisté receptoru CGRP a protilátky proti CGRP a jeho receptoru v léčbě migrény. Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). CGRP dráha u migrény jako reálný cíl pro terapii. Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). CGRP jako cíl nové léčby migrény – úspěšný převod ze stolu na kliniku. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., and Edvinsson, L. (2013). Diferenciace nervových vláken ukládajících CGRP a CGRP receptory v periferním trigeminovaskulárním systému. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., and Premkumar, L. S. (2012). Sumatriptan inhibuje kanály TRPV1 v trigeminálních neuronech. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., and Goadsby, P. J. (2001). Perorální triptany (agonisté serotoninu 5-HT(1B/1D)) v léčbě akutní migrény: metaanalýza 53 studií. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). Preventivní účinky galcanezumabu u dospělých pacientů s epizodickou nebo chronickou migrénou přetrvávají: údaje z randomizovaných, dvojitě zaslepených, placebem kontrolovaných studií fáze 3 EVOLVE-1, EVOLVE-2 a REGAIN. J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). Calcitonin gene-related peptide receptor jako nový cíl pro léčbu osob s epizodickou migrénou: současné důkazy a bezpečnostní profil erenumabu. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). Nové léky pro léčbu migrény. Expert Opin. Emerg. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). Uvolňování vazoaktivních peptidů v extracerebrálním oběhu člověka během migrény. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). Patofyziologie migrény: porucha smyslového zpracování. Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Kontrolovaná studie erenumabu u epizodické migrény. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017). Perzistence a vzorce změny perorální profylaktické medikace migrény u pacientů s chronickou migrénou: retrospektivní analýza nároků. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Randomizovaná, kontrolovaná studie telcagepantu u pacientů s migrénou a ischemickou chorobou srdeční. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018). Monoklonální protilátky CGRP pro preventivní léčbu migrény. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). Nové léky pro léčbu migrény: aktualizace. Expert Opin. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002). CGRP může hrát příčinnou roli u migrény. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., and Balthasar, J. P. (2004). Farmakokinetika a farmakodynamika protilátek. J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Migréna. Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). Použití monoklonálních protilátek CGRP(r) ve spektru migrény: potřeby a priority. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). Velká záplava CGRP – zdroje, propady a signální místa v trigeminovaskulárním systému. J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Bezpečnost, snášenlivost, farmakokinetika a farmakodynamika monoklonální protilátky vázající CGRP LY2951742 (galcanezumab) u zdravých dobrovolníků. Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). Fremanezumab blokuje dilataci vyvolanou CGRP v lidských mozkových, středních meningeálních a břišních tepnách. J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Biologická anti-TNF léčiva: imunogenicita, která je základem selhání léčby a nežádoucích účinků. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Calcitonin gene-related peptide: fyziologie a patofyziologie. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). Pokyny Evropské federace pro bolesti hlavy k používání monoklonálních protilátek působících na peptid související s kalcitoninovým genem nebo jeho receptorem pro prevenci migrény. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Primární výsledky studie PROMISE-1 (prevention of migine via intravenous eptinezumab safety and efficacy-1): randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze 3 k vyhodnocení účinnosti a bezpečnosti eptinezumabu pro prevenci častých epizodických migrén (S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Farmakologická charakterizace AMG 334, silné a selektivní lidské monoklonální protilátky proti receptoru pro peptid související s kalcitoninovým genem. J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). Účinnost a bezpečnost galcanezumabu v prevenci epizodické migrény: výsledky 3. fáze randomizovaného kontrolovaného klinického hodnocení EVOLVE-2. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). Hodnocení galcanezumabu pro prevenci epizodické migrény: randomizované klinické hodnocení EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). Migréna je první příčinou invalidity u osob mladších 50 let: všimnou si jí nyní zdravotničtí politici? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amylin, imunologie a medicína bolesti hlavy. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Migrenózní biomarkery v mozkomíšním moku: systematický přehled a metaanalýza. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., Jensen, R. H., et al. (2018). Účinek infuze peptidu souvisejícího s kalcitoninovým genem na záchvaty cluster headache: randomizovaná klinická studie. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., and Hay, D. L. (2010). Regulace přenosu signálu receptory peptidu souvisejícího s kalcitoninovým genem. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J. P. (2008). Farmakokinetika a farmakodynamika monoklonálních protilátek. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., and Sandkuhler, J. (2014). Neurogenní neurozánět: zánětlivé reakce CNS v reakci na neuronální aktivitu. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., and Silberstein, S. D. (2017). Monoklonální protilátky CGRP pro léčbu migrény: zdůvodnění a pokrok. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar
.