Chemical Kinetics
Chemical Kinetics
Možná znáte acidobazické titrace, které používají fenolftalein jako indikátor koncového bodu. Možná jste si však nevšimli, co se stane, když se roztok obsahující fenolftalein v přítomnosti přebytku zásady nechá několik minut stát. Ačkoli má roztok zpočátku růžovou barvu, postupně se změní na bezbarvý, protože fenolftalein reaguje s OH-iontem v silně bazickém roztoku.
Následující tabulka ukazuje, co se stane s koncentrací fenolftaleinu v roztoku, který měl původně 0,005 M fenolftaleinu a 0,61 M OH-iontu. Jak je vidět, když jsou tyto údaje vyneseny do níže uvedeného grafu, koncentrace fenolftaleinu se během přibližně čtyř minut sníží desetinásobně.
Experimentální data pro reakci mezi fenolftaleinem a přebytečnou bází
Experimenty, jako je ten, který nám poskytl data ve výše uvedené tabulce, jsou klasifikovány jako měření chemické kinetiky (z řeckého kmene znamenajícího „pohyb“). Jedním z cílů těchto experimentů je popsat rychlost reakcerychlost, jakou se reaktantypřeměňují na produkty reakce.
Termín rychlost se často používá k popisu změny veličiny, ke které dochází za jednotku času. Míra inflace je například změna průměrné ceny souboru standardních položek za rok. Rychlost, kterou se objekt pohybuje v prostoru, je vzdálenost uražená za jednotku času, například míle za hodinu nebo kilometry za sekundu. V chemické kinetice je ujetá vzdálenost změnou koncentrace jedné ze složek reakce. Rychlost reakce je tedy změna koncentrace jedné z reaktantů![]() (X)
(X)![]() , ke které dojde za daný časový úsek
, ke které dojde za daný časový úsek![]() t.
t.
![]()
Praktická úloha 1:
Použijte údaje ve výše uvedené tabulce k výpočtu rychlosti, kterou fenolftalein reaguje s OH-iontem během každého z následujících časových úseků:
(a) Během prvního časového intervalu, kdy koncentrace fenolftaleinu klesne z 0,0050 M na 0,0045 M.
(a) Během prvního časového intervalu, kdy koncentrace fenolftaleinu klesne z 0,0050 M na 0,0045 M.
(b) Během druhého intervalu, kdy koncentrace klesne z 0,0045 M na 0,0040 M.
(c) Během třetího intervalu, kdy koncentrace klesne z 0,0040 M na 0,0035 M.
Klikněte sem pro kontrolu odpovědi na cvičnou úlohu 1.
Klikněte sem pro kontrolu řešení cvičné úlohy 1.
![]()
Konstantní rychlost reakce a rychlostní zákon pro reakci
Rychlost reakce mezi fenolftaleinem a OH-iontem není konstantní, mění se s časem. Stejně jako většina reakcí i rychlost této reakcepostupně klesá s tím, jak se spotřebovávají reaktanty. To znamená, že rychlost reakcese během měření mění.
Abychom minimalizovali chybu, kterou to vnáší do našich měření, jeví se jako vhodné měřit rychlost reakce v časových úsecích, které jsou krátké ve srovnání s dobou, za kterou reakce proběhne. Můžeme se například pokusit změřit nekonečně malou změnu koncentrace![]() d(X)
d(X)![]() , ke které dojde za nekonečně krátkou dobu. Poměr těchtokvantit je znám jako okamžitá rychlost reakce.
, ke které dojde za nekonečně krátkou dobu. Poměr těchtokvantit je znám jako okamžitá rychlost reakce.
![]()
Momentální rychlost reakce v libovolném časovém okamžiku lze vypočítatz grafu závislosti koncentrace reaktantu (nebo produktu) na čase. Níže uvedený graf ukazuje, jak lze z grafu závislosti koncentrace na čase vypočítat rychlost reakce pro rozklad fenolftaleinu. Rychlost reakce v libovolném časovém okamžiku se rovná sklonu tečny nakreslené k této křivce v daném okamžiku.
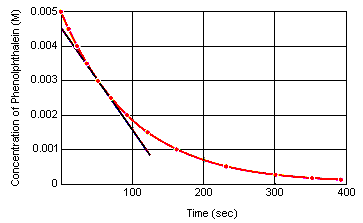
Momentální rychlost reakce lze měřit v libovolném okamžiku mezi okamžikem, kdy jsou reaktanty smíchány, a okamžikem, kdy reakce dosáhne rovnováhy. extrapolací těchto údajů zpět k okamžiku, kdy jsou reagenty smíchány, získáme počáteční momentální rychlost reakce.
![]()
Rychlostní zákony a rychlostní konstanty
Zajímavý výsledek získáme, když okamžitou rychlost reakce vypočítáme v různých bodech podél křivky v grafu v předcházející části. Rychlost reakce v každém bodě této křivky je přímoúměrná koncentraci fenolftaleinu v daném časovém okamžiku.
Rychlost = k(fenolftalein)
Protože tato rovnice je experimentální zákon, který popisuje rychlostreakce, nazývá se rychlostní zákon pro danou reakci. Konstanta úměrnosti, k, se nazývá rychlostní konstanta.
Cvičná úloha 2:
Vypočítejte rychlostní konstantu pro reakci mezi fenolftaleinem a OH-iontem, je-li okamžitá rychlost reakce 2,5 x 10-5 molů na litr za sekundu, je-li koncentrace fenolftaleinu 0,0025 M.
Klikněte sem pro kontrolu odpovědi na cvičnou úlohu 2.
Klikněte sem pro zobrazení řešení cvičné úlohy 2.
Cvičná úloha 3:
Pomocí rychlostní konstanty pro reakci mezi fenolftaleinem a OH-iontem vypočítejte počáteční okamžitou rychlost reakce pro experimentální údaje uvedené v předchozí tabulce.
Klikněte sem pro kontrolu odpovědi na cvičnou úlohu 3.
Klikněte sem pro zobrazení řešení cvičné úlohy 3.
![]()
Různé způsoby vyjádření rychlosti reakce
Obvykle existuje více než jeden způsob měření rychlosti reakce. Můžeme například studovat rozklad jodovodíku měřením rychlosti, jakou vzniká H2 nebo I2 v následující reakci, nebo rychlosti, jakou se spotřebovává HI.
2 HI(g) H2(g) + I2(g)
Experimentálně jsme zjistili, že rychlost, jakou vzniká I2, je úměrná kvadrátu koncentrace HI v každém časovém okamžiku.
![]()
Co by se stalo, kdybychom studovali rychlost, jakou vzniká H2?“ Z vyvážené rovnice vyplývá, že H2 a I2 musí vznikat přesně stejnou rychlostí.
![]()
Co by se však stalo, kdybychom studovali rychlost, jakou se v této reakci spotřebovává HI? Protože se HI spotřebovává, musí být změna jeho koncentrace záporné číslo. Podle konvence se rychlost reakce vždy uvádí jako kladnéčíslo. Proto musíme před uvedením reakční rychlosti změnit znaménko u činidla, které se v reakci spotřebovává.
![]()
Záporné znaménko dělá dvě věci. Matematicky převádí zápornouzměnu koncentrace HI na kladnou rychlost. Fyzikálně nám připomíná, žekoncentrace reaktantu s časem klesá.
Jaký je vztah mezi rychlostí reakce získanou sledováním vzniku H2 nebo I2 a rychlostí získanou sledováním zániku HI? Stechiometrie reakce říká, že na každou vzniklou molekulu H2 nebo I2 připadají dvě molekuly HI. To znamená, že rychlost rozkladu HI je dvakrát rychlejší než rychlost vzniku H2 a I2. Tento vztah můžeme převést do matematické rovnice takto.
![]()
V důsledku toho není rychlostní konstanta získaná studiem rychlosti, jakou se v této reakci tvoří H2a I2 (k), stejná jako rychlostní konstanta získaná sledováním rychlosti, jakou se spotřebovává HI (k‘)
Praktická úloha 4:
Vypočítejte rychlost, jakou v následující reakci mizí HI v okamžiku, kdy se I2 tvoří rychlostí 1. Jakou rychlostí mizí HI?8 x 10-6 molů na litr za sekundu:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
Klikněte zde pro kontrolu odpovědi na cvičnou úlohu 4.
Klikněte zde pro zobrazení řešení cvičné úlohy 4.
![]()
Rychlostní zákon versus stechiometrie reakce
Ve 30. letech 20. století studoval sir Christopher Ingold a jeho spolupracovníci na Londýnské univerzitě kinetiku substitučních reakcí, např.
CH3Br(aq) + OH-(aq)
CH3OH(aq) + Br-(aq)
Zjistili, že rychlost této reakce je úměrnákoncentracím obou reaktantů.
Rychlost = k(CH3Br)(OH-)
Když provedli podobnou reakci na trochu jiném výchozím materiálu, dostali podobné produkty.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)
Ale nyní byla rychlost reakce úměrná koncentraci pouze jednoho z reaktantů.
Rate = k((CH3)3CBr)
Tyto výsledky ilustrují důležitou věc: Rychlostní zákon pro reakci nelze předpovědět ze stechiometrie reakce; musí být určenexperimentálně. Někdy je rychlostní zákon v souladu s tím, co očekáváme ze stechiometrie reakce.
2 HI(g) H2(g) + I2(g)
Rychlost = k(HI)2
Často, to však neplatí.
| 2 N2O5(g) |
Rychlost = k(N2O5) |
![]()
Pořadí molekulárnosti
Některé reakce probíhají v jednom kroku. Reakce, při níž se chloratom přenáší z ClNO2 na NO za vzniku NO2 a ClNO, je dobrýmpříkladem jednokrokové reakce.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Další reakce probíhají řadou jednotlivých kroků. Například N2O5 se rozkládá na NO2 a O2 třístupňovým mechanismem.
| Krok 1: | N2O5 |
|
| Krok 2: | N2O5 |
|
| : | NO2 + NO3 |
|
| Krok 3: | NO + NO3 |
Kroky reakce jsou klasifikovány z hlediska molekularity,která popisuje počet spotřebovaných molekul. Pokud se spotřebuje jedinámolekula, krok se nazývá jednomolekulární. Pokud jsou spotřebovány dvě molekuly, jedná se o bimolekulární krok.
Cvičná úloha 5:
Určete molekularitu jednotlivých kroků reakce, při níž se N2O5 rozkládá na NO2 a O2.
Klikněte sem pro kontrolu odpovědi na cvičnou úlohu 5.
Klikněte sem pro zobrazení řešení cvičné úlohy 5.
Reakce lze také klasifikovat z hlediska jejich pořadí. Rozklad N2O5 je reakcí prvního řádu, protože rychlost reakce závisí na koncentraci N2O5 zvýšené na první mocninu.
Rychlost = k(N2O5)
Rozklad HI je reakcí druhého řádu, protože rychlost reakce závisí na koncentraci HI zvýšené na druhou mocninu.
Rychlost = k(HI)2
Když rychlost reakce závisí na více než jednom činidle, klasifikujeme reakci podle řádu jednotlivých činidel.
Cvičná úloha 6:
Klasifikujte pořadí reakce mezi NO a O2 za vzniku NO2:
2 NO(g) + O2(g) ![]() 2 NO2(g)
2 NO2(g)
Předpokládejte následující rychlostní zákon pro tuto reakci:
Rate = k(NO)2(O2)
Klikněte zde pro kontrolu odpovědi na cvičnou úlohu 6.
Rozdíl mezi molekulárností a pořadím reakce je důležitý. Molekulárnost reakce nebo kroku v reakci popisuje, co se děje na molekulární úrovni. Pořadí reakce popisuje, co se děje na makroskopické úrovni. Pořadí reakce určíme tak, že sledujeme, jak se objevují produkty reakce nebo mizí reaktanty. Molekulárnost reakceje něco, co odvozujeme, abychom vysvětlili tyto experimentální výsledky.
![]()
Model srážkové teorie chemických reakcí
Model srážkové teorie chemických reakcí lze použít k vysvětlení pozorovaných zákonů rychlosti pro jednokrokové i vícekrokové reakce. Tento modelpředpokládá, že rychlost jakéhokoli kroku reakce závisí na četnosti srážekmezi částicemi, které se tohoto kroku účastní.
Následující obrázek poskytuje základ pro pochopení důsledků modelu teorie srážek pro jednoduché jednokrokové reakce, jako je například následující.
ClNO2(g) + NO(g) ![]() NO2(g) + ClNO(g)
NO2(g) + ClNO(g)
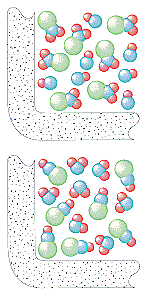
Kinetická molekulová teorie předpokládá, že počet srážek za sekundu v plynu závisí na počtu částic na litr. Rychlost, jakou vznikají NO2a ClNO v této reakci, by proto měla být přímo úměrnákoncentracím ClNO2 i NO.
Rychlost = k(ClNO2)(NO)
Model srážkové teorie předpokládá, že rychlost jakéhokoli kroku v areakci je úměrná koncentracím činidel spotřebovaných v tomto kroku. Zákon rychlosti pro jednokrokovou reakci by proto měl souhlasit se stechiometrií této reakce.
Například následující reakce probíhá v jednom kroku.
CH3Br(aq) + OH-(aq) ![]() CH3OH(aq) + Br-(aq)
CH3OH(aq) + Br-(aq)
Pokud se tyto molekuly srazí ve správné orientaci, může být dvojice nevazebných elektronů na iontu OH- darována atomu uhlíku ve středu molekuly CH3Br, jak je znázorněno na obrázku níže.

Když k tomu dojde, vytvoří se vazba mezi uhlíkem a kyslíkem a zároveň se přeruší vazba mezi uhlíkem a bromem. Čistým výsledkem této reakce je záměna iontuOH- za ion Br -. Protože reakce probíhá v jednom kroku, který zahrnuje srážky mezi oběma reaktanty, je rychlost této reakce úměrná koncentraci obou reaktantů.
Rychlost = k(CH3Br)(OH-)
Ne všechny reakce probíhají v jednom kroku. Následující reakce probíhá ve třech krocích, jak ukazuje obrázek níže.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)

V prvním kroku se molekula (CH3)3CBr disociuje na dvojici iontů.
| První krok |  |
Kladně nabitý (CH3)3C+ ion pakreaguje s vodou ve druhém kroku.
| Druhý krok |  |
Produkt této reakce pak v posledním kroku ztrácí proton buď na OH-iont, nebo na vodu.
| Třetí krok |  |
Druhý a třetí krok této reakce jsou velmi rychlé nežprvní.
| (CH3)3CBr |
pomalý krok | |
| (CH3)3C+ + H2O |
rychlý krok | |
| (CH3)3COH2+ + OH- |
Rychlý krok |
Celková rychlost reakce je tedy víceméně rovna rychlosti prvního kroku. První krok se proto vtéto reakci nazývá krokem omezujícím rychlost, protože doslova omezuje rychlost, kterou mohou vznikat produkty reakce. Protože se na kroku omezujícím rychlost podílí pouze jedno činidlo, je celková rychlost reakce úměrná koncentraci pouze tohoto činidla.
Rychlost = k((CH3)3CBr)
Rychlostní zákon pro tuto reakci se tedy liší od toho, co bychom předpokládali ze stechiometrie reakce. Přestože se při reakci spotřebovávají jak (CH3)3CBr, tak OH-, rychlost reakce je úměrná pouze koncentraci (CH3)3CBr.
Rychlostní zákony pro chemické reakce lze vysvětlit pomocí následujících obecných pravidel.
Rychlost jakéhokoli kroku reakce je přímo úměrná koncentraci činidel spotřebovaných v tomto kroku.
Celkový zákon rychlosti reakce je určen posloupností kroků neboli mechanismem, kterým se reaktanty přeměňují na produkty reakce.
Celkovému zákonu rychlosti reakce dominuje zákon rychlosti pro nejpomalejší krok reakce.
.
