Fyzikální vlastnosti iontových a kovalentních sloučenin
Iontové a kovalentní sloučeniny mají obecně různé fyzikální vlastnosti. Iontové sloučeniny tvoří tvrdé krystalické pevné látky, které tají při vysokých teplotách a jsou odolné proti vypařování. Tyto vlastnosti vyplývají z charakteristické vnitřní struktury iontové pevné látky, schematicky znázorněné v části a) na obrázku 2.7.4, která ukazuje trojrozměrné uspořádání střídajících se kladných a záporných iontů držených pohromadě silnou elektrostatickou přitažlivostí. Naproti tomu, jak je znázorněno v části (b) na obrázku 9.5.1, většina kovalentních sloučenin se skládá z diskrétních molekul držených pohromadě poměrně slabými mezimolekulárními silami (silami mezi molekulami), přestože atomy v každé molekule jsou drženy pohromadě silnými vnitromolekulárními kovalentními vazbami (silami uvnitř molekuly). Kovalentní látky mohou být při pokojové teplotě a tlaku plyny, kapaliny nebo pevné látky v závislosti na síle mezimolekulárních interakcí. Kovalentní molekulární pevné látky mají tendenci tvořit měkké krystaly, které při nízkých teplotách tají a snadno se vypařují.
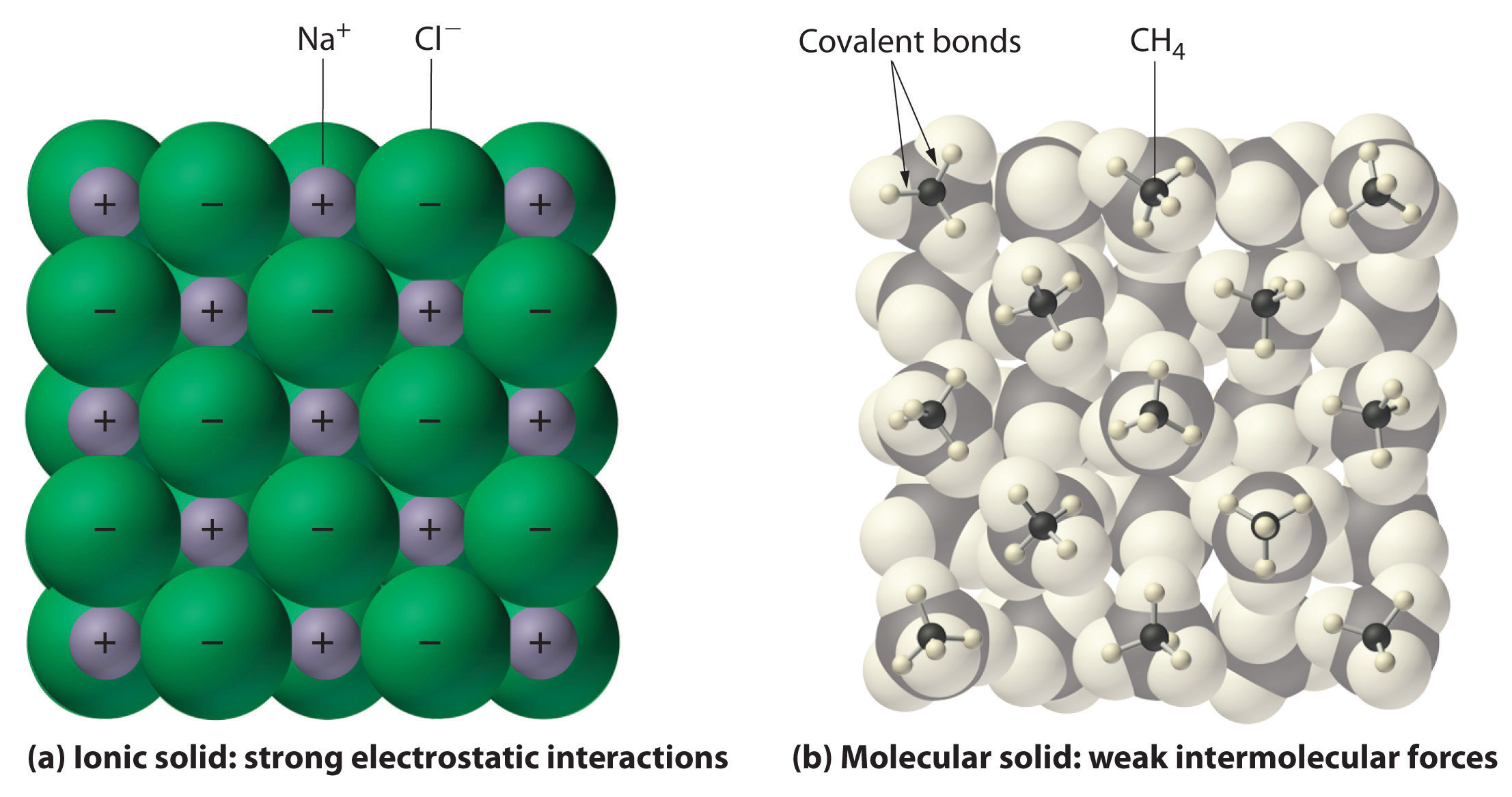
Obrázek 9.5.1. Kovalentní molekulární látky: Interakce v iontových a kovalentních pevných látkách. (a) Kladně a záporně nabité ionty v iontové pevné látce, jako je chlorid sodný (NaCl), jsou drženy pohromadě silnými elektrostatickými interakcemi. (b) Na tomto znázornění uspořádání molekul metanu (\(CH_4\)) v pevné látce metanu, prototypu molekulární pevné látky, jsou molekuly metanu v pevné látce drženy pohromadě pouze relativně slabými mezimolekulárními silami, přestože atomy v každé molekule metanu jsou drženy pohromadě silnými kovalentními vazbami.
Uhlovodíky
Molekulární pevné látky se skládají z atomů nebo molekul držených navzájem dipólovými interakcemi, Londonovými disperzními silami nebo vodíkovými vazbami, případně jejich libovolnou kombinací. Uspořádání molekul v pevném benzenu je následující:

Obrázek 9.5.2: Struktura pevného benzenu. V pevném benzenu nejsou molekuly uspořádány tak, aby jejich roviny byly navzájem rovnoběžné, ale svírají úhel 90°.
Protože mezimolekulární interakce v molekulární pevné látce jsou relativně slabé ve srovnání s iontovými a kovalentními vazbami, molekulární pevné látky bývají měkké, málo tající a snadno se odpařují (\(ΔH_{fus}\) a \(ΔH_{vap}\) jsou nízké). U podobných látek se síla londýnských disperzních sil plynule zvyšuje s rostoucí molekulovou hmotností. Například teploty tání benzenu (C6H6), naftalenu (C10H8) a anthracenu (C14H10) s jedním, dvěma a třemi sloučenými aromatickými kruhy jsou 5,5 °C, 80,2 °C a 215 °C v tomto pořadí. Entalpie fúze se v rámci řady rovněž plynule zvyšují: benzen (9,95 kJ/mol) < naftalen (19,1 kJ/mol) < antracen (28,8 kJ/mol). Pokud však mají molekuly tvary, které se nemohou v krystalu efektivně nabalit, pak teploty tání a entalpie tání bývají nečekaně nízké, protože molekuly se nemohou uspořádat tak, aby optimalizovaly mezimolekulární interakce. Proto mají toluen (C6H5CH3) a m-xylen teploty tání -95 °C, resp. -48 °C, které jsou výrazně nižší než teploty tání lehčího, ale symetričtějšího analogu, benzenu.
Samostatně se hojící kaučuk je příkladem molekulární pevné látky s potenciálem významného komerčního využití. Tento materiál se může roztáhnout, ale když se rozlomí na kousky, může se opět spojit dohromady obnovením své sítě vodíkových vazeb, aniž by vykazoval známky slabosti. Kromě jiných aplikací se zkoumá jeho využití v lepidlech a pneumatikách jízdních kol, které se samy zacelí.

Obrázek 9.5.3: Toluen a m-xylen. Methylové skupiny připojené k fenylovému kruhu v toluenu a m-xylenu brání tomu, aby se kruhy na sebe nabalovaly stejně jako v pevném benzenu.
.