
Napište sem své příklady.
- 9.1 Signalizační molekuly a buněčné receptory
- 9.2 Signalizační molekuly a buněčné receptory
- 9.2 Šíření signálu
- 9.3 Reakce na signál
Představte si, jaký by byl život, kdybyste vy a lidé kolem vás nemohli komunikovat. Nemohli byste ostatním vyjádřit svá přání, ani byste nemohli klást otázky, abyste se dozvěděli více o svém okolí. Sociální organizace je závislá na komunikaci mezi jednotlivci, kteří tuto společnost tvoří.
Stejně jako pro lidi je i pro jednotlivé buňky životně důležité, aby mohly komunikovat se svým okolím a mezi sebou navzájem. To platí bez ohledu na to, zda buňka roste sama v rybníce, nebo je jednou z mnoha buněk, které tvoří větší organismus. Aby buňky mohly správně reagovat na vnější podněty, vyvinuly si složité mechanismy komunikace, aby mohly přijmout zprávu, přenést informaci přes plazmatickou membránu a poté v reakci na zprávu vyvolat změny uvnitř buňky.
V mnohobuněčných organismech buňky neustále vysílají a přijímají chemické zprávy, aby koordinovaly činnost ostatních orgánů, tkání a buněk. Schopnost rychle a účinně vysílat zprávy umožňuje buňkám koordinovat a dolaďovat své funkce. Ačkoli se nutnost buněčné komunikace u větších organismů zdá být zřejmá, komunikují mezi sebou i jednobuněčné organismy. Buňky kvasinek si navzájem vysílají signály, které napomáhají páření. Některé formy bakterií koordinují své činnosti, aby vytvořily velké komplexy zvané biofilmy nebo aby organizovaly produkci toxinů k odstranění konkurenčních organismů. Schopnost buněk komunikovat prostřednictvím chemických signálů vznikla u jednotlivých buněk a byla nezbytná pro evoluci mnohobuněčných organismů. Účinná a bezchybná komunikace je nezbytná pro veškerý život.
- 9.1 | Signální molekuly a buněčné receptory
- 9.1.1 Formy signalizace
- Parakrinní signalizace
- Autokrinní signalizace
- Endokrinní signalizace
- Přímá signalizace
- 9.1.2 Typy receptorů
- Vnitřní receptory
- Receptory na povrchu buněk
- 9. Který z následujících kroků by byl inhibován přípravkem Lapatinib?1.3 Signální molekuly
- Malé hydrofobní ligandy
- Ligandy rozpustné ve vodě
- 9.2 | Šíření signálu
- 9.2.1 Signální dráhy a zesílení signálu
- 9.2.2 Metody vnitrobuněčné signalizace
- Fosforylace
- Druzí poslové
- 9.3 | Odpověď na signál
- 9.3.1 Reakce na signální dráhu
- Exprese genu
- Zvýšení buněčného metabolismu
- Růst buněk
- Buněčná smrt
- 9.3.2 Ukončení signálních drah
9.1 | Signální molekuly a buněčné receptory
Na konci této části budete schopni:
- Popsat čtyři typy signalizace, které se vyskytují u mnohobuněčných organismů.
- Srovnat vnitřní receptory s receptory na povrchu buněk.
- Rozpoznat vztah mezi chemickým složením ligandu a mechanismem jeho účinku.
Ve světě živých buněk existují dva druhy komunikace. Komunikace mezi buňkami se nazývá mezibuněčná signalizace a komunikace uvnitř buňky se nazývá vnitrobuněčná signalizace. Snadný způsob, jak si zapamatovat tento rozdíl, je pochopit, že předpona inter- znamená „mezi“ (mezistátní dálnice prochází mezi státy) a intra- znamená „uvnitř“ (kapačka znamená intravenózní nebo „uvnitř žíly“).
Chemické signály jsou uvolňovány signální buňkou a přijímány cílovou buňkou. Cílové buňky mají bílkoviny zvané receptory, které se vážou na signální molekuly a vyvolávají odpověď. Signální molekuly, které se vážou na receptory, se nazývají ligandy. Ligandy a receptory jsou pro sebe navzájem specifické; receptor se obvykle váže pouze na svůj specifický ligand. Existují však různé typy signalizace.
9.1.1 Formy signalizace
V mnohobuněčných organismech se vyskytují čtyři kategorie chemické signalizace: autokrinní signalizace, parakrinní signalizace, endokrinní signalizace a přímá signalizace přes gap junctions (obrázek 9.2). Hlavním rozdílem mezi jednotlivými kategoriemi signalizace je vzdálenost, kterou signál urazí, aby dosáhl cílové buňky.
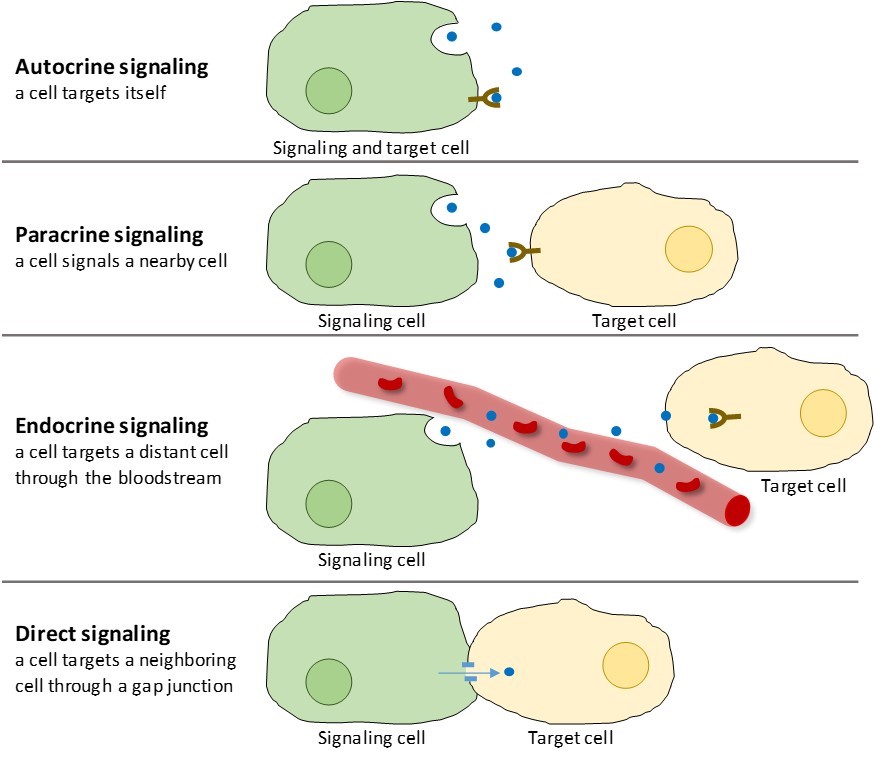
Parakrinní signalizace
Signály, které působí lokálně mezi buňkami, které jsou blízko sebe, se nazývají parakrinní signály. Parakrinní signály se pohybují difuzí přes extracelulární matrix (obr. 9.2). Tyto typy signálů obvykle vyvolávají rychlé reakce, které trvají jen krátkou dobu. Aby byla odpověď lokalizovaná, jsou parakrinní ligandy obvykle rychle degradovány enzymy nebo odstraněny sousedními buňkami. Odstraněním signálů se znovu vytvoří koncentrační gradient pro signální molekulu, což jim v případě opětovného uvolnění umožní rychle difundovat intracelulárním prostorem.
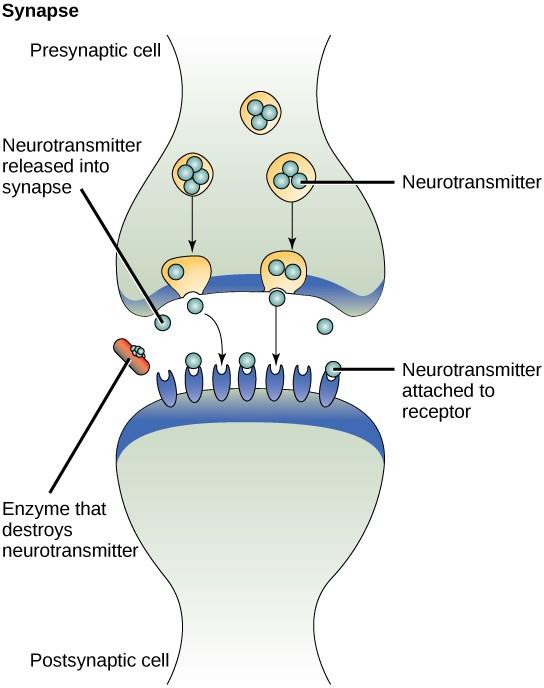
Jedním z příkladů parakrinní signalizace je přenos signálů mezi nervovými buňkami. Malý prostor mezi nervovými buňkami, kde dochází k přenosu signálu, se nazývá synapse. Signály se šíří podél nervových buněk pomocí rychle se pohybujících elektrických impulsů. Když tyto impulsy dosáhnou konce jedné nervové buňky, uvolní presynaptická buňka (buňka vysílající signál) do synapse chemické ligandy zvané neurotransmitery. Neurotransmitery se šíří napříč synapsií (obrázek 9.3). Malá vzdálenost mezi nervovými buňkami umožňuje rychlé šíření signálu, což umožňuje okamžitou reakci, například: „Sundej ruku ze sporáku!“. Když se neurotransmiter naváže na receptor na povrchu postsynaptické buňky, spustí se další elektrický impuls. Neurotransmitery jsou rychle odbourávány nebo jsou presynaptickou buňkou reabsorbovány, takže se přijímající nervová buňka může rychle zotavit a být připravena rychle reagovat na další synaptický signál.
Autokrinní signalizace
Když buňka reaguje na svou vlastní signální molekulu, nazývá se to autokrinní signalizace (auto = „sám“). Autokrinní signalizace se často vyskytuje společně s jinými typy signalizace. Například při uvolnění parakrinního signálu může signální buňka reagovat na signál spolu se svými sousedy (obrázek 9.2).
Autokrinní signalizace se často vyskytuje během raného vývoje organismu, aby se zajistil vývoj buněk do správných tkání. Autokrinní signalizace také reguluje vnímání bolesti a zánětlivé reakce. Dále, pokud je buňka infikována virem, může sama signalizovat, aby podstoupila programovanou buněčnou smrt, čímž dojde k usmrcení viru.
Endokrinní signalizace
Signály ze vzdálených buněk se nazývají endokrinní signály a pocházejí z endokrinních buněk. (V těle se mnoho endokrinních buněk nachází v endokrinních žlázách, jako je štítná žláza, hypotalamus a hypofýza). Tyto typy signálů obvykle vyvolávají pomalejší reakci, ale mají dlouhodobější účinek. Ligandy uvolňované při endokrinní signalizaci se nazývají hormony, signální molekuly, které jsou produkovány v jedné části těla, ale ovlivňují jiné oblasti těla v určité vzdálenosti (obrázek 9.2).
Hormony překonávají velké vzdálenosti mezi endokrinními buňkami a jejich cílovými buňkami prostřednictvím krevního oběhu, což je relativně pomalý způsob pohybu po celém těle. Vzhledem ke způsobu transportu se hormony ředí a v době, kdy působí na své cílové buňky, jsou přítomny v nízkých koncentracích. Tím se liší od parakrinní signalizace, při níž mohou být lokální koncentrace signálních molekul velmi vysoké.
Přímá signalizace
Přepážky u živočichů a plazmodesmata u rostlin jsou spojení mezi plazmatickými membránami sousedních buněk. Tyto vodou naplněné kanály umožňují difúzi malých signálních molekul mezi oběma buňkami. Malé molekuly, jako jsou ionty vápníku (Ca2+), se mohou pohybovat mezi buňkami, ale velké molekuly, jako jsou proteiny a DNA, se do kanálků nevejdou. Specifičnost kanálů zajišťuje, že buňky zůstávají nezávislé, ale mohou rychle a snadno přenášet signály. Přímá signalizace umožňuje skupině buněk koordinovat svou odpověď na signál, který mohla přijmout pouze jedna z nich. V rostlinách jsou plazmodesmata všudypřítomná, což z celé rostliny činí obří komunikační síť.
9.1.2 Typy receptorů
Receptory jsou molekuly bílkovin v cílové buňce nebo na jejím povrchu, které se vážou na ligandy. Existují dva typy receptorů, vnitřní receptory a receptory na povrchu buněk.
Vnitřní receptory
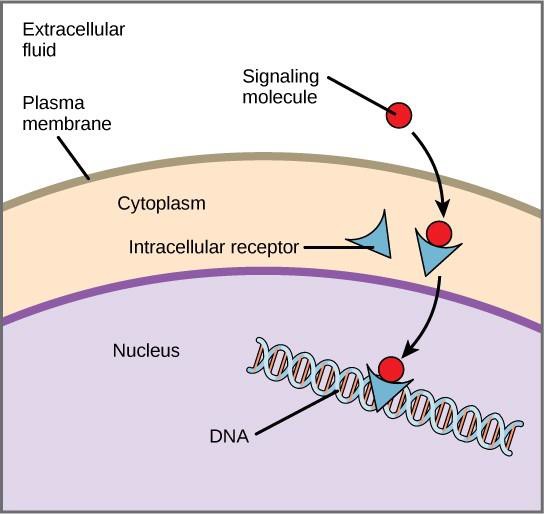
Vnitřní receptory, známé také jako intracelulární nebo cytoplazmatické receptory, se nacházejí v cytoplazmě cílových buněk a reagují na hydrofobní molekuly ligandů, které jsou schopny cestovat přes plazmatickou membránu. Po vstupu do buňky se mnohé z těchto molekul vážou na proteiny, které působí jako regulátory syntézy mRNA (transkripce) a zprostředkovávají tak expresi genů.
Exprese genů je buněčný proces přeměny informace v DNA buňky na sekvenci aminokyselin, která nakonec vytvoří protein. Když se ligand naváže na vnitřní receptor, dojde ke konformační změně, která odhalí vazebné místo DNA na receptorovém proteinu. Komplex ligand-receptor se přesune do jádra, poté se naváže na specifické regulační oblasti chromozomální DNA a podpoří zahájení transkripce (obrázek 9.4). Transkripce je proces kopírování informací v DNA buňky do speciální formy RNA zvané messengerová RNA (mRNA); buňka využívá informace v mRNA k propojení specifických aminokyselin ve správném pořadí, čímž vzniká protein. Když se tedy ligand naváže na vnitřní receptor, může přímo ovlivnit expresi genu v cílové buňce.
Receptory na povrchu buněk
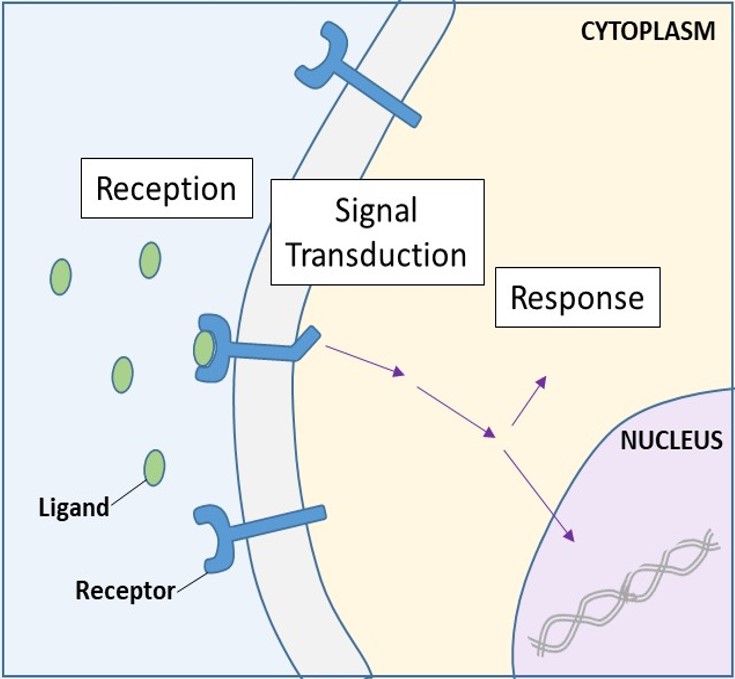
Receptory na povrchu buněk, známé také jako transmembránové receptory, jsou integrální proteiny, které se vážou na vnější signální molekuly. Tyto receptory překlenují plazmatickou membránu a provádějí transdukci signálu, při níž se extracelulární signál přeměňuje na mezibuněčný signál. (Obrázek 9.5). Protože receptorové proteiny na povrchu buněk mají zásadní význam pro normální fungování buněk, nemělo by být překvapením, že porucha některého z těchto proteinů může mít závažné důsledky. Bylo prokázáno, že chyby ve struktuře bílkovin některých receptorových molekul hrají roli při vzniku hypertenze (vysokého krevního tlaku), astmatu, srdečních onemocnění a rakoviny.
Každý receptor na buněčném povrchu má tři hlavní složky: vnější doménu vázající ligand neboli extracelulární doménu, hydrofobní membránovou oblast a intracelulární doménu. Receptory na povrchu buněk se podílejí na většině signalizace u mnohobuněčných organismů. Existují tři obecné kategorie receptorů na povrchu buněk: receptory vázané na enzymy, receptory vázané na iontové kanály a receptory vázané na G-proteiny.
Receptory vázané na enzymy jsou receptory na povrchu buněk s intracelulárními doménami, které jsou spojeny s enzymem. V některých případech je intracelulární doména receptoru sama enzymem. Jiné receptory vázané na enzym mají malou intracelulární doménu, která interaguje přímo s enzymem. Receptory vázané na enzym mají obvykle velké extracelulární a intracelulární domény, ale membránou procházející oblast se skládá z jediného alfa-helixu v peptidovém vlákně.
Když se ligand váže na extracelulární doménu receptoru vázaného na enzym, signál se přenáší přes membránu a aktivuje enzym. Aktivace enzymu spustí v buňce řetězec událostí, které nakonec vedou k odpovědi.
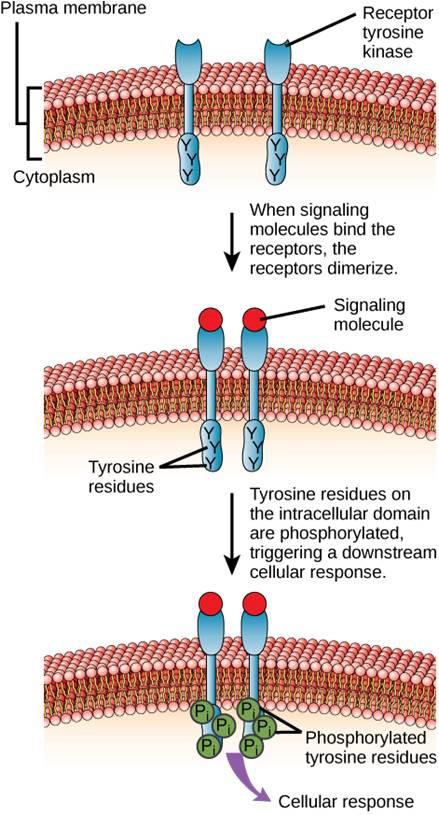
Jedním z příkladů enzymově vázaného receptoru je tyrozinkinázový receptor (obrázek 9.6). Kináza je enzym, který přenáší fosfátové skupiny z ATP na jiný protein. Tyrozinkinázový receptor přenáší fosfátové skupiny na molekuly tyrozinu. Nejprve se signální molekuly vážou na extracelulární doménu dvou blízkých tyrozinkinázových receptorů. Dva sousední receptory se poté spojí neboli dimerizují. Fosfáty se pak přidávají k tyrozinovým zbytkům na intracelulární doméně receptorů (fosforylace). Fosforylované zbytky pak mohou předat signál dalšímu poslíčkovi v cytoplazmě.
Receptory pro epidermální růstový faktor jsou příkladem receptorových tyrozinkináz, které se řídí tímto způsobem signalizace. Defekty v signalizaci ErbB této rodiny mohou vést k nervosvalovým onemocněním, jako je roztroušená skleróza a Alzheimerova choroba.
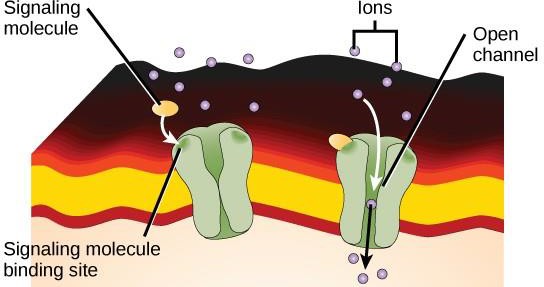
Receptory vázané na iontové kanály se vážou na ligand a otevírají kanál přes membránu, který umožňuje průchod specifických iontů. Tento typ receptoru na buněčném povrchu má rozsáhlou membránovou oblast s hydrofobními aminokyselinami. Naopak aminokyseliny, které lemují vnitřní stranu kanálu, jsou hydrofilní, aby umožnily průchod iontů. Když se ligand naváže na extracelulární oblast kanálu, dojde ke konformační změně struktury proteinu, která umožní průchod iontů, jako je sodík, vápník, hořčík nebo vodík (obrázek 9.7).
Receptory vázané na G-protein se vážou na ligand a aktivují přidružený G-protein. Aktivovaný G-protein pak interaguje s blízkým membránovým proteinem, kterým může být iontový kanál nebo enzym (obr. 9.8). Všechny receptory vázané na G-protein mají sedm transmembránových domén, ale každý receptor má specifickou extracelulární doménu a vazebné místo pro G-protein.
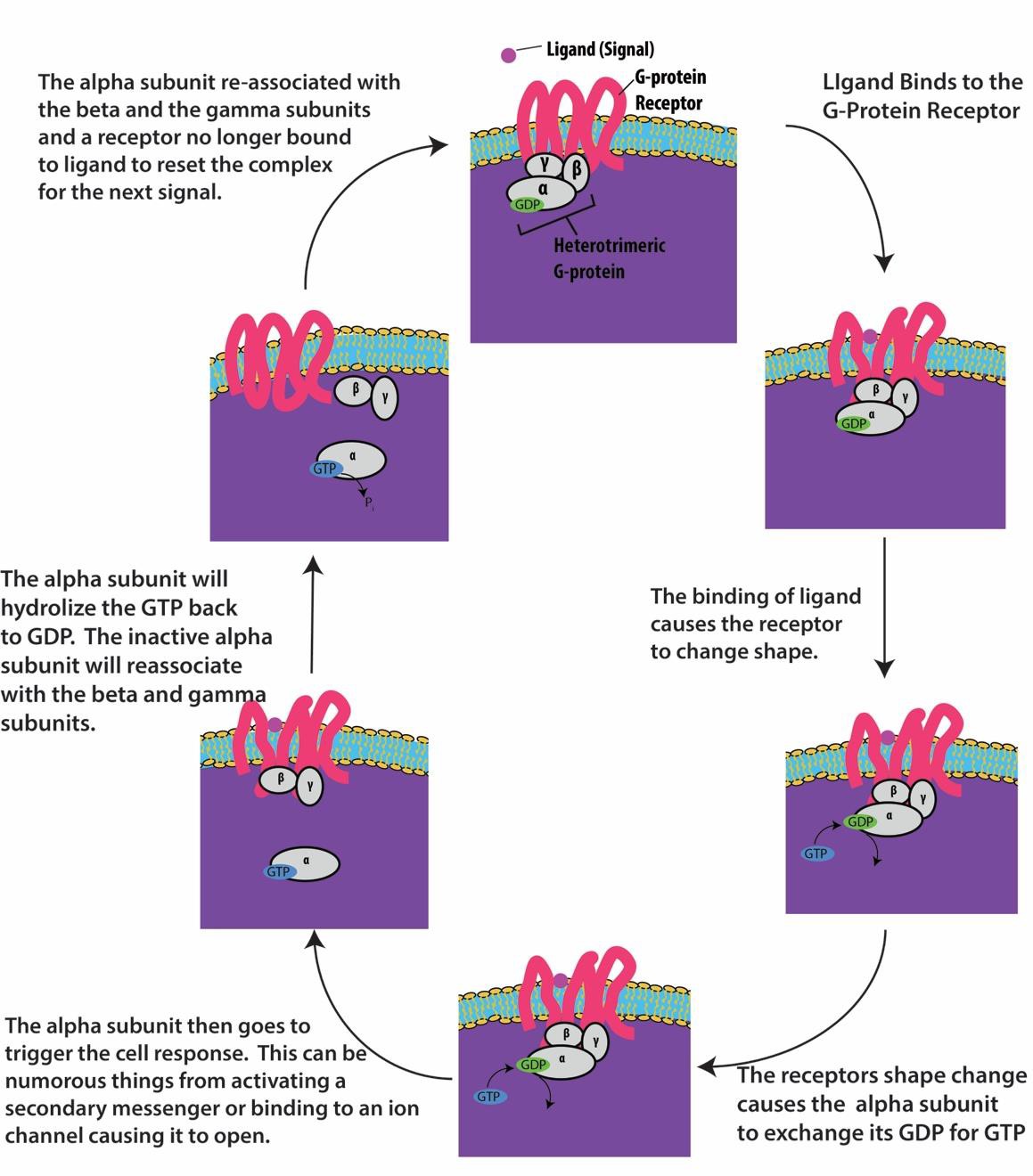
Buněčná signalizace pomocí receptorů vázaných na G-protein probíhá jako cyklus. Jakmile se ligand naváže na receptor, výsledná změna tvaru aktivuje G-protein, který uvolní GDP a vyzvedne GTP. Podjednotky G-proteinu se poté rozdělí na podjednotky α a βγ. Jeden nebo oba tyto fragmenty G-proteinu mohou být schopny aktivovat další proteiny v buňce. Po určité době se GTP na aktivní podjednotce α G-proteinu hydrolyzuje na GDP a podjednotka βγ je deaktivována. Podjednotky se znovu spojí a vytvoří neaktivní G-protein a cyklus začíná znovu (obrázek 9.8).
Receptory spojené s G-proteinem se používají v mnoha fyziologických procesech včetně těch pro přenos zraku, chuti a regulaci imunitního systému a zánětu.

HER2 je receptorová tyrozinkináza. U 30 % lidských karcinomů prsu je HER2 trvale aktivován, což vede k neregulovanému dělení buněk. Lapatinib, lék používaný k léčbě rakoviny prsu, inhibuje proces, při kterém se receptor fosforyluje, a snižuje tak růst nádoru o 50 procent. Který z následujících kroků by byl inhibován přípravkem Lapatinib?“
- Vazba signální molekuly, dimerizace a následná buněčná odpověď
- Dimerizace a následná buněčná odpověď
- Následná buněčná odpověď
- Fosfatázová aktivita, dimerizace a následná buněčná odpověď
9. Který z následujících kroků by byl inhibován přípravkem Lapatinib?1.3 Signální molekuly
Ligandy produkované signálními buňkami jsou chemické signály, které putují k cílovým buňkám a vyvolávají odpověď. Typy molekul, které slouží jako ligandy, jsou neuvěřitelně rozmanité a sahají od malých proteinů až po malé ionty. Ligandy se dělí buď na malé hydrofobní ligandy, které mohou procházet plazmatickými membránami, nebo na ligandy rozpustné ve vodě, které nemohou.
Malé hydrofobní ligandy
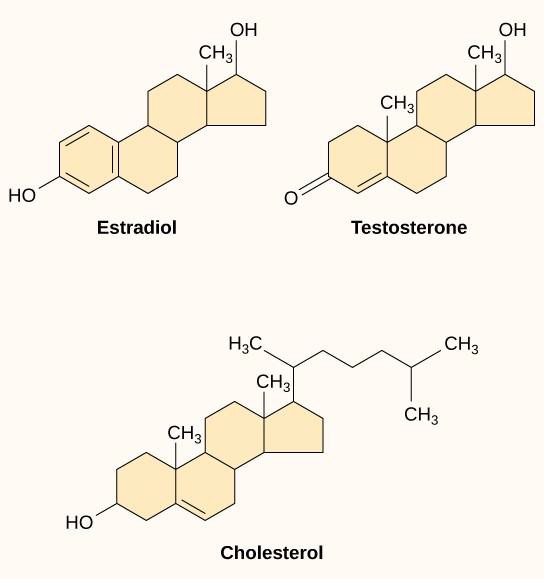
Malé hydrofobní ligandy, nazývané také ligandy rozpustné v lipidech, mohou přímo difundovat plazmatickou membránou a interagovat s vnitřními receptory. Důležitými zástupci této třídy ligandů jsou steroidní hormony. Steroidy jsou lipidy, které mají uhlovodíkový skelet se čtyřmi sloučenými kruhy; různé steroidy mají na uhlíkový skelet navázány různé funkční skupiny. Mezi steroidní hormony patří ženský pohlavní hormon estradiol, který je typem estrogenu, mužský pohlavní hormon testosteron a cholesterol, který je důležitou strukturní složkou biologických membrán a prekurzorem steroidních hormonů (obrázek 9.10). Mezi další hydrofobní hormony patří hormony štítné žlázy a vitamin D. Aby byly hydrofobní ligandy rozpustné v krvi, musí se při transportu krevním řečištěm vázat na nosné bílkoviny.
Ligandy rozpustné ve vodě
Protože ligandy rozpustné ve vodě jsou polární, nemohou bez pomoci procházet plazmatickou membránou. Někdy jsou příliš velké na to, aby membránou vůbec prošly. Místo toho se většina ve vodě rozpustných ligandů váže na extracelulární doménu receptorů na povrchu buněk (viz obrázek 9.5). Tato skupina ligandů je poměrně rozmanitá a zahrnuje malé molekuly, peptidy a proteiny.
9.2 | Šíření signálu
Na konci této části budete schopni:
- Vysvětlit, jak vazba ligandu iniciuje přenos signálu v celé buňce.
- Rozpoznat, že vnitrobuněčné signály jsou přenášeny pomocí úlohy fosforylace nebo druhých poslů.
Jakmile se ve vodě rozpustný ligand naváže na svůj receptor, signál je přenesen přes membránu do cytoplazmy. Pokračování signálu tímto způsobem se nazývá transdukce signálu (obr. 9.5). K transdukci signálu dochází pouze u receptorů na povrchu buňky, protože vnitřní receptory mohou vstoupit do buňky.
Když se ligand váže na svůj receptor, dochází ke konformačním změnám, které ovlivňují intracelulární doménu receptoru. Tyto konformační změny vedou k aktivaci intracelulární domény nebo s ní spojených proteinů. V některých případech vazba ligandu způsobí dimerizaci receptoru, což znamená, že se dva receptory navzájem spojí a vytvoří stabilní komplex nazývaný dimer. Dimer je chemická sloučenina, která vzniká spojením dvou molekul (často identických). Vazba receptorů tímto způsobem umožňuje, aby se jejich intracelulární domény dostaly do těsného kontaktu a vzájemně se aktivovaly.
9.2.1 Signální dráhy a zesílení signálu
Ačkoli se signální molekuly často vyskytují ve velmi nízkých koncentracích, mohou vyvolat hluboké účinky. Poté, co se ligand naváže na receptor na povrchu buňky, spustí aktivace intracelulárních složek receptoru řetězec událostí, který se nazývá signální dráha nebo signální kaskáda. V signální dráze druzí poslové, enzymy a/nebo aktivované proteiny aktivují další proteiny nebo posly (obrázek 9.11). Každý člen dráhy může aktivovat tisíce dalších členů dráhy v procesu zvaném zesílení signálu. Protože se signál v každém kroku zesiluje, může z jediného receptoru, který váže ligand, vzniknout velmi rozsáhlá odezva.
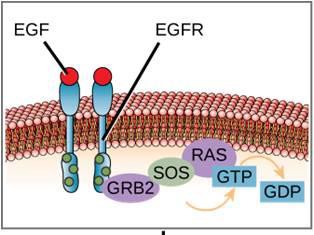
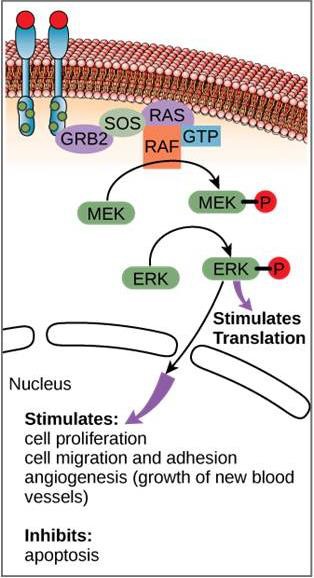
Příklad signální dráhy je znázorněn na obrázku 9.11. Epidermální růstový faktor (EGF) je signální molekula, která se podílí na regulaci buněčného růstu, hojení ran a obnově tkání. Receptor pro EGF (EGFR) je tyrozinkináza. Aktivovaná kináza fosforyluje a aktivuje mnoho navazujících molekul. Když se EGF naváže na EGFR, kaskáda navazujících fosforylačních dějů dá buňce signál k růstu a dělení. Pokud je EGFR aktivován v nevhodnou dobu, může dojít k nekontrolovanému růstu buněk (rakovině).
U některých druhů rakoviny je aktivita GTPázy G-proteinu RAS inhibována. To znamená, že protein RAS již nemůže hydrolyzovat GTP na GDP. Jaký vliv by to mělo na následné buněčné děje?“
9.2.2 Metody vnitrobuněčné signalizace
Indukce signální dráhy závisí na modifikaci buněčné složky enzymem. K aktivaci další složky dráhy může dojít mnoha enzymatickými modifikacemi. Níže jsou uvedeny některé z nejběžnějších dějů v nitrobuněčné signalizaci.
Fosforylace
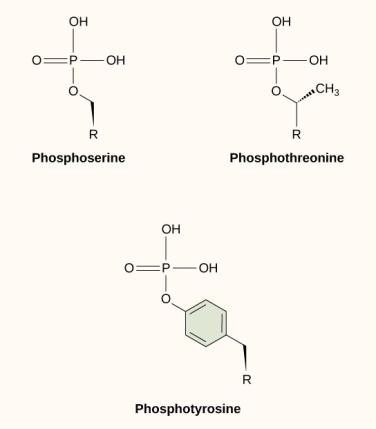
Jednou z nejběžnějších chemických modifikací, ke kterým dochází v signálních drahách, je přidání fosfátové skupiny k molekule v procesu zvaném fosforylace. Fosfát může být přidán k nukleotidu, jako je GMP, za vzniku GDP nebo GTP. Fosfáty se také často přidávají k serinovým, threoninovým a tyrosinovým zbytkům proteinů, kde nahrazují hydroxylovou skupinu aminokyseliny (obrázek 9.12). Přenos fosfátu katalyzuje enzym zvaný kináza. Fosforylace může aktivovat nebo inaktivovat enzymy a obrácení fosforylace, defosforylace, zvrátí účinek.
Druzí poslové
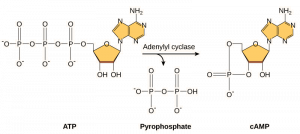
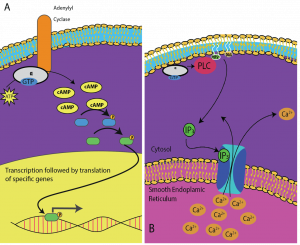
Druzí poslové jsou malé molekuly, které šíří signál poté, co byl iniciován vazbou signální molekuly na receptor. Tyto molekuly pomáhají šířit signál cytoplazmou tím, že mění chování určitých buněčných proteinů. Druhým poslem využívaným mnoha různými typy buněk je cyklický AMP (cAMP). Cyklický AMP je syntetizován enzymem adenylylcyklázou z ATP (obrázek 9.13). Hlavní úlohou cAMP v buňkách je vazba a aktivace enzymu zvaného cAMP-dependentní kináza (A-kináza). A-kináza reguluje mnoho životně důležitých metabolických drah: Fosforyluje serinové a threoninové zbytky svých cílových proteinů a aktivuje je přitom. A-kináza se vyskytuje v mnoha různých typech buněk a cílové proteiny se v každém druhu buněk liší. Dalším sekundárním poslem je Ca2+ , který se může uvolňovat a zaplavovat buňku.
Různé buňky reagují na cAMP různě. Na obrázku 9.14 je znázorněna podjednotka alfa z receptoru G-proteinu, která aktivuje dva různé typy signalizace. Na prvním obrázku je cAMP produkován enzymem adenylátcyklázou po aktivaci podjednotkou alfa. cAMP pak aktivuje další proteiny, které ovlivňují transkripci genů. Na druhém obrázku podjednotka alfa z G-proteinu spouští kaskádu, která uvolňuje Ca2+ z hladkého endoplazmatického retikula. V tomto případě je Ca2+ sekundárním poslem, který způsobuje buněčnou odpověď.
9.3 | Odpověď na signál
Na konci této části budete schopni:
- Rozpoznat, že signální dráhy řídí expresi proteinů, buněčný metabolismus a buněčný růst.
- Rozpoznat úlohu apoptózy ve vývoji a udržení zdravého organismu.
Pomocí signálních přenosových drah vyvolávají receptory v plazmatické membráně různé účinky na buňku. Uvnitř buňky se ligandy vážou na své vnitřní receptory, což jim umožňuje přímo ovlivňovat DNA a mechanismus buňky produkující bílkoviny. Výsledky signálních drah jsou velmi rozmanité a závisí na typu příslušné buňky i na vnějších a vnitřních podmínkách. Níže je popsán malý vzorek reakcí.
9.3.1 Reakce na signální dráhu
Exprese genu
Některé signální dráhy regulují přepis RNA. Jiné regulují translaci proteinů.
Zvýšení buněčného metabolismu
Aktivace β-adrenergních receptorů ve svalových buňkách adrenalinem vede ke zvýšení cyklického AMP uvnitř buňky. Adrenalin je hormon produkovaný nadledvinami, který připravuje organismus na krátkodobé krizové situace.
Růst buněk
Buněčné signální dráhy hrají významnou roli také při dělení buněk. Buňky se normálně nedělí, pokud nejsou stimulovány signály z jiných buněk. Ligandy, které podporují růst buněk, se nazývají růstové faktory. Většina růstových faktorů se váže na receptory na povrchu buněk, které jsou spojeny s tyrozinkinázami.
Buněčná smrt
Pokud je buňka poškozená, nadbytečná nebo potenciálně nebezpečná pro organismus, může buňka spustit mechanismus spouštějící programovanou buněčnou smrt neboli apoptózu. Apoptóza umožňuje buňce zemřít řízeným způsobem, který zabrání uvolnění potenciálně škodlivých molekul z nitra buňky. V některých případech, jako je virová infekce nebo nekontrolované dělení buněk způsobené rakovinou, však normální kontrolní mechanismy buňky selhávají. Apoptózu mohou iniciovat také vnější signály. Například většina normálních živočišných buněk má receptory, které interagují s extracelulární matrix, sítí glykoproteinů, která poskytuje živočišným buňkám strukturální podporu. Vazba buněčných receptorů na extracelulární matrix iniciuje v buňce signální kaskádu. Pokud se však buňka od extracelulární matrix vzdálí, signalizace ustane a buňka projde apoptózou. Tento systém pomáhá zabránit tomu, aby buňky putovaly tělem a nekontrolovaně se množily, jak se to stává u nádorových buněk, které metastazují.
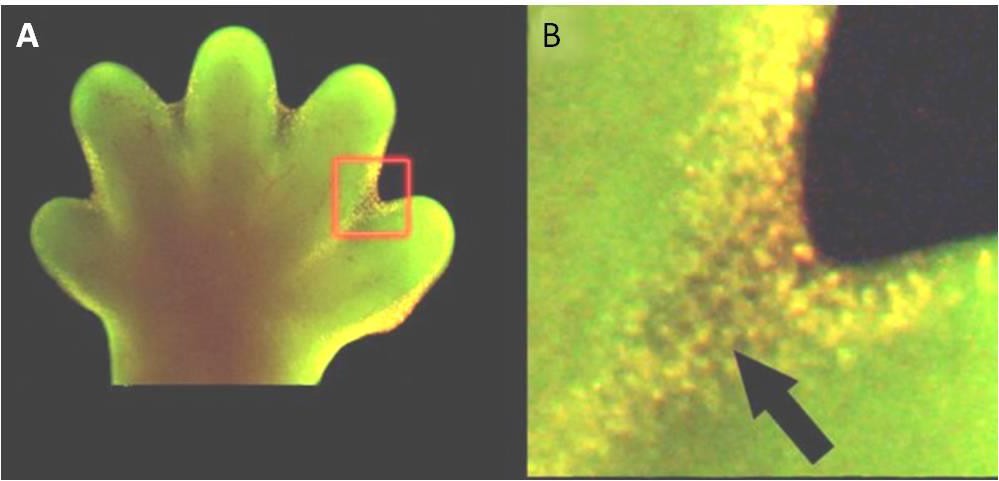
Apoptóza je rovněž nezbytná pro normální embryologický vývoj. Například u obratlovců dochází v raných fázích vývoje k tvorbě pavučinovité tkáně mezi jednotlivými prsty na rukou a nohou (obr. 9.15). V průběhu normálního vývoje musí být tyto nepotřebné buňky odstraněny, což umožní vznik plně oddělených prstů na rukou a nohou. Mechanismus buněčné signalizace spouští apoptózu, která ničí buňky mezi vyvíjejícími se prsty.
9.3.2 Ukončení signálních drah
Aberantní signalizace, která je často pozorována u nádorových buněk, je důkazem, že ukončení signálu ve vhodnou dobu může být stejně důležité jako jeho zahájení. Jednou z metod zastavení specifického signálu je degradace ligandu nebo jeho odstranění tak, aby již neměl přístup ke svému receptoru. Jedním z důvodů, proč hydrofobní hormony jako estrogen a testosteron vyvolávají dlouhotrvající děje, je to, že se vážou na nosné proteiny. Tyto proteiny umožňují, aby byly nerozpustné molekuly rozpustné v krvi, ale také chrání hormony před degradací cirkulujícími enzymy.
Vnitř buňky mnoho různých enzymů zvrátí buněčné modifikace, které jsou výsledkem signálních kaskád. Například fosfatázy jsou enzymy, které odstraňují fosfátovou skupinu připojenou k proteinům kinázami v procesu zvaném defosforylace. cAMP je fosfodiesterázou degradován na AMP, čímž je ukončen jeho signál. Podobně uvolňování zásob vápníku zvrátí Ca2+ pumpy, které se nacházejí v buněčných membránách.
.