Os tratamentos médicos mais comuns são concebidos para o “paciente médio” como uma abordagem de tamanho único, que pode ser bem sucedida para alguns pacientes, mas não para outros. A medicina de precisão, às vezes conhecida como “medicina personalizada” é uma abordagem inovadora para a prevenção e tratamento de doenças que leva em conta as diferenças nos genes, ambientes e estilos de vida das pessoas. O objetivo da medicina de precisão é direcionar os tratamentos certos para os pacientes certos no momento certo.
Os avanços na medicina de precisão já levaram a novas descobertas poderosas e tratamentos aprovados pela FDA que são adaptados às características específicas dos indivíduos, como a composição genética de uma pessoa, ou o perfil genético do tumor de um indivíduo. Pacientes com uma variedade de cânceres passam rotineiramente por testes moleculares como parte do cuidado ao paciente, permitindo aos médicos selecionar tratamentos que melhoram as chances de sobrevivência e reduzem a exposição a efeitos adversos.
- Testes de sequenciamento de gerações futuras (NGS)
- O papel da FDA no avanço da medicina de precisão
- Aprimoramento da Supervisão Regulatória de Testes NGS da FDA
- Orientação de Bancos de Dados Clínicos
- Guia de Validação Analítica
- FDA’s Bioinformatics Platform
- Questões?
- O que os funcionários da FDA estão dizendo
- GS Guias Finais
- Relatórios e Documentos de Discussão
- Reuniões anteriores
Testes de sequenciamento de gerações futuras (NGS)
Cuidados de precisão serão tão bons quanto os testes que orientam o diagnóstico e o tratamento. Os testes de Next Generation Sequencing (NGS) são capazes de identificar rapidamente ou ‘sequenciar’ grandes secções do genoma de uma pessoa e são avanços importantes nas aplicações clínicas da medicina de precisão.
Pacientes, médicos e pesquisadores podem usar esses testes para encontrar variantes genéticas que os ajudem a diagnosticar, tratar e entender mais sobre doenças humanas.
O papel da FDA no avanço da medicina de precisão
A FDA está trabalhando para garantir a precisão dos testes NGS, para que pacientes e clínicos possam receber resultados de testes precisos e clinicamente significativos.
A vasta quantidade de informação gerada através do NGS coloca novas questões regulatórias para a FDA. Embora as abordagens regulatórias atuais sejam apropriadas para diagnósticos convencionais que detectam uma única doença ou condição (como os níveis de glicemia ou colesterol), essas novas técnicas de sequenciamento contêm o equivalente a milhões de testes em um. Devido a isso, a FDA tem trabalhado com as partes interessadas na indústria, laboratórios, academia e sociedades de pacientes e profissionais para desenvolver uma abordagem regulatória flexível para acomodar essa tecnologia em rápida evolução que aproveita padrões consensuais, dados de origem pública, e tecnologia de computação de código aberto de última geração para apoiar o desenvolvimento de testes NGS. Essa abordagem permitirá a inovação em testes e pesquisas, e acelerará o acesso a testes genéticos precisos e confiáveis.
Aprimoramento da Supervisão Regulatória de Testes NGS da FDA
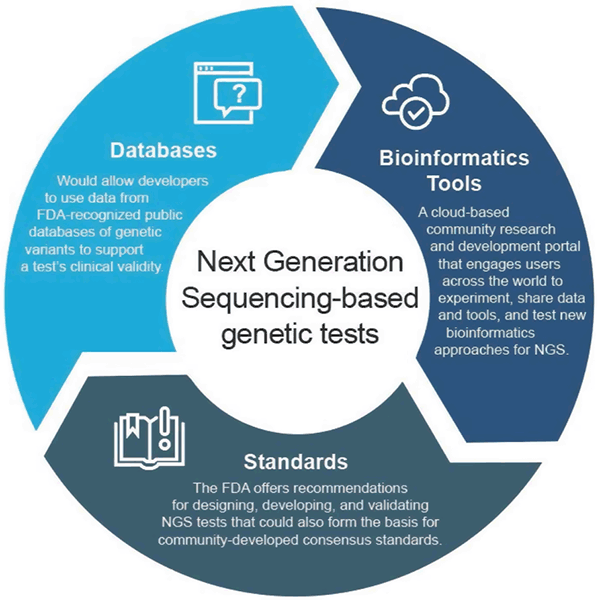
Em abril de 2018, a FDA emitiu duas diretrizes finais que recomendam abordagens para agilizar o envio e a revisão de dados que suportam a validade clínica e analítica dos testes baseados no NGS. Estas recomendações destinam-se a fornecer uma abordagem de supervisão regulamentar eficiente e flexível: à medida que a tecnologia avança, os padrões podem evoluir rapidamente e ser usados para estabelecer métricas apropriadas para campos de rápido crescimento, como o NGS. Da mesma forma, à medida que a evidência clínica melhora, novas afirmações podem ser apoiadas. Essa abordagem adaptativa acabaria por promover inovação entre os desenvolvedores de testes e melhorar o acesso dos pacientes a essas novas tecnologias.
Orientação de Bancos de Dados Clínicos
A orientação final “Uso de Bancos de Dados Públicos de Variantes Genéticas Humanas para Apoiar a Validade Clínica para Diagnóstico Genético e Genômico In Vitro” permite que os desenvolvedores usem dados de bancos de dados públicos de variantes genéticas reconhecidos pela FDA para ajudar a apoiar a validade clínica de um teste e delineia como os administradores de bancos de dados podem buscar o reconhecimento de seus bancos de dados se atenderem a certas recomendações de qualidade. Essa abordagem incentiva o compartilhamento de dados e fornece um caminho mais eficiente para o mercado.
Mais informações sobre reconhecimento de bancos de dados estão disponíveis na página da web do FDA sobre Reconhecimento de Bancos de Dados de Variantes Genéticas Humanas Públicas.
Guia de Validação Analítica
A orientação final “Considerações para Desenho, Desenvolvimento e Validação Analítica da Próxima Geração Seqüencial (NGS) – Based In Vitro Diagnostics (IVDs) Destinada a Auxiliar no Diagnóstico de Suspeitas de Doenças de Germes” oferece recomendações para o desenho, desenvolvimento e validação de testes NGS. A orientação também encoraja o envolvimento da comunidade no desenvolvimento de padrões relacionados à NGS por organizações desenvolvedoras de padrões (SDOs), uma vez que os padrões podem evoluir mais rapidamente com mudanças na tecnologia e no conhecimento e, portanto, podem ser usados para estabelecer métricas apropriadas, tais como limites de desempenho específicos para campos de rápido crescimento como o NGS.
FDA’s Bioinformatics Platform
A FDA criou o precisionFDA, um portal de pesquisa e desenvolvimento comunitário baseado em nuvem que envolve usuários em todo o mundo para compartilhar dados e ferramentas para testar, pilotar e validar abordagens existentes e novas da bioinformática para o processamento de NGS. Indivíduos e organizações da comunidade genômica podem encontrar mais informações e se inscrever para participar em http://precision.fda.gov.
Questões?
Por favor, entre em contato conosco com qualquer dúvida sobre os esforços da FDA em relação à medicina de precisão em [email protected].
O que os funcionários da FDA estão dizendo
- FDA finaliza as diretrizes para acelerar o desenvolvimento de medicamentos confiáveis, testes baseados em seqüenciamento de próxima geração benéficos
GS Guias Finais
- Utilização de Bancos de Dados de Variantes Genéticas Humanas Públicas para Apoiar a Validade Clínica para Diagnóstico In Vitro Genético e Genômico – Orientação para Partes Interessadas e Funcionários da Administração de Alimentos e Medicamentos (PDF – 444KB)
- Considerações para Design, Desenvolvimento, e Validação Analítica da Próxima Geração Sequencial (NGS) – Based In Vitro Diagnostics (IVDs) Destinado a Auxiliar no Diagnóstico de Doenças Suspeitas de Germes – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 869KB)
Relatórios e Documentos de Discussão
- Optimização dos Testes de Diagnóstico de Sequenciamento da Próxima Geração da FDA (PDF – 424KB)
- Relatório: Pavimentar o caminho para a medicina personalizada (Arquivado)
Reuniões anteriores
- 07/27/16: Webinar – Guias de Rascunho para o Sequenciamento da Próxima Geração (NGS): Implicações para pacientes e provedores
- 07/27/16: Webinar – Rascunho de Diretrizes de Seqüenciamento da Próxima Geração (NGS): Aspectos técnicos e regulamentares
- 11/13/2015: Workshop Público – Uso de Bases de Dados para o Estabelecimento da Relevância Clínica das Variantes Genéticas Humanas
- 11/12/2015: Abordagem Baseada em Padrões para Avaliação do Desempenho Analítico da Próxima Geração de Testes de Diagnóstico In Vitro
- 02/20/2015: Workshop Público de Otimização da Supervisão Regulamentar da Próxima Geração de Testes de Diagnóstico Seqüenciais da FDA