Trifosfato de guanosina (Guanosina-5′-trifosfato para ser mais preciso ou também abreviado GTP para simplificar) é um nucleotídeo de alta energia (não confundir com nucleosídeo) encontrado no citoplasma ou polimerizado para formar a base da guanina.
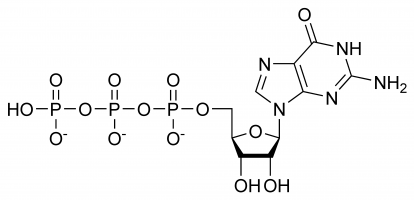
GTP tem papéis selectivos na formação de filamentos de RNA, funcionando como uma molécula transportadora de energia para a síntese de proteínas, uma coenzima, um predecessor do GTP – uma molécula mensageira secundária ou como uma molécula efetora. As duas últimas são comumente demonstradas pela modulação da proteína G. Todas elas são o resultado da sua complexa estrutura tridimensional e da variedade de diferentes grupos químicos que a compõem. Para simplificar pode, portanto, ser pensado como uma maldade de diferentes grupos funcionais que praticamente desempenham diferentes funções isoladamente (embora por vezes a estrutura esteja envolvida, por exemplo, quando interage com uma enzima e outro substrato), por exemplo, apenas o trifosfato está envolvido na libertação de energia para a polimerização enquanto que apenas a base guanina está envolvida na sua desaminação. É importante notar que a lista dada no início não exalta as suas interacções químicas, mas é apenas uma demonstração das suas várias capacidades.
Em GTP o açúcar ribose é central para a disposição tridimensional das moléculas de guanina e trifosfato ligadas covalentemente. Este monossacarídeo fornece grupos hidroxil para reacções de condensação e ataques nucleófilos, sendo este último importante para a destruição das moléculas de RNA e, consequentemente, para a regulação da expressão genética. A molécula guanina e o trifosfato formam ligações covalentes nos átomos C’1 e C’5 respectivamente, no entanto, também é possível utilizar outros grupos hidroxil desde que a estrutura resultante não cause choque. Da perspectiva do purina é ligado como resultado de uma reacção de condensação a 9’N, que anteriormente tinha sido ligado covalentemente a um átomo de hidrogénio. Como a guanina é uma base purina, é classificada como um trifosfato de purina juntamente com o trifosfato de adenina (ATP) e é formada através da modificação do monofosfato de inosina.
Conteúdo
- 1 Conceito errado: GTP, A Baseline Building Block
- 2 One Of Many RNA Base Predecesors
- 3 GTP; A Cousin of Universal ATP
- 4 A Resource for Signalling
- 5 Referências
Misconcepção: GTP, A Baseline Building Block
O fígado é o órgão principal que sintetiza os nucleótidos purine e piramidina. Os nucleotídeos puros (GTP e ATP) são sintetizados criando primeiro monofosfato de inosina a partir de ATP, glutamina, glicina, CO2, aspartato e formate. IMP
pode então ser modificado para produzir qualquer uma das moléculas.
No caso da formação de GTP o IMP é primeiro convertido em XMP por IMP desidrogenase. A mudança química e estrutural resultante permite a ação da GTP sintase que rapidamente converte XMP em GMP. Entretanto, GMP não é uma molécula de alta energia pois não possui um trifosfato, então é fosforilado por quinases de fosfato nucleosídeos para primeiro produzir um difosfato e eventualmente um trifosfato.
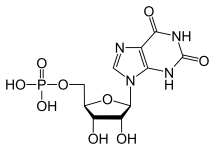
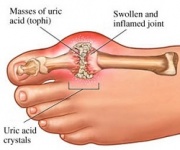
GTP é normalmente catabolizado em ácido úrico insolúvel que pode então surgir na urina como cristais de urato de sódio. Este processo é considerado anormal se ocorrer nas articulações sinoviais, resultando em ácido úrico que é então convertido em monossódico nocivo ou pirofosfato de cálcio dihidratado. A prescrição de tais produtos químicos permite o desenvolvimento de inflamação e artrite e os sintomas combinados levam à classificação da doença como gota. Outro exemplo da importância do catabolismo apropriado dos nucleotídeos puros é a Imunodeficiência Combinada Grave que resulta na destruição dos linfócitos essenciais B e T
Um De Muitos Predecessores de Base de RNA
Existem várias diferenças entre o RNA e o DNA, mas a principal distinção está na estrutura das nucleobases que constroem cada polímero. As nucleobases de RNA contêm um grupo 2’OH no seu açúcar ribose, o que lhes permite serem significativamente mais reactivas quimicamente, catalíticas e instáveis. É importante notar que o trifosfato de guanosina só está preocupado com a produção da base de guanosina no RNA. O análogo do GTP para a formação de uma base de guanina no DNA é o trifosfato de desoxiganosina. Este trifosfato contém um açúcar desoxirribose sem um grupo
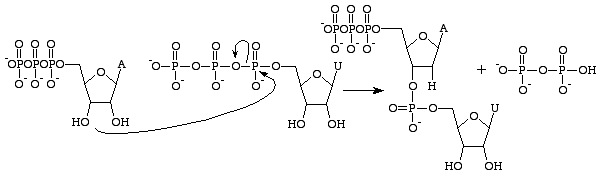
2’OH o que o torna significativamente mais estável – prevenindo ataques nucleofílicos que fenderiam as ligações fosfodiéster entre as nucleobases. Isto é ideal, pois o RNA deve ser desintegrado após ter sido traduzido em uma proteína, enquanto o DNA tem que permanecer intacto para a passagem de informação genética para a célula filha.
Guanosina trifosfato resultará na formação de uma base de guanina como resultado da clivagem de uma ligação de anidrido e liberação de alfa e fosfatos gama como fosfatos livres. O GMP irá então formar uma ligação fosfodiéster com o grupo próximo 3’OH contendo base, e fornecer um grupo 3’OH para a próxima base de RNA. Esta reação só ocorre se a base oposta à GMP for citosina com a qual ela pode formar ligações de hidrogênio e sua taxa é aumentada pela RNA polimerase. A RNA polimerase não alinha os trifosfatos. Ela apenas catalisa a reação que ocorre após isto ter sido feito de forma independente. Após a catálise, a molécula faz parte de uma cadeia de polinucleotídeos e não é mais conhecida como GTP, mas como a guanina base.
GTP; Um Primo do ATP Universal
O mecanismo subjacente de produção de energia a partir da clivagem da ligação de anidrido é o mesmo em todos os trifosfatos. O status de alta energia dos trifosfatos é alcançado através de três mecanismos distintos. O primeiro é devido às forças repulsivas
em cada um dos grupos de fosfatos. Isto contribui para uma alta instabilidade dos trifosfatos ligados e um alto “desejo” de alcançar um estado de menor energia. O segundo é devido à estabilização da ressonância. Quando GTP é
convertido em PIB a quantidade de posições possíveis para os pares de electrões existentes aumenta, emprestando a uma maior estabilidade. Este argumento também é sustentado com a conversão do PIB em GMP. O terceiro é devido ao efeito antrópico desfavorável que uma maior quantidade de fosfatos tem sobre a conformação das moléculas de água que envolvem a molécula.
Desde que a concentração de GTP no citoplasma é significativamente menor do que a de ATP, ele é usado para funções específicas nos processos metabólicos celulares.
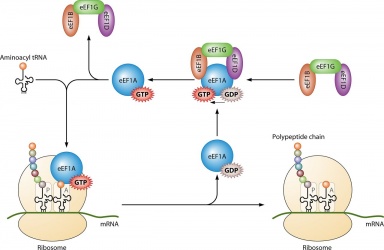
O seu uso principal é na síntese de proteínas quando acoplado com IF2 durante a iniciação ribossómica, Ef-Tu e Ef-G durante a elongação e ;RF3 durante a terminação. Todas as moléculas de GTP que se ligam com as proteínas indicadas tornam-se desfosforadas, resultando em PIB e um fosfato livre
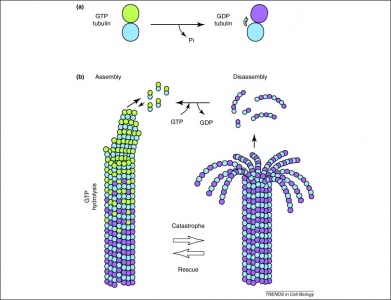
Além disso, o GTP também é utilizado por dímeros de tubulina na sua formação de microtúbulos. Os dímeros tubulínicos são compostos por tubulinas alfa e beta, cada uma das quais possui locais de ligação de GTP. Uma vez que a tubulina beta existe no extremo mais positivo do filamento, o GTP é sempre hidrolisado aqui quando outro dímero é adicionado ao polímero de alongamento. Importante, a hidrólise do GTP enfraquece as interações não covalentes entre os dímeros da tubulina, o que resulta em uma capacidade facilitada de dissolver os microtúbulos quando necessário. Note que a proteína alfa tubulínica GTP não é desfosforizada, pelo que pode ser considerada consistente através da estrutura do microtubulo.
A Resource for Signalling
O uso da química específica e da conformação espacial do GTP é efetivamente demonstrado pelo seu uso na transmissão de sinais. Em primeiro lugar, ele é capaz de ligar e regular a atividade de diferentes proteínas de vias de sinalização que são classificadas em dois grupos diferentes. O primeiro são as proteínas heterotriméricas de ligação ao GTP (também conhecidas como proteínas G heterotriméricas) que utilizam o GTP na ativação de receptores acoplados à proteína G a fim de modificar a atividade de outras proteínas na via. A segunda são as proteínas de ligação GTP monomérica (também conhecidas como proteínas G monoméricas). Estas respondem a receptores que não os receptores de proteína G acoplada. Um exemplo típico citado durante sua explicação é a proteína Ras. Note que elas são capazes de ligar GTP seletivamente não apenas devido à sua química específica, mas também devido ao fenômeno de ajuste induzido. O GTP ligado será então hidrolisado após um certo período de tempo e assim resultará em uma auto-ativação da proteína e prevenção da estimulação excessiva de um caminho de sinalização. Depois que o GTP for hidrolisado, o GDP permanecerá ligado, já que a mudança conformacional resultará em uma mudança de afinidade em direção à molécula GTP e à molécula GDP. No entanto, esta é uma mudança de impernimento e pode ser revertida pela subsequente activação pelo receptor acoplado à proteína G.
GTP também pode ser usado como um reagente para produzir cGMP que é uma molécula de sinalização secundária relativamente comum. A catálise é desencadeada pela liberação de NO que ativa a guanilato ciclase, uma enzima que produz o GMPc sob a forma de GTP. O GMPc pode então atuar como um efeito para a proteína kinases que fosforilato e modificar a ação de proteínas específicas.
- J Koolman e KH Roehm, Atlas de cores da Bioquímica, 3ª edição, Stuttgart, Alemanha. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell e P A Weil. Harper’s Illustrated Bioquímica. 28ª Edição. Pequim, China. 2009.
- J Dow, G Lindsay e J Morrison, Biochemistry: Moléculas, Células e o Corpo. 1ª Edição. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Bioquímica: Moléculas, Células e o Corpo. 1ª Edição. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Bioquímica: Moléculas, Células e o Corpo. 1ª Edição. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Alemanha. Thieme 2013.
- J Koolman e KH Roehm, Atlas de Cores de Bioquímica, 3ª Edição, Stuttgart, Alemanha. Thieme 2013.
- M W W King. A Página de Bioquímica Médica. Setembro 2016. Citado: 11:31. 03.12.2016. Disponível em: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell e P A Weil. Harper’s Illustrated Bioquímica. 28ª Edição. Pequim, China. 2009.
- M W W King. A Página de Bioquímica Médica. Setembro de 2016. Citado: 11:31. 03.12.2016. Disponível a partir de: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. A Página de Bioquímica Médica. Setembro 2016. Citado: 11:31. 03.12.2016. Disponível a partir de: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. A Página de Bioquímica Médica. Setembro 2016. Citado: 11:31. 03.12.2016. Disponível a partir de: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. A Página de Bioquímica Médica. Setembro 2016. Citado: 11:31. 03.12.2016. Disponível em: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay e J Morrison, Biochemistry: Moléculas, Células e o Corpo. 1ª Edição. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Bioquímica: Moléculas, Células e o Corpo. 1ª Edição. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Dow, G Lindsay e J Morrison, Bioquímica: Moléculas, Células e o Corpo. 1ª Edição. Wokingham, Inglaterra. Addison-Wesley. 1996.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Alemanha. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto e R Stryer. Bioquímica. Oitava Edição. Cidade e País Não identificado. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto e R Stryer. Biochemistry. Oitava Edição. Cidade e País Não Identificado. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto e R Stryer. Biochemistry. Oitava Edição. Cidade e País Não Identificado. Freeman and Co. 2015.
- T E Dever e R Green. As fases de Alongamento, Terminação e Reciclagem em Eukaryotes. CSHPB. Julho de 2012. 4:7:1-16
- B Alberts et al. A Biologia Molecular da Célula. 6ª Edição. Nova York, EUA. Garland Science. 2015.
- B Alberts. Biologia Molecular da Célula. 6ª Edição. Nova York, EUA. Garland Science. 2015.
- J Koolman and KH Roehm, Color Atlas of Biochemistry, 3rd Edition, Stuttgart, Alemanha. Thieme 2013.
- J Koolman e KH Roehm, Atlas de Cores de Bioquímica, 3ª Edição, Stuttgart, Alemanha. Thieme 2013.
- J Koolman e KH Roehm, Atlas de Cores de Bioquímica, 3ª Edição, Stuttgart, Alemanha. Thieme 2013.
- J Koolman e KH Roehm, Atlas de Cores de Bioquímica, 3ª Edição, Stuttgart, Alemanha. Thieme 2013.