- trans-Cinnamaldehyde Chemical Properties,Uses,Production
- Overview
- Farmacocinética
- Aplicações
- Toxicidade
- Propriedades químicas
- Propriedades Químicas
- Propriedades Químicas
- Definição
- Síntese Referência(s)
- Descrição Geral
- Air &Reacções à água
- Perfil de reatividade
- Perigo de Fogo
- Potencial exposição
- Embarque
- Incompatibilidades
- Descarte de resíduos
trans-Cinnamaldehyde Chemical Properties,Uses,Production
Overview
Cinnamaldehyde, um antigo sabor derivado da Canela e de outras espécies do género Cinnamomum, atraiu agora interesses crescentes pela sua capacidade de prevenir o desenvolvimento da diabetes e das suas complicações. Como líquido amarelo e viscoso, a canela constitui 98% do óleo essencial da casca da canela, tendo sido primeiro isolada por Dumas e Péligot e depois sintetizada em laboratório pelo químico italiano Luigi Chiozza (1828-1889), em 1854. Em 2007, Subash et al. primeiramente relataram um efeito hipoglicêmico e hipolipidêmico da cinamaldeído sobre estreptozotocina (STZ) – induzido por ratos Wistar machos diabéticos. Desde então, a canela tem sido amplamente estudada em modelos animais de diabetes e obesidade.
Cassia ou canela chinesa é uma especiaria amplamente utilizada, extraída da casca interna da canela. A Cassia é utilizada há milhares de anos para fins medicinais e é considerada uma das 50 ervas fundamentais na medicina tradicional chinesa. Várias partes da planta Cassia são utilizadas para fins medicinais, incluindo a raiz, a casca, as folhas e as flores. Extratos de canela têm sido relatados como tendo vários efeitos benéficos, incluindo efeitos antialergênicos, antimicrobianos, antivirais, antioxidantes, gastroprotetores, angiogênicos e anti-Alzheimer, bem como atividades biológicas semelhantes à insulina. Os extratos de canela contêm vários compostos ativos, incluindo óleos essenciais (cinamaldeído e aldeído de canela), taninos, muco e carboidratos. Curiosamente, o cinamaldeído, também conhecido como aldeído cinâmico, mostra efeitos anti-obesidade, reduzindo o acúmulo de lipídios e diminuindo o receptor peroxisome ativado pelo proliferador-γ, a proteína CCAAT/enhancer-binding protein α, e a proteína aglutinante do elemento regulador do esterol 1. Além disso, o cinamaldeído inibe a ativação microglial induzida por lipopolissacarídeos, visando a proteína-1 relacionada ao receptor de lipoproteína de baixa densidade. Também foi relatado que a cinamaldeído tem efeitos antimutagênicos nas células cancerígenas.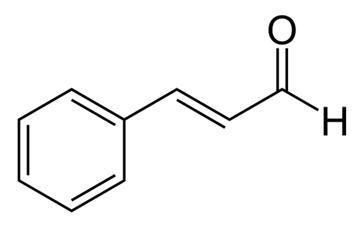
Figure 1 a estrutura química da Cinamaldeído;
Farmacocinética
Cinamaldeído existe naturalmente na forma de trans-cinamaldeído. Em um experimento realizado por Zhao et al. avalia a farmacocinética da cinamaldeído em ratos usando abordagem relativamente sensível da cromatografia gasosa espectrometria de massa (GC-MS) via oral (500 mg/kg) e injeção intravenosa (i.v.,20 mg/kg). Os resultados revelam que a AUC0-t de cinamaldeído via administração oral e via i.v. administração são 1984 ± 531 e 355 ± 53 ng h/ml, respectivamente. Os T1/2 e Tmax de cinamaldeído são mais longos para a administração oral (6,7 ± 1,5 h e 1,6 ± 0,5 h) do que para a administração i.v. (1,7 ± 0,3 h e 0,033 h). O Cmax é 249±36 ng/ml para administração oral, e 547±142 ng/ml para administração i.v., respectivamente. Os resultados indicam que a biodisponibilidade da cinamaldeído é melhor com a administração de i.v. do que com a administração oral.
Outros, os autores demonstram que Cmax e AUC0-t são proporcionais à dose (de 125 a 500 mg), enquanto Tmax e tempo médio de residência não se alteram em resposta ao aumento da dose. Considerando que o cinamaldeído e o álcool cinamílico podem se transformar um no outro em ratos, os autores também analisam a propriedade farmacocinética do álcool cinamílico no plasma de ratos. Os dados farmacocinéticos de álcool cinamílico são 1105±337 ng-h/ml para AUC0-t, 6,7±2,8 h para T1/2, 1,5±0,7 h para Tmax e 221±66 ng/ml para Cmax, na dosagem oral de 500 mg/kg. Curiosamente, o cinamato de metilo também foi descoberto nos metabólitos. Para propriedades farmacocinéticas do cinamato de metilo, os leitores interessados são encorajados a consultar o artigo de Zhao et al. Em resumo, a cinamaldeído é bem distribuída em todo o corpo após a absorção. O cinamaldeído tem a opção de se transformar em álcool cinamílico e também pode ser oxidado em ácido cinâmico após entrar no corpo. A fim de compreender completamente as propriedades farmacocinéticas do cinamaldeído, cinamato de metilo e álcool cinamílico também deve ser determinado no plasma. No entanto, a instabilidade da cinamaldeído põe em causa que a bioactividade da cinamaldeído seja provavelmente devida à soma dos seus metabolitos. Por isso, espera-se que novas tentativas respondam às potenciais preocupações. Além disso, a recém-desenvolvida PME-cinamaldeído com melhor biodisponibilidade também necessita de mais investigação do efeito antidiabético.
Aplicações
Os extractos de canela têm vários efeitos benéficos incluindo efeitos antialérgicos, antimicrobianos, antivirais, anti-oxidantes, gastro-protectores, anti-angiogénicos e anti-alzheimer, bem como actividades biológicas semelhantes à insulina. A cinamaldeído mostra efeitos anti-obesidade, reduzindo o acúmulo de lipídios e diminuindo a regulação do receptor peroxisome activado pelo proliferador-γ, CCAAT/ proteína ligante de reforço α, e a proteína ligante do elemento regulador do esterol 1. Além disso, a cinamaldeído inibe a activação microglial induzida por lipopolissacarídeos, visando a proteína-1 relacionada com o receptor de baixa densidade da lipoproteína. Também foi relatado que a cinamaldeído tem efeitos antimutagênicos nas células cancerígenas. O efeito da cinamaldeído no tratamento de câncer e diabetes é destacado abaixo:
Anticancer
Kwon et al. relataram pela primeira vez que extratos de canela induzem a morte celular in vitro e in vivo do melanoma através da inibição da NF-κB e AP-1. Um estudo subsequente mostrou que o HCA é o principal composto antitumorigênico encontrado em extratos de canela, exercendo seus efeitos inibidores de crescimento em 29 tipos de células cancerígenas humanas in vitro e em xenoenxertos tumorais humanos SW620 in vivo.
Outras equipes de pesquisa também relataram efeitos antitumorigênicos de extratos de canela. Eles inibem as células cancerosas melanoma induzindo a expressão de fatores pró-angiogênicos; eles também melhoraram as atividades antitumorigênicas das células CD8 T, aumentando sua atividade citolítica. Os extratos de canela também inibem o fator de crescimento endotelial vascular, o qual foi descoberto através da triagem de compostos para sua atividade inibitória contra o VEGFR2. A maioria dos efeitos antitumorigênicos dos extratos de canela pode ser atribuída à canela, o principal componente do óleo essencial, responsável pelo sabor e aroma da canela inteira. Foi relatado que a cinamaldeído inibiu a proliferação de células cancerígenas ao inibir a ciclina D1 em vários tipos de tumores. A canela também induz apoptose através da geração de espécies reativas de oxigênio nas células de leucemia HL-60 e através da ativação de proteínas pro-apoptóticas da família Bcl-2 e da via de sinalização MAPK nas células de hepatoma humano. Além disso, cinamaldeídos diméricos derivados de HCA mostraram maiores efeitos antitumorigênicos do que cinamaldeídos monoméricos ao induzir a apoptose e a parada do ciclo celular. Além disso, uma série de estudos revelou que os efeitos antitumorigênicos do HCA e seus derivados são mediados através de vários mecanismos moleculares. Um estudo recente mostrou que polifenóis contendo um andaime de cinamaldeído desencadearam a parada do ciclo celular na fase G2/M e a morte de células apoptóticas em células de câncer de ovário humano resistentes à cisplatina, sugerindo que os compostos de cinamaldeído poderiam ser eficazes em quimioterapias combinadas para pacientes com câncer. Em geral, os mecanismos moleculares subjacentes aos efeitos anticancerígenos e antimetastáticos da cinamaldeído são diversos, sugerindo que a cinamaldeído é um composto multitargeting. A resposta diferencial de vários cancros a diferentes derivados da cinamaldeído deve ser avaliada para permitir a selecção do composto mais eficaz para cada tipo de cancro.
Anti-diabetes
Etudos emergentes têm sido realizados ao longo das últimas décadas para avaliar o seu papel benéfico na gestão da diabetes e das suas complicações. Foi demonstrado que a administração oral de cinamaldeído variando de 20 mg/kg de peso corporal a 40 mg/kg-BW por dia durante um período de 21 a 60 dias resultou em uma melhora significativa nos níveis de glicose no sangue e hemoglobina glicosilada, bem como na sensibilidade insulínica em ratos diabéticos induzidos por STZ. E 20 mg/kg-BW é suposto ser a dose eficaz para prevenir o desenvolvimento da diabetes em animais. Além disso, o tratamento com cinamaldeído durante 4 semanas aumenta os níveis plasmáticos de insulina e o conteúdo de glicogênio hepático, assim como diminui os níveis de triglicérides e lipoproteínas de baixa densidade em ratos Wistar machos insultados por STZ e/ou HFD. Além disso, Camacho et al. descobriram que a administração com cinamaldeído por 5 semanas a ratos C57BL/6J alimentados com HFD levou a uma redução significativa no ganho de massa gorda corporal. Entretanto, eles alegaram que o tratamento com cinamaldeído não alterou os níveis plasmáticos de insulina em jejum e o consumo de ração. A razão para a inconsistência em relação à regulação da insulina pode ser atribuída ao facto dos antecedentes genéticos dos ratos C57BL/6J estarem alterados em algumas instalações de produção. Os diferentes substratos dos ratos podem apresentar diferenças significativas nos fenótipos. Além disso, a cinamaldeído pode exibir efeito de diminuição do glucose-baixo através da melhoria da sensibilidade insulínica na periferia do estudo de Camacho.
Cinamaldeído tem a capacidade de melhorar os tecidos adiposos diabéticos reduzindo a deposição de gordura visceral e promovendo a lipólise e oxidação de ácidos gordos e termogénese, que está associada a uma upregulação dos genes de gasto energético, uma inibição de PPARγ/CEBP-α e SREBP1, uma upregulação de HSL e PNPLA2 e MGL, uma indução de fosforilação AMPK e um aumento de Cpt1a no WAT e Acsl4 no BAT, bem como um estímulo do sistema nervoso simpático. Além disso, a cinamaldeído impede a expressão de genes inflamatórios e melhora a expressão dos GLUTs em animais diabéticos. A cinamaldeído pode proteger contra diabetes melhorando a sensibilidade insulínica e a absorção de glicose através da regulação da via PI3K/IRS-1 e RBP4-GLUT4 no tecido muscular esquelético, assim como regulando o metabolismo das mitocôndrias através da via PGC-1α/MEF2/GLUT4 nas células C2C12. A cinamaldeído também tem efeitos positivos no fígado diabético através da melhoria das sínteses de glicogênio, regulando as atividades de PK e PEPCK e diminuindo o nível de RBP4, bem como normalizando as enzimas hepáticas aberrantes, sugerindo um papel benéfico deste composto no metabolismo da glicose e sensibilidade insulínica no fígado diabético.
Efeitos antimicrobianos
Estudo confirmou a atividade antimicrobiana da cinamaldeído, cravo-da-índia, tomilho e alecrim contra E. coli O157:H7 e Salmonella. Wendakoon e Sakaguchi relataram que o grupo carbonilo da cinamaldeído se liga às proteínas, prevenindo a atividade do aminoácido descarboxilase em Enterobacter aerogenes. Smid et al. observaram os danos à membrana citoplasmática de Saccharomyces cerevisiae quando tratada com cinamaldeído, levando ao vazamento excessivo de metabólitos e enzimas da célula, e finalmente a perda de viabilidade. A maioria dos estudos tem sugerido que os modos de ação dos óleos essenciais dependem do tipo de microorganismos, principalmente de sua estrutura da parede celular e da disposição da membrana externa. Observaram danos devido às diferenças significativas nas membranas externas das bactérias gram-negativas e gram-positivas.
Toxicidade
Mesmo agora, ainda se assume que a canela é um agente natural de ingredientes seguro e bem tolerado em humanos e animais. O conceito também é bem aceito pelo FDA e pelo Conselho da Europa com sugestão da dose diária aceitável de 1,25 mg/kg.
Toxicidade aguda
Cinnamaldeído é relatado como tendo a alta margem de segurança, e administrado 20 vezes a dose efetiva(20 mg/kg) deste composto não causou sinais de comportamento anormais e valores séricos de química perturbados ao longo do estudo. A toxicidade aguda da cinamaldeído é baixa, com valores de dose oral mediana letal(LD50) variando de uma baixa de 0,6 g/kg de PV a uma alta de 3,4 g/kg de PV em diferentes espécies.
Toxicidade a longo prazo
Os resultados de um estudo de três meses mostram que os pesos corporais são reduzidos em ratos fêmeas expostas a 16.500 ou 33.000 ppm e em ratos fêmeas expostas a 8200 ppm ou mais. Além disso, o consumo de ração é reduzido em todos os grupos de ratos expostos e no grupo de ratos com a dose mais alta. Além disso, a exposição à cinamaldeído aumenta a incidência de hiperplasia epitélica escamosa da floresta. Além disso, os ratos expostos à cinamaldeído também apresentam aumento da incidência de degeneração epitelial olfatória da cavidade nasal. Todos os ratos sobreviveram durante o estudo de três meses.
Outros
Cinnamaldehyde também podem mostrar efeitos de citotoxicidade nos hepatócitos F344 de rato evidenciados por níveis de glutationa depleting glutathione, e nas células HepG2 evidenciados pelo aumento do número de micronúcleos. Behar et al. estudaram a potencial toxicidade deste produto em células embrionárias e pulmonares humanas. Os resultados demonstram que o tratamento com cinamaldeído despolimeriza microtúbulos em fibroblastos pulmonares humanos. A cinamaldeído também diminui a proliferação e diferenciação celular, inibindo o crescimento e diferenciação celular e alterando a morfologia e motilidade celular, bem como aumentando as quebras de filamentos de DNA e a morte celular. Um estudo realizado por Olsen et al. revela que a cinamaldeído causa irritação da pele ao aumentar o limiar de dor fria e diminuir o limiar de dor mecânica, bem como ao aumentar a temperatura e perfusão da pele no ser humano.
- Zhou M, Chen Z, Shen S. Recentes avanços sobre a cinamaldeído. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. A suplementação com cinamaldeído previne a hiperfagia induzida pelo jejum, o acúmulo de lipídios e a inflamação em ratos alimentados com dieta rica em gordura. BioFactores 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Osteoporose diabética: Uma revisão do seu uso medicinal tradicional chinês e pesquisa clínica e pré-clínica. Medicina complementar e alternativa baseada em evidências : eCAM 2016;2016:3218313.
- Dumas JP, E. Pesquisa química orgânica – sobre óleo de canela, o ácido hippúrico e o ácido sebácico. Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l’essence de cannelle”. Comptes rendus 1856;42:222-227.
- Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldehyde – um potencial agente antidiabético. Fitomedicina : revista internacional de fitoterapia e fitofarmacologia 2007;14:15-22.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013. O extrato de canela inibe a desgranulação e a nova síntese de mediadores inflamatórios em mastócitos. Alergia 68: 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006. Atividade antimicrobiana de óleos de canela e cravo sob condições atmosféricas modificadas. Int J Food Microbiol 107: 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. Inibidores de entrada de HIV tipo 1 com um novo modo de ação. Antivir Chem Chemother 19: 243-255.
- Yang CH, Li RX, Chuang LY. 2012. Atividade antioxidante de várias partes da Cinnamomum cassia extraída com diferentes métodos de extração. Moléculas 17: 7294-7304.
- Peterson DW et al. 2009. O extracto de canela inibe a agregação de tau associada à doença de Alzheimer in vitro. J Alzheimers Dis 17: 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012. Efeitos antidiabéticos in vivo e in vitro do extracto aquoso de canela e da matriz alimentar enriquecida com polifenóis de canela. Food Chem 135: 2994-3002.
- Kim JE et al. 2015a. Um novo produto natural relacionado com a canela com actividade inibitória do Pim-1 inibe a leucemia e o cancro da pele. Cancer Res 75: 2716-2728.
- Hwang H et al. 2011. 2′-Hidroxicinamaldeído tem como alvo a proteína-1 de baixa densidade relacionada com os receptores de lipoproteína para inibir a ativação microglial induzida por lipopolissacarídeos. J Neuroimmunol2011 230: 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. O efeito antimutagênico da vanilina e cinamaldeído na mutação espontânea em Salmonella TA104 é devido a uma redução das mutações em GC, mas não em AT. Mutat Res 480: 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. Progresso da investigação dos efeitos farmacológicos do trans-cinamaldeído. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Estudo farmacocinético da cinamaldeído em ratos por gc-ms após administração oral e intravenosa. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al. 1998. Síntese e citotoxicidade in vitro de cinamaldeídos a células tumorais sólidas humanas. Arch Pharm Res 21: 147-152.
- Lee CW et al. 1999. Inibição do crescimento do tumor humano por 2′-hydroxyand 2′-benzoyloxycinnamaldehydes. Planta Med 65: 263-266
- Kwon HK et al. 2009. O extrato de canela suprime a progressão tumoral através da modulação da angiogênese e da função efetora das células T CD8+. Cancer Lett 278: 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. Nova atividade inibitória da angiogênese em blocos de extrato de canela VEGFR2 kinase e sinalização a jusante. Carcinogénese 31: 481-488.
- Jeong HW et al. 2000. Cinnamaldeídos inibem a cinase 4/ciclina D1 dependente de ciclina. Bioorg Med Chem Lett 10: 1819-1822.
- Ka H et al. 2003. Cinamaldeído induz apoptose por ROSmediated mitocondrial permeability transition in human promyelocytic leukemia HL-60 cells. Cancer Lett 196: 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. Apoptose induzida por canela em células humanas PLC/PRF/5 através da activação das proteínas proapoptóticas da família Bcl-2 e da via MAPK. Life Sci 77: 938-951.
- Shin DS et al. 2006. Síntese e avaliação biológica de cinamaldeídos diméricos como agentes antitumorais potentes. Bioorg Med Chem 14: 2498-2506.
- Shin SY et al. 2014. Polifenóis portadores de cinamaldeído com efeitos inibidores do crescimento celular nas células cisplânticas resistentes ao câncer de ovário A2780/Cis. Bioorg Med Chem 22: 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. Composição química e efeito hipoglicémico e pâncreas-protector do óleo essencial de folha de canela indígena. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Cinnamaldehyde protege da hipertensão associada à diabetes. Food and chemical toxicology : uma revista internacional publicada para a British Industrial Biological Research Association 2011;49:3007-3012.
- Li M, Xu Y, Zhang W. Effects of cinnamaldehydehyde on the expression levels of irs-1 and p85 alpha in gastrocnemius of type 2 diabetic rats. Medical Journal of Wuhan University 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Gc-ms análise e triagem do potencial antidiabético, antioxidante e hipolipidêmico do óleo de canela tamala em estreptozotocina induzida por diabetes mellitus em ratos. Diabetologia Cardiovascular 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. Efeitos anti-obesidade e anti-hiperglicémicos da cinamaldeído via secreção de ghrelin alterada e impacto funcional na ingestão de alimentos e esvaziamento gástrico. Relatórios científicos 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR. O fundo de tensão do rato c57bl/6j modifica o efeito de uma mutação em bcl2l2. G3 2012;2:99-102.
- Mekada K, Abe K, Murakami A, Nakamura S, Nakata H, Moriwaki K, Obata Y, Yoshiki A. Diferenças genéticas entre os substratos c57bl/6. Animais experimentais 2009;58:141-149.
- Kiselycznyk C, Holmes A. Todos os ratos não são criados iguais. Fronteiras em neurociência 2011;5:10.
- Attane C, Peyot ML, Lussier R, Zhang D, Joly E, Madiraju SR, Prentki M. Secreção diferencial de insulina dos ratos c57bl/6nn e c57bl/6nj alimentados com dieta rica em gordura: Implicações da mistura genética em estudos metabólicos. PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK, Mermierd. CM, Conne. CA, Vaughanc. RA. Trans-cinnamaldeído estimula a biogénese mitocondrial através de pgc-1α e δ/δ levando a uma expressão melhorada de glut4. Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. Efeitos antidiabéticos da cinamaldeído e da berberina e seus impactos na expressão da proteína de ligação ao retinol 4 em ratos com diabetes mellitus tipo 2. Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Aumento da expressão de p85/55/50 e diminuição da atividade fosfo-tidylinositol 3-quinase no músculo esquelético humano resistente à insulina. Diabetes 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS. Impacto da deficiência hematopoiética de cicloxigenase-1 na inflamação do tecido adiposo ligado à obesidade e distúrbios metabólicos em camundongos. Metabolismo: clínico e experimental 2013;62:1673-1685.
- Ohaeri OC. Efeito do óleo de alho sobre os níveis de várias enzimas no soro e tecido de ratos diabéticos estreptozotocina. Bioscience reports 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH. Avaliação da lipocalina associada à gelatina neutrofílica (ngal) e proteína de ligação ao retinol 4 em pacientes diabéticos do tipo 2 com nefropatia. Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. e CORKE, H. 2007. Propriedades antibacterianas e principais componentes bioactivos do pau de canela: Actividade contra bactérias patogénicas de origem alimentar. J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K. e REMMAL, A. 2003. O mecanismo de ação bactericida dos óleos essenciais de orégãos e cravos de seus componentes fenólicos principais sobre Escherichia coli e Bacillus subtilis. J. Essent. Óleo Res. 15, 356-362.
- KIM, H.-O., PARK, S.-W. e PARK, H.-D. 2004. Inactivação da Escherichia coli O157:H7 por aldeído cinâmico purificado a partir de rebento de Cinnamomum cassia. Microbiol alimentar. 21, 105-110
- WENDAKOON, C. e SAKAGUCHI, M. 1995. Inibição da actividade do aminoácido descarboxilase de Enterobacter aerogenes por componentes activos em especiarias. J. Prot. alimentar. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. e GORRIS, L.G.M. 1996. Acção fungicida e fungistática dos metabolitos secundários das plantas cinamaldeído e carvona. In Modern Fungicidas e Compostos Antimicrobianos, pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. Da diabetes tipo 2 à actividade antioxidante: Uma revisão sistemática da segurança e eficácia da casca de canela comum e da casca de canela da cássia. Canadian journal of physiology and pharmacology 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Insulinotropic effect of cinnamaldehydeine on transcriptional regulation of pyruvate kinase, phosphoenolpyruvate carboxykinase, and glut4 translocation in experimental diabetic rats. Interações quimico-biológicas 2010;186:72-81.
- Gowder SJT. Avaliação da segurança do sabor dos alimentos -cinnamaldeído. Biosafety 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR. Estudos toxicológicos e de carcinogênese de trans-cinamaldeído microencapsulado em ratos e camundongos. Food and chemical toxicology : revista internacional publicada para a British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehydehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes. Toxicologia in vitro : revista internacional publicada em associação com BIBRA 1996;10:37-42.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens. Mutagénese 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribuição, quantificação e toxicidade da cinamaldeído em líquidos e aerossóis de recarga de cigarros electrónicos. Controle do tabaco 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Manifestações somatosensoriais e vasomotoras de estimulação individual e combinada do trpm8 e trpa1 usando l-menthol tópico e trans-cinnamaldeído em voluntários saudáveis. Revista europeia da dor 2014;18:1333-1342.
Propriedades químicas
trans-cinamaldeído é o componente principal do óleo de cássia (cerca de 90%) e do óleo de casca de canela do Sri Lanka (cerca de 75%). Quantidades mais pequenas são encontradas em muitos outros óleos essenciais. Na natureza, o isómero trans é predominante.
trans-Cinnamaldehydehyde é um líquido amarelado com um odor característico a especiarias, reminiscente da canela. Sendo um ??,??-aldeído insaturado, ele subestima muitas reações, das quais a hidrogenação ao álcool cinâmico, dihidrocinnamaldeído,e ao álcool dihidrocinâmico é importante. O ácido cinâmico é formado por autoxidação.
Em escala industrial, o cinamaldeído é preparado quase exclusivamente por condensação alcalina de benzaldeído e acetaldeído. A auto-condensação de acetaldeído pode ser evitada usando um excesso de benzaldeído e lentamente o acetaldeído.
Cinnamaldeído é usado em muitas composições para criar notas picantes e orientais (por exemplo, perfumes de sabão). É o principal componente do óleo de canela artificial. Além disso, é um importante intermediário na síntese de álcool cinâmico e álcool dihidrocinâmico.
Propriedades Químicas
LÍQUIDO AMARELO LÍQUIDO LIMPO
Propriedades Químicas
Líquido combustível, amarelado, oleoso (engrossa com a exposição ao ar). Forte odor pungente, picante, de canela.
Definição
ChEBI: O estereoisómero E (trans) da cinamaldeído, o pai da classe das cinamaldeídos.
Síntese Referência(s)
Cartas de Química, 12, p. 1207, 1983
Journal of the American Chemical Society, 93, p. 2080, 1971 DOI: 10.1021/ja00737a057
Cartas de Tetraedro, 18, p. 1215, 1977
Descrição Geral
Líquido amarelo claro com odor de canela e sabor doce.
Air &Reacções à água
Pode ser sensível à exposição prolongada ao ar e à luz. Insolúvel na água.
Perfil de reatividade
O trans-cinamaldeído é incompatível com agentes oxidantes fortes e bases fortes. O trans-cinamaldeído também pode reagir com hidróxido de sódio.
Perigo de Fogo
trans-cinamaldeído é combustível.
Potencial exposição
Fungicida e inseticida botânico. Usado como um agente antifúngico, atractivo do crisomelídeo do milho, e repelente de cães e gatos. Pode ser usado no invólucro do solo para cogumelos, culturas em linha, relva, e todos os produtos alimentares. Não listado para uso em países da UE.
Embarque
UN1989 Aldeídos, n.s.a., Classe de Perigo: 3; Rótulos: 3-Líquido inflamável
Incompatibilidades
Os aldeídos estão frequentemente envolvidos em reacções de autocondensação ou polimerização. Estas reacções são exotérmicas; são frequentemente catalisadas por ácido. Os aldeídos são prontamente oxidados para dar ácidos carboxílicos. Gases inflamáveis e/ou tóxicos são gerados pela combinação de aldeídos com azo, compostos diazóicos, ditiocarbamatos, nitretos e agentes redutores fortes. Os aldeídos podem reagir com o ar para dar os primeiros ácidos peroxo, e em última instância, ácidos carboxílicos. Estas reacções de autoxidação são activadas pela luz, catalisadas por sais de metais de transição, e são autocatalíticas (catalisadas pelos produtos da reacção). A adição de estabilizantes (antioxidantes) a remessas de aldeídos retarda a autoxidação. Incompatível com oxidantes (cloratos, nitratos, peróxidos, permanganatos, percloratos, cloro, bromo, flúor, etc.); o contato pode causar incêndios ou explosões. Manter afastado de materiais alcalinos, bases fortes, ácidos fortes, oxoácidos, epóxidos, cetonas, corantes azóicos, cáusticos, boranos, hidrazinas
Descarte de resíduos
Incineração. De acordo com 40CFR165, siga as recomendações para a eliminação de pesticidas e recipientes de pesticidas.