Entre a Neisséria humana e espécies relacionadas, três espécies – N. mucosa, M. catarrhalis e K. denitrificans reduzem o nitrato. O teste de redução de nitrato é um teste crítico para diferenciar entre N. gonorrhoeae e K. denitrificans, particularmente quando estirpes de K. denitrificans parecem ser diplococos gram-negativos em esfregaços corados.
Princípio
As espécies bacterianas podem ser diferenciadas com base na sua capacidade de reduzir nitrato a nitritos ou gases nitrogenados. Entre as Neisseriaceae de origem humana, cepas de Neisseria mucosa, Moraxella catarrhalis e Kingella denitrificans reduzem o nitrato. Estirpes de M. catarrhalis e K. denitrificans foram mal identificadas como N. gonorrhoeae. O teste de redução de nitrato permite a diferenciação entre estas espécies que são positivas em nitratos e N. gonorrhoeae (nitrato-negativo). A redução de nitrato pode ser acoplada à respiração anaeróbica em algumas espécies.
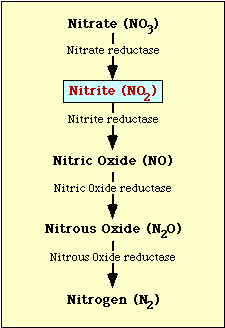
O caminho bioquímico envolvido na redução de nitrato é mostrado na Figura 1. O nitrato é reduzido a nitrito que pode então ser reduzido a óxido nítrico, óxido nitroso ou nitrogênio (Figura 1).
Figure l. Via de redução de nitrato.
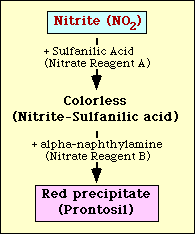
O teste de redução de nitrato é baseado na detecção de nitrito no meio após a incubação com um organismo. Se presente no meio, os nitritos reagirão com ácido sulfanílico (reagente de nitrato A) para formar um complexo incolor (ácido nitrito-sulfanílico). Este complexo produzirá então um precipitado vermelho (pronto) quando o reagente de nitrato B (alfa-naftilamina) é então adicionado ao teste como mostrado na Figura 2.
Figure 2. Representação esquemática da detecção de nitrito no meio.
Uma cor vermelha só será produzida no meio quando o nitrito estiver presente no meio. A ausência de cor vermelha no meio após a adição de ácido sulfanílico e alfa-naftilamina significa apenas que o nitrito não está presente no meio. Pode haver duas explicações para esta observação.
- O nitrato pode não ter sido reduzido; a estirpe é nitrato-negativa.
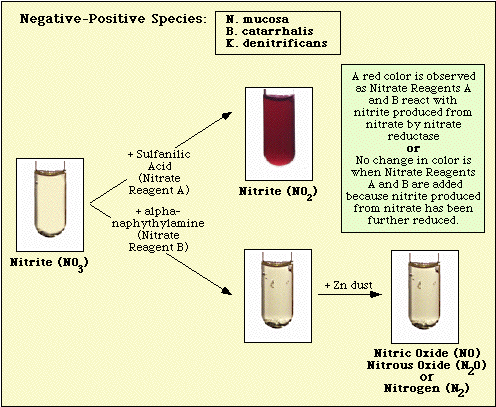
O nitrato pode ter sido reduzido a nitrito que foi então completamente reduzido a óxido nítrico, óxido nitroso, ou nitrogênio que não reagirá com os reagentes que reagem com nitrito; a estirpe é nitrato-positiva.
Um meio de teste que dê um resultado negativo após a adição dos reagentes de nitrato deve ser testado para determinar qual das duas interpretações é precisa.
Um teste de redução de nitrato bem sucedido depende da realização do teste nas condições corretas.
- A reação ocorrerá melhor se o meio base suportar o crescimento do organismo. Entretanto, embora algumas espécies de Neisseria não cresçam bem em meio de caldo, o teste de redução de nitrato pode ser realizado com sucesso em um meio que não suporte o crescimento através da inoculação pesada do meio para fornecer enzima pré-formada suficiente para a reação ocorrer.
Reação de nitrato ocorre somente sob condições anaeróbicas. O meio contendo nitrato é dispensado em tubos para dar uma baixa relação área superficial:profundidade, o que limita a difusão de oxigênio no meio, por exemplo, 5 ml de meio são dispensados em um tubo de 13 mm de diâmetro. Neisseria e espécies relacionadas usam o oxigênio no meio e rapidamente produzem condições anaeróbicas ideais para a redução do nitrato.
O teste de redução de nitrato é realizado em um meio contendo 0,2% de nitrato de potássio. O meio é fortemente inoculado com uma cultura pura do organismo suspeito e incubado a 35C a 36,5C durante 48 h. numa incubadora com ou sem suplemento de dióxido de carbono.
Nitrato de redução é detectado com os reagentes Griess Llosvay, ácido sulfanílico e alfa-naftilamina. O ácido sulfanílico (reagente de nitrato A) é adicionado à mistura de incubação e forma um complexo (ácido nitrito-sulfanílico) com qualquer nitrito presente no meio. Quando se adiciona alfa-naftilamina (reagente de nitrato B) ao meio incubado, forma-se um precipitado vermelho (prontoil) com qualquer complexo de ácido nitrito-sulfanílico presente no meio.
Um organismo pode ser reportado como nitrato-positivo se uma cor vermelha se desenvolver no meio após a adição dos reagentes nitrato A e B ao meio, indicando que o organismo reduziu nitrato a nitrito.
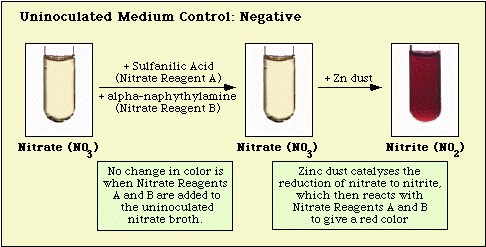
A ausência de uma cor vermelha após a adição de ambos os reagentes não significa automaticamente que o organismo é incapaz de reduzir o nitrato. As estirpes podem ter reduzido o nitrato a nitrito, e então reduzir completamente o nitrito a gases nitrogenados que não são detectados quando os reagentes de nitrato A e B são adicionados ao meio. Se o meio não mudar de cor após a adição de ácido sulfanílico e alfa-naftilamina, uma pequena quantidade (“ponta de faca”) de pó de zinco é adicionada ao meio incubado. O pó de zinco catalisará a redução de nitrato a nitrito quimicamente. Assim, se o nitrato não tiver sido reduzido pelos organismos, ou seja, se estes forem nitrato-negativos, será reduzido pelo pó de zinco e desenvolver-se-á uma cor vermelha no meio incubado dentro de 15 min. Se nenhuma cor se desenvolver no meio incubado após a adição de pó de zinco, os organismos não só reduziram nitrato a nitrito, mas também reduziram nitrito a gases nitrogenados; estes organismos também são nitrato-positivos.
Embora o meio nitrato seja fornecido com tubos Durham invertidos para detectar a produção de gás, a produção de gás não é registrada para as espécies Neisseria. Embora algumas espécies possam reduzir o nitrato além do nitrito a gases nitrogenados, o gás pode não se acumular no tubo. A acumulação de gás depende da taxa a que é produzido. Quando o gás é produzido muito lentamente, ele pode se dissolver no meio e não se acumular no tubo Durham.
Requisitos do espécime
Optimum espécime: Cultura pura de um diplococo oxidase-positivo diplococcus (Neisseria spp. ou M. catarrhalis) de gram negativo suspeito em ágar de chocolate incubado numa atmosfera enriquecida com dióxido de carbono a 35C a 36,5C durante 18 a 24 h.
Amostras inaceitáveis: Culturas de isolados em ágar de chocolate incubados numa atmosfera enriquecida com dióxido de carbono a 35C a 36,5C durante mais de 24 h.
Factores comprometedores que afectam os resultados dos testes:
- O meio de teste deve ser inoculado de forma suficientemente forte para permitir que a reacção ocorra com enzimas pré-formadas. Inóculos insuficientes podem não permitir que os organismos utilizem oxigénio para produzir condições anaeróbicas em que a redução de nitratos possa ocorrer.
Demasiado pó de zinco adicionado ao tubo incubado pode resultar numa redução muito rápida do nitrato para além dos nitritos para gases azotados, de modo a que os nitritos não sejam detectados.
Estabilidade da amostra: A detecção de redução de nitrato para Neisseria e espécies relacionadas depende da presença de enzimas pré-formadas.
- Testes só devem ser realizados com inóculo colhido a partir de culturas de 24 h.
Médio nitrato deve ser inoculado dentro de 30 min. da remoção da cultura da incubadora; a exposição prolongada da cultura à temperatura ambiente pode resultar em diminuição da atividade enzimática.
Meio/Reagentes
Medio: Caldo de nitrato (Caldo de infusão de coração contendo 0,2% de nitrato de potássio)
Caldo de infusão de coração (Difco), 25,0 g
Nitrato de potássio, 2,0 g
Água destilada, 1000,0 ml
- Dissolver os ingredientes em água destilada; ajustar a solução ao pH 7.0,
Disponha alíquotas de 5 ml do caldo em tubos de 16 mm x 100 mm com inserções de gás (tubos Durham, 6 mm x 50 mm). Autoclave durante 15 minutos a 121C.
C (refrigerado) até ser utilizado. Pré-aqueça o meio à temperatura ambiente antes da inoculação.
Reagentes: Solução de ácido sulfanílico (reagente de nitrato A): 0,8% em ácido acético 5N
Nome químico: Ácido 4-aminobenzeno sulfónico
Reagente de nitrato A a 15C a 30C (temperatura ambiente) por até 3 meses, no escuro. Os reagentes podem ser armazenados em recipientes de vidro marrom escuro; os frascos podem ser embalados em folha de alumínio para garantir a escuridão.
Solução de alfa-naftilamina (Reagente Nitrato B): 0,6% em ácido acético 5N
Nome químico: N,N-dimetil-1 naftilamina
Reagente de nitrato B a 2C a 8C (refrigerado) por até 3 meses, no escuro. Os reagentes podem ser armazenados em recipientes de vidro marrom escuro; os frascos podem ser envoltos em folha de alumínio para garantir a escuridão.
Pó de zinco, grau de Reagente: Armazenar à temperatura ambiente (15C a 30C)
Aviso: O ácido acético é corrosivo. O contacto com a pele pode causar bolhas e queimaduras. Em caso de contacto, lavar imediatamente os olhos e a pele com água em abundância (durante pelo menos 15 min.)
Controlo de qualidade/Procedimento de teste
Cepas QC:
- Nitrato de controle de redutase-positivo: Kingella denitrificans, CDC 10.236
>353535>Controle negativo de nitrato de redutase: Neisseria gonorrhoeae, ATCC 43069
Cepas de QC são armazenadas a -70C numa solução de caldo de soja triptico contendo 20% de glicerol. As reações das cepas de controle devem ser confirmadas no momento em que os estoques congelados são preparados. As cepas de QC podem ser armazenadas a -70C por até 2 anos.
Procedimento:
Cepas de QC são testadas da mesma forma que os isolados clínicos. As estirpes de QC devem ser subcultivadas pelo menos uma vez após a cultura inicial do espécime congelado antes da realização do teste. Os isolados clínicos podem ser subcultivados a partir do meio selectivo ou de subculturas purificadas. Certifique-se de que as culturas são puras.
- Descongelar os frascos de estirpes de controlo armazenados a -70C. Cortar em placas de ágar de chocolate ou ágar GC suplementar para isolamento. Incubar a 35C a 36,5C numa atmosfera enriquecida com dióxido de carbono durante 18 a 24 h.
-
Com um esfregaço esterilizado, preparar uma suspensão pesada de colónias bem isoladas a partir de uma cultura pura do isolado incubado em meio de chocolate a 35C a 36.5 C numa atmosfera enriquecida com dióxido de carbono durante 18 a 24 h. Inocular o meio de ensaio para dar turbidez pesada.
Nota: Estirpes de N. gonorrhoeae e algumas outras Neisseria spp. podem não crescer neste meio. Assim, a reação pode ser dependente da enzima pré-formada.
- Incubar meio inoculado e um tubo de controle de meio não inoculado a 35C a 36,5 C em uma atmosfera enriquecida com dióxido de carbono durante 48 h.
-
Se a suspensão estiver incolor após a adição dos reagentes A e B, adicione uma pequena quantidade (4 a 5 mg; “ponta de faca afiada”) de pó de zinco ao meio. Agite vigorosamente o tubo e deixe-o à temperatura ambiente durante 10-15 min.
Se o meio permanecer incolor após a adição de pó Zn, o resultado do teste é positivo.
Se o meio ficar rosado após a adição de pó Zn, o resultado é negativo.
Após 48 h. incubação adicionar, com pipetas Pasteur, 5 gotas do Reagente #A, seguidas de 5 gotas do Reagente #B a cada tubo. Agitar bem o tubo para misturar os reagentes com o meio.
Examinar a suspensão para uma cor vermelho-rosado que deverá desenvolver-se em poucos minutos se o meio ainda estiver quente. A reacção pode demorar um pouco mais se o meio estiver frio quando os reagentes são adicionados.
Se a suspensão ficar vermelho-rosado antes da adição de pó Zn, a reticulação é positiva e o teste está completo. Não execute o passo 4.
Reações observadas com o controle do meio não inoculado, e os isolados nitrato-negativo e nitrato positivo são ilustrados na Figura 3, Figura 4, e Figura 5, respectivamente.
Ler e registrar os resultados.
Figure 3. Reação Observada com meio nitrato não-inoculado.
Figure 4. Reacção Observada com Espécies Negativas de Nitratos.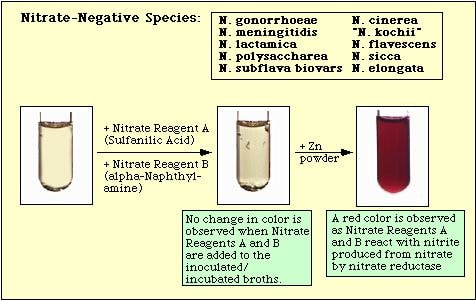
Figure 5. Reacções Observadas com Espécies Nitrato-Positivas.
Calendário de Controlo de Qualidade:
- É realizado diariamente um teste de QC de nitrato redutor.
Problemas & Soluções
O teste de redução de nitrato pode dar resultados falso-negativos ou falso-positivos se o meio não for produzido com precisão ou se o teste não for realizado com precisão. A reação neste teste depende de vários fatores.
- Falha para detectar a cor rosa no tubo de controle do meio não-inoculado após a adição de pó de Zn pode ser devido (1) ao meio que não contém nitrato ou (2) à adição de muito pó de zinco que catalisou a redução do nitrato além do nitrito para gases nitrogenados. A solução mais simples é obter mais meio de nitrato garantindo que o nitrato foi adicionado ao meio base. Alternativamente, inocule o meio com uma estirpe de controlo positivo, mas teste para uma reacção após um tempo de incubação mais curto; estirpes de N. mucosa produzirão uma reacção positiva de nitritos após algumas horas de incubação. Se for confirmado que o meio contém nitrato, repetir o teste até ter determinado a quantidade correcta de pó de zinco a adicionar. É fundamental saber qual a quantidade de pó de zinco a adicionar ao teste. A adição de demasiado pó de zinco pode resultar num resultado falso-positivo.
- Se for detectada uma cor rosa no controlo do meio não inoculado após a adição dos reagentes de nitrato A e B ao meio, o meio é contaminado com nitrito. A única solução é obter um novo lote de meio que não esteja contaminado com nitrito.
- A reacção de redução de nitrato indica a capacidade dos organismos de reduzir o nitrato, reacção que ocorre apenas em condições anaeróbias; a reacção não ocorrerá se os organismos receberem um fornecimento contínuo de oxigénio. Assim, a reação pode não ocorrer em culturas paradas (particularmente de espécies de crescimento lento) nas quais o meio é distribuído em camadas rasas que permitem que o oxigênio se difunda para o meio. Um teste para determinar se o oxigênio está presente no meio pode ser feito pela adição de uma gota de reagente de oxidase ao meio. Se o meio ficar púrpura, o meio contém oxigénio e a reacção de redução de nitratos pode não ocorrer. Se o meio permanecer incolor, o meio não contém oxigénio e pode ocorrer o teste de redução de nitratos. Foi observado que as células de N. gonorréia consomem o oxigênio rapidamente se células suficientes forem inoculadas no meio. Se o reagente oxidase for adicionado após aproximadamente 1 a 2 horas de incubação, o meio permanecerá incolor. Como o reagente da oxidase mata os gonococos presentes no meio, o meio ficará gradualmente roxo, começando no topo do tubo, à medida que o oxigénio se difunde para o meio. Se o meio for dispensado em tubos de dimensões diferentes das sugeridas acima, assegurar que a razão área-profundidade da superfície seja pelo menos igual ou menor do que as sugeridas acima. Se o diâmetro do tubo em que o meio é dispensado for maior do que o descrito acima, usar um volume maior de meio para manter a mesma razão área-profundidade superficial.
-
A reação de redução de nitrato pode não ocorrer se o meio em que o teste é realizado não permitir o crescimento normal do organismo. Entretanto, o teste pode ser realizado em um meio que não suporte o crescimento dos organismos se o inóculo for suficientemente denso para que as enzimas pré-formadas possam esgotar o suprimento de oxigênio existente e reduzir o nitrato a uma velocidade maior do que aquela em que o oxigênio se difunde no meio.
Nota: Para verificar se o oxigênio foi removido do meio, adicionar 2 a 3 gotas de reagente de oxidase a um duplicado do meio inoculado. Se o oxigênio tiver sido adequadamente removido do meio, o reagente de oxidase não ficará roxo imediatamente. Se o meio contiver oxigénio dissolvido, o reagente de oxidase ficará púrpura. Note também que o teste de redução de nitrato pode ser realizado no meio ao qual o reagente de oxidase foi adicionado.
- Quando o Reagente A é adicionado ao meio de ensaio, o nitrito produzido como resultado da redução do nitrato formará um complexo com o ácido sulfanílico que produz um precipitado vermelho com a alfa-naftilamina no Reagente B. A presença de uma cor vermelha no meio de ensaio indica que o nitrito está presente como resultado da redução do nitrato. Contudo, a ausência de uma cor vermelha após a adição dos Reagentes A e B não significa necessariamente que o nitrato não tenha sido reduzido. O não desenvolvimento de uma cor vermelha pode significar (1) que o nitrato não foi reduzido, ou (2) que o nitrito, produzido como resultado da redução do nitrato, foi ele próprio reduzido a gases nitrogenados. Para determinar se o nitrito foi reduzido, coloque uma pequena quantidade de pó de zinco na mistura de incubação se este estiver incolor após a adição dos Reagentes A e B. O pó de zinco catalisa a redução do nitrato para nitrito; deve desenvolver-se uma cor vermelha no meio que ainda contém nitrato não reduzido. É importante, contudo, não adicionar demasiado pó de zinco; o excesso de pó de zinco catalisará a redução de nitrito produzido a partir desse nitrato, resultando num meio incolor e a interpretação incorrecta do teste como positivo (um resultado falso-positivo).
- Um teste de redução de nitrato positivo é obtido com a estirpe de controlo negativo, N. gonorreiae, após a adição do pó de zinco indica que o nitrato foi reduzido para além do nitrito, provavelmente devido à adição de demasiado pó de zinco ao teste. Repita o teste, certificando-se de que adiciona muito pouco pó de zinco. A cor rosa, indicando que o organismo não reduziu o nitrato, pode demorar 10 a 15 minutos a desenvolver-se. Não adicione mais pó de zinco! Aguarde que a cor se desenvolva. Se nenhuma cor se desenvolveu em 30 min., interprete o teste como positivo.
Em meio contendo nitrato, a falha da estirpe do controle positivo, Kingella denitrificans, em dar uma reação positiva só ocorreria se a estirpe não fosse K. denitrificans. Verifique novamente a identidade da estirpe do controle positivo. Seleccione uma nova cultura da estirpe de controlo e repita o teste. Da mesma forma, se um teste de nitrato redutase positivo for obtido com a estirpe do controlo negativo, N. gonorreiae, ou a estirpe do controlo negativo não é N. gonorreiae ou a cultura está contaminada com um organismo nitrato-positivo. Verificar novamente a pureza e identidade da estirpe de referência gonocócica. Repetir o teste com uma cultura pura de uma cultura confirmada de N. gonorreiae.
Limitações do teste
Se o teste for realizado correctamente e as estirpes de controlo de qualidade derem resultados apropriados, não deve haver limitações a este teste. Deve-se tomar cuidado para garantir que todos os componentes do teste sejam executados adequadamente .
Nenhuma identificação de gênero ou espécie pode ser feita somente com base no teste de redução de nitrato.
Resultados, Interpretação e Relatório
Isolados podem ser relatados como Nitrato positivo se o nitrito (cor rosa) for detectado no meio inoculado após a adição dos reagentes A e B ou se nenhuma cor for detectada no meio após a adição de pó de zinco.
Isolados podem ser reportados como Nitrato negativo se não for detectado nitrito (sem alteração de cor) após a adição dos reagentes A e B, ou se uma cor rosa se desenvolver após a adição de pó de zinco ao meio inoculado.
Bibliografia
Knapp JS, Clark VL. Crescimento anaeróbico de Neisseria gonorrhoeae acoplado à redução de nitritos. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Um guia para a identificação dos gêneros de bactérias. The Williams & Wilkins Co., Baltimore, MD.