trans-Cinnamaldehyde 化学的性質、用途、生産
概要
シナモンの木やシナノキ属の他の種から得られる古くからある香料で、糖尿病やその合併症を予防する能力があると注目され、現在では、シナムアルデヒトは、糖尿病を予防することができるとされています。 シンナムアルデヒドは黄色い粘性のある液体で、シナモンの樹皮の精油の98%を占め、DumasとPéligotによって初めて単離され、1854年にイタリアの化学者Luigi Chiozza (1828-1889) によって実験室で合成された。 2007年、Subashらは、ストレプトゾトシン(STZ)誘発の雄性糖尿病Wistarラットに対するcinnamaldehydeの血糖降下および脂質低下作用を初めて報告した。
Cassia または Chinese cinnamon は、シナモンノキの内皮から抽出されたスパイスとして広く使用されています。 カシアは何千年もの間、薬用として使用されており、伝統的な中国医学における50の基本的な薬草の1つと見なされています。 カシアの根、樹皮、葉、花など、いくつかの部位が薬用に利用されています。 シナモンエキスは、抗アレルギー作用、抗菌作用、抗ウイルス作用、抗酸化作用、胃腸保護作用、抗血管新生作用、抗アルツハイマー作用、インスリン様生物活性など、様々な有益な作用を持つことが報告されている . シナモンの抽出物には、精油(シンナムアルデヒドとシンナミルアルデヒド)、タンニン、粘液、炭水化物など、いくつかの活性化合物が含まれています。 興味深いことに、桂皮アルデヒドとして知られるシンナムアルデヒドは、脂質の蓄積を抑え、ペルオキシソーム増殖剤活性化受容体-γ、CCAAT/エンハンサー結合タンパク質α、ステロール調節要素結合タンパク質1をダウンレギュレートすることにより抗肥満効果を示す。 さらにシンナムアルデヒドは、低密度リポタンパク質受容体関連タンパク質-1を標的としてリポ多糖誘導性のマイクログリア活性を阻害する。 また、シンナムアルデヒドが癌細胞において抗変異原性作用を有することも報告されている。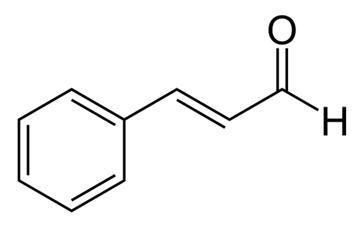
図1 シンナムアルデヒドの化学構造、
薬物動態
シンナムアルデヒドは天然にはトランス-シンナムアルデヒドの形で存在している。 Zhaoらは、経口投与(500 mg/kg)および静脈内注射(20 mg/kg)により、ガスクロマトグラフ質量分析(GC-MS)の相対的な感度を用いた方法で、ラットのシンナムアルデヒドの薬物動態を評価する実験を実施しました。 その結果、シンナムアルデヒドのAUC0-tは経口投与で1984 ± 531 ng h/ml、静脈内投与で355 ± 53 ng h/mlであった。 また、シンナムアルデヒドのT1/2及びTmaxは、経口投与では6.7 ± 1.5 h及び1.6 ± 0.5 h、静脈内投与では1.7 ± 0.3 h及び0.033 hと長く、静脈内投与では、1.5 ± 1.5 h及び0.033 hとなった。 また,Cmaxは経口投与で249±36 ng/ml,静脈内投与で547±142 ng/mlであり,経口投与と静脈内投与を比較すると,経口投与の方がCmaxが高く,静脈内投与の方がCmaxが低いことが確認された。 さらに、CmaxとAUC0-tは投与量(125~500mg)に比例するが、Tmaxと平均滞留時間は投与量の増加に対して変化しないことを実証した。 また、ラットでは、シンナムアルデヒドとシンナミルアルコールが互いに変化する可能性があることから、ラットの血漿中におけるシンナミルアルコールの薬物動態についても解析している。 500 mg/kgの経口投与で、AUC0-tが1105±337 ng・h/ml、T1/2が6.7±2.8 h、Tmaxが1.5±0.7 h、Cmaxが221±66 ng/mlと、シンナミルアルコールの薬物動態データは良好であることが確認された。 また、興味深いことに、代謝物中に桂皮酸メチルも発見された。 桂皮酸メチルの薬物動態学的特性については、Zhaoらの論文を参照されたい。 つまり、シンナムアルデヒドは、吸収された後、全身によく分布しています。 桂皮アルデヒドは、体内に入ると桂皮アルコールに変化し、また桂皮酸に酸化される可能性があります。 シンナムアルデヒドの薬物動態特性を十分に理解するためには、桂皮酸メチルおよびシンナミルアルコールも血漿中に測定する必要があります。 しかし、シンナムアルデヒドは不安定であるため、シンナムアルデヒドの生理活性がその代謝物の合計によるものである可能性が高いことが疑問視されています。 したがって、この潜在的な懸念を払拭するために、さらなる試みが期待されます。 また、今回開発されたバイオアベイラビリティを向上させたSME-cinnamaldehydeについても、抗糖尿病作用についてさらなる検討が必要である。
応用例
シナモン抽出物は、抗アレルギー、抗菌、抗ウイルス、抗酸化、胃腸保護、抗血管新生、抗アルツハイマー作用、インスリン様生物活性など、様々な有益な作用を有しています。 シンナムアルデヒドは、脂質の蓄積を抑え、peroxisome proliferator-activated receptor-γ, CCAAT/enhancer-binding protein α, sterol regulatory element-binding protein 1のダウンレギュレーションにより抗肥満作用を示す。 さらに、シンナムアルデヒドは、low density lipoprotein receptor-related protein-1をターゲットとしてリポポリサッカライドによるミクログリア活性を阻害する。 また、cinnamaldehydeが癌細胞において抗変異原性作用を有することが報告されている。 シンナムアルデヒドのがんや糖尿病の治療に対する効果を以下に紹介します。
抗がんKwonらは、シナモン抽出物がNF-κBおよびAP-1の阻害を介してin vitroおよびin vivoでのメラノーマ細胞死を誘発することを初めて報告しました。 その後の研究で、HCAが桂皮抽出物に含まれる主要な抗腫瘍性化合物であり、in vitroで29種類のヒトがん細胞、in vivoでSW620ヒト腫瘍異種移植片に増殖抑制効果を発揮することがわかりました
他の研究チームも桂皮抽出物の抗腫瘍性作用を報告しています。 それらは、血管新生促進因子の発現を誘導することにより、メラノーマがん細胞を抑制します。また、CD8 T細胞の細胞溶解活性を高めることにより、抗腫瘍原性活性を向上させました。 また、シナモン抽出物は血管内皮増殖因子を阻害するが、これはVEGFR2に対する阻害活性を持つ化合物をスクリーニングすることにより発見された。 シナモン抽出物の抗腫瘍効果のほとんどは、精油の主成分で、シナモン全体の味と香りの原因であるシンナマルデヒドに起因すると考えられます。 いくつかの種類の腫瘍において、シンナムアルデヒドがサイクリンD1を阻害することにより、がん細胞の増殖を抑制することが報告されています。 また、シンナムアルデヒドは、HL-60白血病細胞において活性酸素を発生させ、ヒト肝細胞においてはプロアポトーシスBcl-2ファミリータンパク質およびMAPKシグナル伝達経路の活性化を通してアポトーシスを誘導する。 さらに、HCA由来の二量体シンナムアルデヒドは、アポトーシスおよび細胞周期停止を誘導することにより、単量体シンナムアルデヒドよりも高い抗腫瘍効果を示しました。 さらに、多くの研究により、HCAとその誘導体の抗腫瘍原性作用は、いくつかの分子メカニズムを介していることが明らかにされています。 最近の研究では、シンナムアルデヒドを足場とするポリフェノールが、シスプラチン抵抗性のヒト卵巣がん細胞においてG2/M期での細胞周期停止とアポトーシス細胞死を引き起こすことが示され、シンナムアルデヒド化合物ががん患者に対する併用化学療法に有効であることが示唆されています。 全体として、シンナムアルデヒドの抗がん作用および抗転移作用の基盤となる分子メカニズムは多様であり、シンナムアルデヒドがマルチターゲット化合物であることが示唆された。
糖尿病対策
糖尿病とその合併症の管理における有益な役割を評価するために、過去数十年にわたって新たな研究が行われています。 シンナムアルデヒドを1日あたり20mg/kg-体重から40mg/kg-体重の範囲で21日から60日間経口投与すると、STZ誘発糖尿病ラットの血糖値やグリコシル化ヘモグロビンのレベル、およびインスリン感受性に著しい改善をもたらすことが証明されています。 そして、20mg/kg-BWが動物の糖尿病の発症を予防するための有効量であると推測される。 さらに、シンナムアルデヒドを4週間投与すると、STZおよび/またはHFD侮辱雄Wistarラットの血漿インスリンレベルおよび肝臓グリコーゲン量が増加し、トリグリセリドおよび低密度リポタンパク質-コレステロールレベルが低下する。 さらに、Camachoらは、HFDを摂取したC57BL/6Jマウスにシンナムアルデヒドを5週間投与すると、体脂肪量の増加が有意に抑制されることを見出した。 しかし、彼らは、シンナムアルデヒドの投与は、血漿空腹時インスリンレベルおよび飼料消費量を変化させなかったと主張している。 インスリン調節に関する矛盾の原因は、C57BL/6Jマウスの遺伝的背景がいくつかの生産施設で変更されていることに起因している可能性がある。 マウスの異なる亜系統は、表現型に大きな違いを示す可能性がある。 また、Camachoの研究では、シンナムアルデヒドは末梢のインスリン感受性を改善することにより、グルコース低下作用を示す可能性がある。
シンナムアルデヒドは、内臓脂肪の沈着を抑制し、脂肪分解や脂肪酸の酸化・熱発生を促進し、エネルギー消費遺伝子のアップレギュレーションを伴う糖尿病性脂肪組織の改善能を有している。 PPARγ/CEBP-αおよびSREBP1の抑制、HSLおよびPNPLA2およびMGLの上昇、AMPKリン酸化の誘導、WATのCpt1aおよびBATのAcsl4の上昇、さらに交感神経系の刺激。 さらに、cinnamaldehyde は、糖尿病動物における炎症性遺伝子の発現を抑制し、GLUTs の発現を改善する。 シンナムアルデヒドは、骨格筋組織におけるPI3K/IRS-1およびRBP4-GLUT4経路の調節を介してインスリン感受性とグルコース取り込みを改善し、またC2C12細胞におけるPGC-1α/MEF2/GLUT4経路を介してミトコンドリア代謝を調節することにより糖尿病を予防すると考えられています。 また、Cinnamaldehydeは、PKおよびPEPCKの活性を調節し、RBP4レベルを低下させることによりグリコーゲン合成を改善し、異常な肝酵素を正常化することにより、糖尿病肝臓にプラスの効果をもたらし、この化合物が糖尿病肝臓の糖代謝およびインスリン感受性に有益な役割を果たすことが示唆された。
抗菌作用
大腸菌O157:H7やサルモネラ菌に対するcinnamaldehyde、クローブ、タイム、ローズマリーの抗菌活性が研究により確認されています。 WendakoonとSakaguchiは、シンナムアルデヒドのカルボニル基がタンパク質に結合し、Enterobacter aerogenesのアミノ酸脱炭酸酵素活性を阻害することを報告した。 Smid らは、シンナムアルデヒドで処理すると Saccharomyces cerevisiae の細胞質膜が損傷し、代謝物や酵素が細胞から過剰に漏出し、最終的に生残性が失われることを観察している。 多くの研究は、エッセンシャルオイルの作用様式は、微生物の種類、主にその細胞壁の構造と外膜の配置に依存することを示唆している。 彼らは、グラム陰性菌とグラム陽性菌の外膜の大きな違いによる損傷を観察した。
毒性
現在でも、シンナムアルデヒドは安全な天然成分剤であり、ヒトや動物への忍容性が高いとされている。 急性毒性
シンナムアルデヒドは安全性が高く、有効量の20倍(20mg/kg)を投与しても、異常行動や血清化学値の異常は認められなかったと報告されています。 シンナムアルデヒドの急性毒性は低く、経口致死量中央値(LD50)は、異なる種で0.6g/kg BWから3.4g/kg BWと高い。
長期毒性
3ヶ月試験の結果、16500または33000 ppmに暴露した雌ラットと8200 ppm以上に暴露した雌マウスで体重が減少することが示されています。 また、ラットの全暴露群およびマウスの最高用量群では飼料消費量が減少しています。 さらに、シンナムアルデヒドへの暴露は、森林胃の扁平上皮過形成の発生率を増加させる。 さらに、シンナムアルデヒドに暴露されたマウスは、鼻腔の嗅上皮変性の発生率も増加させることが示された。
その他
シンナムアルデヒドは、F344ラット肝細胞においてグルタチオンレベルの減少により、またHepG2細胞において小核数の増加により、細胞毒性作用を示すことがある。 Beharらは、この製品の潜在的な毒性を、ヒト胚細胞および肺細胞で研究しました。 その結果、シンナムアルデヒド処理は、ヒト肺線維芽細胞において微小管を脱重合することが実証された。 また、シンナムアルデヒドは、細胞の増殖と分化を阻害し、細胞の形態と運動性を変化させるとともに、DNA鎖切断と細胞死を増加させることにより、細胞の増殖と分化を減少させます。 Olsenらによって行われた研究では、シンナムアルデヒドは、ヒトの皮膚温度と灌流を増加させると同時に、冷痛閾値を増加させ、機械的痛閾値を減少させることによって皮膚刺激を引き起こすことが明らかにされています。
- Zhou M, Chen Z, Shen S. Recent advanceson cinnamaldehyde. Journal of Economic Animal 2015;19:1-5.
- Khare P, Jagtap S, Jain Y, Baboota RK, Mangal P, Boparai RK, Bhutani KK, Sharma SS, Premkumar LS, Kondepudi KK, Chopra K, Bishnoi M. Cinnamaldehyde supplementation prevents fasting-induced hyperphagia, lipid accumulation and inflammation in high fat diet fed mice.錫安アルデヒドの補給は、空腹による摂餌過多と脂質蓄積、炎症を防ぐ。 BioFactors 2016;42:201-211.
- Ma R, Zhu R, Wang L, Guo Y, Liu C, Liu H, Liu F, Li H, Li Y, Fu M, Zhang D. Diabetic osteoporosis.糖尿病の骨粗鬆症。 を、その伝統的な漢方薬の使用と臨床および前臨床研究のレビュー。 Evidence-based complementary and alternative medicine : eCAM 2016;2016:3218313.
- Dumas JP, E. Organic Chemistry research – on cinnamon oil, the hippuric acid and sebacic acid.有機化学の研究。 Annales de chimie et de physique 1834;57:305-334.
- Chiozza L. Sur la production artificielle de l´essence de cannelle」. また、”Subash Babu P, Prabuseenivasan S, Ignacimuthu S. Cinnamaldehyde–a potential antidiabetic agent.
- Hagenlocher Y, Bergheim I, Zacheja S, Schaffer M, Bischoff SC, Lorentz A. 2013.に掲載されました。 シナモンエキスは、マスト細胞における炎症性メディエーターの脱顆粒およびデノボ合成を抑制する。 アレルギー 68: 490-497.
- Matan N, Rimkeeree H, Mawson AJ, Chompreeda P, Haruthaithanasan V, Parker M. 2006.シナモンは、マスト細胞の脱顆粒と炎症性メディエーターのデノボ合成を抑制する。 大気圧条件下におけるシナモンオイルおよびクローブオイルの抗菌活性。 Int J Food Microbiol 107: 180-185.
- Fink RC, Roschek B Jr, Alberte RS. 2009. 新しい作用機序を持つHIV1型侵入阻害剤。 Antivir Chem Chemother 19: 243-255.
- Yang CH, Li RX, Chuang LY. 2012. を用いたCinnamomum cassiaの各種部位の抽出法による抗酸化活性の検討。 Molecules 17: 7294-7304.
- Peterson DW et al.2009年. シナモンエキスは、in vitroでアルツハイマー病に関連するタウ凝集を抑制する。 J Alzheimers Dis 17: 585-597.
- Cheng DM, Kuhn P, Poulev A, Rojo LE, Lila MA, Raskin I. 2012.シナモンは、アルツハイマー病に関連するタウの凝集を抑制する。 シナモン水性抽出物およびシナモンポリフェノール強化食品マトリックスのin vivoおよびin vitroの抗糖尿病効果。 Food Chem 135: 2994-3002.
- Kim JE et al. 2015a.。 Pim-1阻害活性を有する新規のシナモン関連天然物は、白血病および皮膚がんを抑制する。 Cancer Res 75: 2716-2728.
- Hwang H et al.2011.。 2′-ヒドロキシシンナムアルデヒドは、低密度リポタンパク質受容体関連タンパク質-1を標的として、リポポリサッカライドによるミクログリアの活性化を抑制する。 J Neuroimmunol2011 230: 52-56.
- Shaughnessy DT, Setzer RW, DeMarini DM. 2001. Salmonella TA104の自然変異に対するバニリンとシンナムアルデヒドの抗変異原性効果は、GC部位ではなくAT部位での変異の減少に起因する。 Mutat Res 480: 55-69.
- Zhang LQ, Zhang ZG, Fu Y, Xu Y. を用いた薬理作用の研究進展. Zhongguo Zhong yao za zhi = China journal of Chinese materia medica 2015;40:4568-4572.
- Zhao H, Xie Y, Yang Q, Cao Y, Tu H, Cao W, Wang S. Pharmacokinetic study of cinnamaldehyde in rat by gc-ms after oral and intravenous administration.Zhao LQ, Zhang ZG, Fu Y, Xu Y. Pharmacokinetic study in rats. Journal of pharmaceutical and biomedical analysis 2014;89:150-157.
- Kwon BM et al.1998年。 シンナマルデヒドの合成とヒト固形腫瘍細胞に対するin vitro細胞毒性. Arch Pharm Res 21: 147-152.
- Lee CWら. 1999年. 2′-hydroxyand 2′-benzoyloxycinnamaldehydes によるヒト腫瘍増殖の抑制。 Planta Med 65: 263-266
- Kwon HKら, 2009年. シナモンエキスは、血管新生およびCD8+ T細胞のエフェクター機能を調節することにより、腫瘍の進行を抑制する。 Cancer Lett 278: 174-182.
- Lu J, Zhang K, Nam S, Anderson RA, Jove R,WenW. 2010. 桂皮抽出物の新規血管新生阻害活性は、VEGFR2キナーゼと下流のシグナル伝達をブロックする。 Carcinogenesis 31: 481-488.
- Jeong HW et al.2000.桂皮抽出物の新規血管新生阻害活性は、VEGFR2キナーゼと下流シグナルをブロックする。 シナールアルデヒドは、サイクリン依存性キナーゼ4/サイクリンD1を阻害する。 Bioorg Med Chem Lett 10: 1819-1822.
- Ka Hら、2003. Cinnamaldehyde は、ヒト前骨髄球性白血病 HL-60 細胞において、活性酸素を介したミトコンドリア透過性遷移によりアポトーシスを誘導する。 Cancer Lett 196: 143-152.
- Wu SJ, Ng LT, Lin CC. 2005. Cinnamaldehyde-induced apoptosis in human PLC/PRF/5 cells through activation of the proapoptotic Bcl-2 family proteins and MAPK pathway. Life Sci 77: 938-951.
- Shin DS et al.2006年. 強力な抗腫瘍剤としての二量体シンナマルデヒドの合成と生物学的評価. Bioorg Med Chem 14: 2498-2506.
- Shin SYら, 2014. シスプラチン耐性A2780/Cis卵巣癌細胞に対して細胞増殖抑制効果を示すシンナムアルデヒドを足場とするポリフェノール類. Bioorg Med Chem 22: 1809-1820.
- Lee SC, Xu WX, Lin LY, Yang JJ, Liu CT. 土着桂皮の葉精油の化学組成と血糖降下作用および膵臓保護作用. Journal of agricultural and food chemistry 2013;61:4905-4913.
- El-Bassossy HM, Fahmy A, Badawy D. Cinnamaldehyde protects from the hypertension associated with diabetes.(シナムアルデヒドは糖尿病に関連する高血圧から保護する)。
- Li M, Xu Y, Zhang W. Effects of cinnamaldehyde on the expression levels of irs-1 and p85 alpha in gastrocnemius of type 2 diabetic rats.「2型糖尿病ラットの腓腹筋におけるイルス-1とp85アルファの発現レベルに対するケイ皮の効果」。 また、武漢大学の医学雑誌 2009;30:723-726=731.
- Kumar S, Vasudeva N, Sharma S. Gc-ms analysis and screening of antidiabetic, antioxidant and hypolipidemic potential of cinnamomum tamala oil in streptozotocin induced diabetes mellitus in rats.(篠崎武蔵大学医学部篠崎武蔵研究室). Cardiovascular diabetology 2012;11:95.
- Camacho S, Michlig S, de Senarclens-Bezencon C, Meylan J, Meystre J, Pezzoli M, Markram H, le Coutre J. 抗肥満および抗高血糖作用はグレリン分泌の変化と食物摂取および胃排出に対する機能的影響を介してcinnnamaldehydeが作用する。 Scientific reports 2015;5:7919.
- Navarro SJ, Trinh T, Lucas CA, Ross AJ, Waymire KG, Macgregor GR.を参照のこと。 c57bl/6jマウス系統のバックグラウンドはbcl2l2の変異の効果を修飾する。 また、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」を行うこととしたものである。 また、「マウスはすべて同じではない」。 また、このような研究成果を踏まえて、「高脂肪食を摂取したC57bl/6nnおよびC57bl/6njマウスのインスリン分泌の違い」を明らかにした。 代謝研究における混合遺伝的背景の意味合い。 PloS one 2016;11:e0159165.
- Nicholas P G, Schnuckc. JK、Mermierd. CM、Conne. CA, Vaughanc. RA. トランスシンナムアルデヒドは、pgc-1αおよびpparβ/δを介してミトコンドリア生合成を刺激し、glut4の発現を増強させる。 Biochimie 2015;119:45-51.
- Zhang W, Xu YC, Guo FJ, Meng Y, Li ML. 2型糖尿病ラットにおけるシンナムアルデヒドとベルベリンの抗糖尿病効果およびレチノール結合タンパク質4発現への影響。 Chin Med J 2008;121:2124-2128.
- Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. インスリン抵抗性ヒト骨格筋におけるp85/55/50発現の増加とphosphotidylinositol 3-kinase活性の減少。 Diabetes 2005;54:2351-2359.
- Saraswathi V, Ramnanan CJ, Wilks AW, Desouza CV, Eller AA, Murali G, Ramalingam R, Milne GL, Coate KC, Edgerton DS.Diabetes 2005;54:2351-2359.
- Milne GL, Coate KC, Erner DS. 造血性シクロオキシゲナーゼ-1欠損が肥満と関連した脂肪組織の炎症と代謝障害に与える影響(マウス)。 Metabolism: clinical and experimental 2013;62:1673-1685.
- Ohaeri OC. ストレプトゾトシン糖尿病ラットの血清および組織中の各種酵素レベルに対するニンニク油の効果。 Bioscience reports 2001;21:19-24.
- Mahfouz MH, Assiri AM, Mukhtar MH.(マーフーズ エムエイチ、アシリ アム、ムフタール エムエイチ)。 腎症を有する2型糖尿病患者における好中球ゼラチナーゼ関連リポカリン(ngal)およびレチノール結合蛋白4の評価。 Biomarker insights 2016;11:31-40.
- SHAN, B., CAY, Y.-Z., BROOKS, J.D. and CORKE, H. 2007.を参照。 シナモンスティックの抗菌特性と主な生理活性成分. 食品由来の病原性細菌に対する活性。 J. Agric. Food Chem. 55, 5484-5490
- RHAYOUR, K., BOUCHIKHI, T., TANTAOUI-ELARAKI, A., SENDIDE, K.とREMMAL, A. 2003. を用いた、大腸菌および枯草菌に対するオレガノおよびクローブ精油のフェノール主成分の殺菌作用の機構について。 J. Essent. 15, 356-362.
- KIM, H.-O., PARK, S.-W. and PARK, H.-D. 2004. Cinnamomum cassia shoot から精製した桂皮アルデヒドによる Escherichia coli O157:H7 の不活性化. Food Microbiol. 21, 105-110
- WENDAKOON, C. and SAKAGUCHI, M.1995(1995年). 香辛料中の有効成分によるEnterobacter aerogenesのアミノ酸脱炭酸酵素活性の阻害. J. Food Prot. 58, 280-283.
- SMID, E.J., KOEKEN, J.P.G. and GORRIS, L.G.M. 1996.香辛料中の有効成分によるアミノ酸脱炭酸酵素活性の阻害. 植物二次代謝産物シンナムアルデヒドとカルボンの殺菌・防カビ作用. 現代の殺菌剤と抗菌性化合物 pp. 173-180, Intercept, Andover, U.K.
- Dugoua JJ, Seely D, Perri D, Cooley K, Forelli T, Mills E, Koren G. From type 2 diabetes to antioxidant activity: コモンシナモンとカシアシナモン樹皮の安全性と有効性に関するシステマティックレビュー。 また、”Canadian journal of physiology and pharmacology 2007;85:837-847.
- Anand P, Murali KY, Tandon V, Murthy PS, Chandra R. Insulinotropic effect of cinnamaldehyde on transcriptional regulation of pyruvate kinase, phosphoenolpyruvate carboxykinase, and glut4 translocation in experimental diabetic rats.The Instructor of cinnamaldehyde effect of insulinotropic effects on transcriptional regulation of pyruvate kinase, phosphoenolpyruvate carboxykinase, and glut4 translated in experimental dioxetic rats. また、”Chemico-biological interactions” 2010;186:72-81.
- Gowder SJT. 食品香料-シンナムアルデヒドの安全性評価. バイオセーフティ 2014;3
- Hooth MJ, Sills RC, Burka LT, Haseman JK, Witt KL, Orzech DP, Fuciarelli AF, Graves SW, Johnson JD, Bucher JR.日本バイオセーフティ学会誌(日本バイオセーフティ学会)。 マイクロカプセル化された trans-cinnamaldehyde のラットおよびマウスにおける毒性および発がん性試験。
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes.Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 2004;42:1757-1768.
- Swales NJ, Caldwell J. Studies on trans-cinnamaldehyde ii: Mechanisms of cytotoxicity in rat isolated hepatocytes.
- Sanyal R, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Inhibition of the genotoxic effects of heterocyclic amines in human derived hepatoma cells by dietary bioantimutagens.ヒト肝細胞における複素環アミンの遺伝毒性作用の食餌性生体内変異原による抑制.Toxicology in vitro : an international journal published in association with BIBRA 1996; 10:37-42.Sanyal R, F, Darroudi F, Parzefall W, Nagao M, Knasmuller S. Mutagenesis 1997;12:297-303.
- Behar RZ, Luo W, Lin SC, Wang Y, Valle J, Pankow JF, Talbot P. Distribution, quantification and toxicity of cinnamaldehyde in electronic cigarette refill fluids and aerosols.電子タバコの補充液とエアゾールにおけるシンナムアルデヒドの分布、定量、毒性。 Tobacco control 2016
- Olsen RV, Andersen HH, Moller HG, Eskelund PW, Arendt-Nielsen L. Somatosensory and vasomotor manifestations of individual and combined stimulation of trpm8 and trpa1 using topical l-menthol and trans-cinnamaldehyde in healthy volunteers.健常ボランティアにおけるl-mentholとtrans-cinnamaldehydeを用いたtrpm8とtrpa1の個別および複合刺激の体感および血管運動の発現。 European journal of pain 2014;18:1333-1342.
Chemical Properties
trans-Cinnamaldehydeはカシア油(約90%)およびスリランカ桂皮油(約75%)の主成分である。 他の多くの精油には少量含まれる。 自然界では、trans-異性体が優勢です。
trans-Cinnamaldehydeは黄色っぽい液体で、シナモンを強く連想させる特徴的なスパイシーなにおいがあります。 不飽和アルデヒドであるため、多くの反応を起こし、その中でも桂皮アルコール、ジヒドロシンナムアルデヒド、ジヒドロシンナミックアルコールへの水素添加は重要である。 桂皮酸は自動酸化により生成する。
工業的には、桂皮アルデヒドは、ほとんどベンズアルデヒドとアセトアルデヒドのアルカリ縮合により調製される。 アセトアルデヒドの自己縮合は、過剰なベンズアルデヒドを使用し、アセトアルデヒドをゆっくりと添加することで回避することができます。 人工シナモンオイルの主成分です。 また、桂皮アルコールおよびジヒドロ桂皮アルコールの合成における重要な中間体です。
化学的性質
透明な黄色の液体
可燃性で黄色がかった油性の液体(空気に触れると増粘する)。 強い刺激性、スパイシー、シナモン臭。
定義
ChEBI。 シンナムアルデヒドのE(トランス)立体異性体で、シンナムアルデヒドのクラスの親である。
合成参考文献
Chemistry Letters, 12, p. 1207, 1983
Journal of the American Chemical Society, 93, p. 2080, 1971 DOI: 10.1021/ja00737a057
Tetrahedron Letters, 18, p. 1215, 1977
概要
透明黄色液体、シナモン臭と甘味があり、柑橘類のようなにおいがする。
空気&水反応
空気と光に長時間さらされると敏感になることがある。 水に不溶。
反応性プロファイル
trans-Cinnamaldehydeは、強酸化剤、強塩基と相容れない。trans-Cinnamaldehydeは、水酸化ナトリウムと反応することもある。
火災の危険性
trans-Cinnamaldehydeは可燃性です。
潜在的な暴露
植物性の殺菌剤、殺虫剤。 抗真菌剤、コーンルートワームの誘引剤、犬や猫の忌避剤として使用される。 キノコ、連作作物、芝生、すべての食用商品の土壌ケーシングに使用できる。 EU諸国での使用はリストされていない。
出荷
UN1989 アルデヒド類、n.o.s.、危険物等級。 3; ラベル 3-可燃性液体
Incompatibility
アルデヒドは、自己縮合反応や重合反応に頻繁に関与している。 これらの反応は発熱性で、しばしば酸によって触媒される。 アルデヒドは容易に酸化され、カルボン酸を与える。 アルデヒドとアゾ化合物、ジアゾ化合物、ジチオカルバミン酸塩、窒化物、強還元剤との組み合わせにより、可燃性ガスや有毒ガスが生成される。 アルデヒドは空気と反応して、まずペルオキソ酸を生成し、最終的にカルボン酸を生成することがある。 これらの自動酸化反応は、光によって活性化され、遷移金属の塩によって触媒され、自己触媒性(反応生成物によって触媒される)である。 アルデヒドの出荷に安定剤(酸化防止剤)を添加すると、自動酸化を遅らせることができる。 酸化剤(塩素酸塩、硝酸塩、過酸化物、過マンガン酸塩、過塩素酸塩、塩素、臭素、フッ素等)とは相容れず、接触により火災や爆発を引き起こす可能性がある。 アルカリ性物質、強塩基、強酸、オキソ酸、エポキシド、ケトン、アゾ染料、腐食剤、ボラン、ヒドラジン
廃棄物処理
焼却する。 40CFR165に従い、殺虫剤および殺虫剤容器の廃棄に関する勧告に従うこと。
Journal of the American Chemical Society, 93, p. 2080, 1971 DOI: 10.1021/ja00737a057
Tetrahedron Letters, 18, p. 1215, 1977