Introduction: 片頭痛クリニック
片頭痛は、他の感覚、自律神経、認知症状のクラスターを伴う一側性頭痛からなり、世界疾病負担(GBD)調査2016によって、世界中で6番目に多い疾患、障害の主な原因の1つとして特定されており、労働年齢や若年成人、中年女性にしばしば発生する(Collaborators, 2018)。 したがって、片頭痛は、障害とともに生きる年数(YLDs)の点で非常に深刻な社会問題であり、15歳から49歳内のYLDsの最も重要な原因である(Steiner et al.、2018を参照)。 このような疾患の負担は、最近まで特定されていない:片頭痛は永久的な障害や死亡の原因ではない;頭痛は一般集団で時折発生する(Collaborators, 2018)。 片頭痛の明確な病因は不明であるが、頭蓋外循環が関与している(Drummond and Lance, 1983)。 片頭痛の臨床経過は、前兆期、前兆期、頭痛期、後遺症期(前兆期に類似)という異なる後続または併存する段階で明示される(Goadsbyら、2017a)。 前兆期には、イライラ、食欲不振、首のこわばりなどがあり、発作の2~72時間前から起こり、他の相にまたがって継続する。 国際頭痛障害分類第3版(ICHD-3)の定義によると。
– 前兆は、1つ以上の一過性の可逆的な神経学的障害によって特徴付けられ、そのうち少なくとも1つは片側の局在でなければならず、5分以上にわたって発症し、それぞれの障害が5~60分持続する;
– 片頭痛は、吐き気、羞明および幻聴、または両方を伴う4~72時間続く頭痛発作で構成される(Goadsbyら、参照:Gadsby et al., 2017a)。
痛みを伴わない刺激に続く痛みの知覚と定義される皮膚アロディニアは、患者の70%以上で発生します(Lambruら、2018)。 激しい頭痛は後遺症期に減衰して停止するが,無気力,傾眠,羞明などの他の症状は患者に影響を与え続け,片頭痛の根底にある複雑な神経基盤が示される(Lambru et al.) 1カ月あたりの罹患日数によって、片頭痛はエピソード型(片頭痛または頭痛の日が15日未満)と慢性型(15日以上、そのうち片頭痛の日が8日以上)に分類されます(Goadsbyら、2017bを参照)。 この側面は、病気の影響と治療法の選択肢に著しく影響する(Giamberardinoら、2017年)。 月に1~3回の発作であれば、頓服的な対症療法薬のみを使用することが可能ですが、月に4~14回の発作が起こると、予防的な治療を加えることが必須となり、後者の治療は病気の慢性化を避けるために必要です(Giamberardino and Martelletti, 2015; Giamberardino et al, 2017)、薬の使いすぎによる頭痛や難治性片頭痛のリスクを軽減するためである(Martelletti, 2017)。
片頭痛の病態とカルシトニン遺伝子関連ペプチド(CGRP)
片頭痛発作の正確な原因はまだよく分かっていませんが、現在の研究では、三叉神経系と脳幹全体の感作過程の重要性が強調されており、痛み処理領域での灰白質減少の観察(参照:Goadsby et al, 2017a). 細胞体を含む三叉神経節から擬似単極性一次求心性神経が血管と三叉神経頸複合体にシナプスし、そこから二次線維が三次視床皮質ニューロンと、青斑核、体液路周囲および視床下部にシナプスする(Goadsby et al.、2017a)。 三叉神経節や頸部後根神経節からの侵害受容線維は硬膜血管を支配し、その末端からはカルシトニン遺伝子関連ペプチド(CGRP)などの血管拡張を誘導する神経ペプチドが放出されます。 図1A-Cに、ヒト硬膜血管におけるCGRP、CLR、RAMP1の発現を示す。 実際,脳外血管を支配する自律神経線維には,ノルアドレナリン,セロトニン,アセチルコリン,ニューロペプチドY(NPY),血管作動性腸ポリペプチド(VIP),サブスタンスP(SP),ニューロキニンA(NU),CGRPなどの神経伝達性血管活性分子が含まれている(Goadsbyら,1990)。 CGRP受容体拮抗薬は、硬膜からの侵害受容情報を遮断する作用があり、視床核で処理され、そこから高次皮質領域に到達する。 5-hydroxytryptamine(5HT)1B/1D受容体作動薬、すなわちトリプタンは、このシステムを介して作用し、発生した血管拡張を打ち消すと考えられている。 プロプラノロールやtopiramateは予防薬として、後者は片頭痛の急性期に使用される薬剤である。 特に、トリプタンは血管収縮作用とは別に、5HT1B/Dシナプス前受容体に直接作用し、侵害受容に関与するCGRPなどのメディエーターの遊離を抑制することが知られている。 さらに、スマトリプタンは、三叉神経節におけるtransient receptor potential vanilloid 1(TRPV1)を介した内向き電流を抑制することが実験的に証明されています(Evans et al.) CGRPは片頭痛発作時に放出され、最も血管作動性の高い神経ペプチドとして、その頭蓋血管レベルが疾患の経過中に増加するといういくつかの役割を示します(Goadsbyら、1990)。 CGRPは脳脊髄液中でも変化を起こすことが示されている(van Dongen et al., 2017)。 中枢興奮性の変化とそれに続く片頭痛エピソードのブレークスルーへのトリガーは、長い間研究されてきました。 神経線維の刺激は、直流電位と逆流電位の両方を助長し、特に、一過性受容体電位(TRP)を発現する硬膜ペプチド性一次感覚求心性の活性化は、神経原性炎症として知られる炎症組織反応を誘発するCGPなどいくつかの分子の放出を誘発し得る(Xanthos and Sandkuhler,2014). 特に、CGRPは、頭蓋侵害受容と、髄膜および脳血管上のその受容体を結合する血管拡張のエピフェノメノンに関わっています(Deen et al.、2017)。 これらのプロセスは、増幅された痛み刺激を視床、視床下部、大脳皮質などの高次領域へ運ぶ三叉神経二次線維の感作を促進し、片頭痛を引き起こす(Dussorら、2014)。 TRPは、温度やpHの変化などの環境刺激に応答して活性化され、片頭痛の素因となることがあります。 CGRPは、カルシトニンをコードする11番染色体上のカルシトニン遺伝子CALC Iの組織特異的な代替スプライシングによって産生されます。 一方、βCGRPは11番染色体の別の場所にあるCALC II遺伝子から産生されます。αCGRP神経ペプチドは37アミノ酸からなるαアイソフォームとして中枢神経系に存在し、そのシグナル伝達は2つの受容体によって担われています
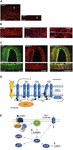
FIGURE 1.神経ペプチドの構造 片頭痛におけるCGRPの発生と経路。 ヒト硬膜血管におけるCGRP,CLR,RAMP1の発現。 (A)外膜の細い繊維にCGRPの免疫反応が見られる;(B)平滑筋細胞の細胞質にRAMP1の発現が見られる横断・縦断面;(C)平滑筋細胞層にCLRとRAMP1が共発現している。 (D)CGRP受容体の構成要素と、受容体のシグナル伝達と内在化に重要な残基。 CGRP受容体は、CLR(青)、RAMP1(黄)、RCP(オレンジ)により形成されている。 機能的に重要な残基は一文字の略号で示した。 アミノ酸残基は予測されるN末端シグナルペプチド(Swiss-Prot Q16602)の開始点から番号をつけた。 CLRのC-末端(∼N400-C436)およびICL3/TM5接合部のI312内のいくつかのアミノ酸は、CGRPによる効果的な内在化には必要である。 CLRのTM6 “kink”(P343)と推定される8番目のヘリックス(∼G388-W399)を含むCGRP受容体の重要な特徴が図示されている。 C′, C-末端;ECL, 細胞外ループ;ICL, 細胞内ループ;N′, N-末端;TM, 膜貫通型。 (E)CGRP受容体を介した細胞内シグナル伝達。 GαsシグナルはAC(緑)活性を上昇させ、細胞内cAMPを上昇させ、PKAを活性化し、その後、多くの潜在的下流エフェクターを活性化する。 パネル(A〜C)はEftekhariら(2013)、パネル(D,E)はWalkerら(2010)からそれぞれ許可を得て引用した。
最初のものはカノニカルCGRP受容体として知られており、Gαsタンパク質結合受容体で、機能するために受容体活性修飾タンパク質(RAMP)1が必要です(Goadsbyら、2017a)。 2つ目は、ヒトのアミリンサブタイプ1受容体(AMY1):アミリンはカルシトニン遺伝子ファミリーに属し、ホルモン活性を有する。 CGRPがその受容体に結合すると、β-アレスチンと複合体化した後、ダイナミン/クラスリン依存性のインターナリゼーションを受ける(Walker et al.) 構造変化が生じると、アデニル酸シクラーゼ(AC)の活性化、cAMPの増加、プロテインキナーゼA(PKA)の活性化が起こり、内皮一酸化窒素合成酵素の直接活性化を通じて血管拡張を促進し、疼痛反応が起こる。 この後者の受容体は、ホスホリパーゼC(PLC)の活性化、マイトジェン活性化プロテインキナーゼ(MAPK)、およびNOの放出を伴うGαq/11に結合することができる(Walkerら、2010参照)(図1D、Eは、CGP受容体を介した細胞内シグナルの概略図である)。 片頭痛患者へのCGRPの投与は発作を誘発し、この証拠は片頭痛の病因におけるCGRPの極めて重要な役割を支持している(Lassen et al.、2002)。 シグナル伝達の終了系はまだ特定されていません。 CGRPはネプリライシン、インスリン分解酵素、エンドセリン変換酵素-1によって代謝され、再吸収活性輸送系が仮説されている(Russellら、2014を参照)。 さらに、CGRPによって受容体が一過性に活性化されるとエンドソームに内在化され、速やかに細胞膜にリサイクルされるが、受容体を慢性的に刺激すると脱感作とリソソーム分解が誘導される(Russell et al.参照)。 2014)。
CGRP経路への薬理学的介入
片頭痛は多面的な障害を伴う神経血管障害であり、現在の経口トリプタンによる治療は急性発作に有効であるが、約40%の患者が治療に抵抗性を示す(Ferrari et al.、2001; Edvinsson, 2015)。 これらの選択的5-HT1B/1Dアゴニストは、最も一般的に使用されているスマトリプタンは、主に皮下経路に活性であり、脳血管の血管収縮、三叉神経系および三叉神経頸系の抑制を介して治療作用を発揮する(フェッラーリら、2001を参照)。 しかし、血管収縮は、これらの薬剤の心血管系の副作用の限界を表している。 さらに、トリプタン系薬剤による治療は、薬剤性頭痛のリスクがあるため、1ヶ月に9日以上続けることはできません。 2010年,A型ボツリヌス毒素(BoNT-A)が,反応のない慢性片頭痛患者の片頭痛予防薬としてFDAから承認されたが,投与が複雑(31部位への注射が必要)なため,患者のコンプライアンスに限界がある。 片頭痛の病態生理においてCGRPが果たす重要な役割のため、その受容体の拮抗薬が開発されています。 これらの薬剤は、ゲパントの一種に属します。 最初の経口ゲパントであるTelgecepantは、冠動脈疾患を有する片頭痛患者において良好な忍容性を示しましたが(ClinicalTrials.gov NCT00662818, Ho et al., 2012)、肝毒性を示したため、これらの低分子化合物の研究は継続されているものの、CGRP(nesumabs)あるいはCGRP受容体に対するモノクロナル抗体(mAbs)開発という新しいアプローチが提案されました。 これらの薬剤は、循環するCGRP分子の作用を阻害して片頭痛発作を予防すると考えられており、その大きさから血液脳関門(BBB)を通過しないため、作用部位は三叉神経系にあるはずです(Edvinsson, 2015)。 特に、硬膜血管はBBBに含まれない。 さらに、CGRPは、CGRP受容体を提示しない三叉神経節の半分のニューロンで発現し、サテライトグリア細胞で発現し、三叉神経節のニューロンソーマの30%で発現することから、BBBを通過せずパラクライン調節因子として作用すると考えられる(Yuan et al, 2017を参照)。 現在、エピソード性片頭痛および慢性片頭痛を対象に、eptinezumab、fremanezumab、galcanezumab、erenumabの4つのmAbが臨床試験で検討されています。 最初の3つのmAbはCGRPに対するヒト化抗体であり、erenumabはそのカノニカル受容体に対するヒト化抗体である。 これらの薬剤の半減期は非常に長く、1ヶ月に1回以上の投与は不可能であり、mAbは静脈内または皮下投与する必要があるため、この点は興味深いところです。 特に、eptinezumabは静脈内投与のみである(Israelら、2018)。 第III相PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) trial (ClinicalTrials.gov NCT02559895) では、頻発する片頭痛の予防に関するEptinezumabの有効性について評価された。 その結果、1~12週にわたる平均ベースライン8.5日からの月間片頭痛日数(MMD)の減少からなる主要評価項目において、プラセボの3.2日に対して300mg投与で4.3日、100mgで3.9日、30mgで4.0日と有意に減少した(Saper et al, 2018)。 慢性片頭痛の予防におけるエプチネスマブの評価については、PROMISE2(ClinicalTrials.gov NCT02974153)に1121人が登録されている。 ガルカネスマブは、EVOLVE-1第3相二重盲検無作為化プラセボ対照試験(ClinicalTrials.gov NCT02614183)で4期に分けて、EVOLVE-2第3相無作為化対照二重盲検6カ月臨床試験(ClinicalTrials.gov NCT026196)で、エピソード性片頭痛予防の効果を評価したものであり、その結果は、以下のとおりです。 EVOLVE-1では、galcanezumabの両用量(120mgおよび240mg)が、プラセボの2.8日と比較して、毎月の片頭痛日数をそれぞれ4.7日および4.6日有意に減少するという主要評価項目を満たした(Staufferら、2018年)。 EVOLVE-2では、患者さんはガルカネズマブ120mgまたは240mgの月1回の注射を受けました。 月平均片頭痛日数は、プラセボで得られた2.3日の減少に対し、それぞれ4.3日および4.2日減少した(p < 0.001)(Skljarevskiら、2018年)。 また、副次的評価項目である片頭痛特異的QOL質問票(MSQ)のRole Function-Restrictive(R-FR)領域スコアで評価した機能障害の軽減、患者全般印象度(PGI-S)および片頭痛障害評価(MIDAS:時点=6カ月目)のスコアの改善も満たされました(Skljarevski et al.、2018)。 ガルカネズマブ120mg、240mgを投与した患者147名(65.0%)、163名(71.5%)、プラセボ投与患者287名(62.3%)が有害事象を呈し、そのうちガルカネズマブ240mg投与中の患者7名のグループ内で急性心筋梗塞、一過性虚血発作が発生しました(Skljarevski et al.、2018年)。 収縮期/拡張期血圧のベースラインからの平均変化量に統計学的な有意差は認められなかった。 ガルカネズマブ120mg群、ガルカネズマブ240mg群、プラセボ群のそれぞれ19例(8.6%)、11例(5.1%)、2例(0.5%)に治療起因性抗薬物抗体(ADA)が認められた。 慢性片頭痛に対するgalcanezumabを評価したREGAIN第III相試験において、MMDはプラセボの2.7に対して120mg投与で4.8日、240mg投与で4.6日減少した(Yuanら、2017を参照)。 さらに、ガルカネスマブによる治療は、統計学的に有意な効果の持続性を有することが実証されました(Forderreuther et al.、2018)。 フレマネズマブは、片頭痛の予防的治療のための第III相HALO試験(ClinicalTrials.gov NCT02638103)で検討された。 プラセボの2.2日減少に対し、12週時点のエピソード性片頭痛のMMDを225mg月1回3カ月で3.7日、675mg四半期1回投与法で3.4日減少した(Yuan et al, 2017を参照)。 エピソード性片頭痛予防におけるエレンマブの有効性は、第3相無作為化二重盲検プラセボ対照試験ARISE(ClinicalTrials.gov NCT02483585)において検討されました。 MMDは、プラセボの1.8日に対し、エレンヌマブ皮下注70mgで2.9日減少し(p<6593>0.001)、副次評価項目であるMMDの少なくとも50%減少および月間片頭痛特異的薬剤治療日(MSMD)の変化に効果を示した(Dodick et al.、2018)。 有害事象を呈した患者の割合は、mAb投与群とプラセボ投与群で同様であり、12週目まで抗エレヌマブ結合抗体陽性が4.3%、うち1人は一過性に中和抗体陽性となったが4週目のみだった(Dodick et al.、2018年)。 また、第III相STRIVE臨床試験(ClinicalTrials.gov NCT02456740)では、エピソード性片頭痛の予防に対するエレンマブの有効性が評価された。 エレヌマブは、毎月70mgまたは140mgを6カ月間投与された(Goadsbyら、2017b)。 ベースラインの平均MMD回数は8.3回で、70mg投与では3.2回、140mg投与では3.7回と、プラセボの1.8日に比べ減少した(対プラセボで各用量のp<6593>0.001あり)(Goadsbyら、2017b)。 また、治療の最終3カ月間において、各用量のエレンマブは、1カ月あたりの平均片頭痛日数がベースラインから50%以上減少し、片頭痛身体機能影響日記(MPFID)の日常-活動(MPFID-EA)および身体-障害(MPFID-PI)の両方がベースラインから減少する副次評価項目が満たされた(Goadsbyら、2017年b)。 抗エレヌマブ抗体を有する患者において、70mgで治療した群の1人だけが中和抗体陽性となり、クレアチニン値、肝毒性、総好中球数および心電図機能の観点から、mAbは全体的に良好な忍容性を示した(Goadsby et al.、2017b)。 著者らによると、この試験の限界の1つは、2種類以上の片頭痛予防薬に治療反応を示さなかった患者を除外したことである(Goadsbyら、2017年b)。 さらに、涙、結膜充血、鼻漏を伴う眼窩周囲の激しい片側性疼痛を特徴とする一次性頭痛である群発頭痛の予防におけるフレマネズマブ(NCT02945046およびNCT02964338)およびガルカネスマブ(NCT02397473およびNCT02438826)の有効性を検討する臨床試験(イスラエルら、2018参照)がある(Vollesenら、2018参照)。 実際、エピソード性(活動期または寛解期)または慢性群発頭痛の患者に対して、CGRPを1.5μg/minで20分間(少なくとも7日間隔てて2日間)点滴ポンプを介して持続点滴すると、活動期の患者または慢性群発頭痛の患者で群発様発作が誘発されたが寛解期では誘発されない(ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018) ことが証明された。 mAbsの主なPKの利点は、長い排泄半減期によって毎日の投与の必要性を制限し、タンパク質分解によるクリアランスに代表されます。 ゲパントの肝臓への影響とCGRPの血管拡張特性のために、CGRPシグナル伝達の阻害の最も恐れられるリスクは、仮定された肝毒性と心血管理論リスクからなる(Yuan et al.、2017)。 欧州頭痛連盟(EHF)は、GRADE(Grading of Recommendation, Assessment, Development and Evaluation)法を適用し、不可能な場合は専門家パネルの意見に依存する抗CGRP mAbsの使用に関するガイドラインを作成しました(Sacco et al.、2019)
Pharmacokinetics (PK) / Pharmacodynamics (PD) Relationship of Anti-Migraine mAbs
mAbsの開発により、CGRP経路を阻害する全く新しいアプローチになっていることがわかります。 低分子ではなくmAbsを使用して達成された主なPDの改善は、広いCGRP受容体-リガンド結合部位を標的とすることがより容易であることである(Taylor, 2018)。 mAbsの主なPKの利点は、毎日の投与を必要としない長い消失半減期とタンパク質分解によるクリアランスに代表され、CGRPシグナル伝達阻害の最も恐れられるリスクは、ゲパントの肝臓への影響による仮説上の肝毒性とCGRPの血管拡張特性による心血管理論リスクから構成されます。 しかしながら、これらのmAbがその生産から標的までの道のりをたどる中で、これらの分子が最初に直面する障害は、経口バイオアベイラビリティが乏しいことから、その投与です。 したがって、非経口投与経路が必要であり、治療へのアドヒアランスを良好にするために、半減期を長くする必要があります(Taylor, 2018)。 免疫グロブリン(Ig)G1、2、または4が可能性である(Wangら、2008;Taylor、2018)。 IgGの起源とは別に、最終的な交差反応性および異化の個々の修飾が半減期に影響を及ぼし得る(Bonilla、2008;Taylor、2018)。 mAbsを生産するために使用される技術は、単一タイプの抗体の決定されたクローンを生産する連続的な分裂中の細胞からなるハイブリドーマの使用に依存し、変動はないか低い(Taylor, 2018)。 mAbを構成するアミノ酸の起源に基づいて、キメラ(ネズミの免疫;ネズミのFragment抗原結合領域Fabの維持、しかしヒトFragment結晶化可能領域Fcの導入)、ヒト化(zumabs、ヒトFab領域にマウス相補性決定領域、CDRを移植)およびヒト(例えばXenoMouseのようにヒト化したマウスにヒト抗体遺伝子全塩基配列を導入)mAbを区別することができる(Taylor、2018を参照)。 CDRは標的へのフィッティングに影響を与える。 4つの抗片頭痛mAbsのうち、erenumabだけがヒトであり、移植されたCDRはfremanezumabがマウス、eptinezumabがウサギ、galcanezumabがマウスである可能性が高い(Taylor, 2018を参照)。 特に、唯一の抗CGRP受容体mAbは、ヒトIgG2λλであるerenumabであり、CGRPの部位に対して向けられた他の3つのmAbは:eptinezumab、遺伝子組み換えヒト化IgG1k;fremanezumab、ヒト化IgG2k;galcanezumab、ヒト化IgG4(Edvinsson et al, 2018)です。 エレヌマブ(Tmax 3-14日)は、フレマネズマブ(Tmax 3-20日)、ガルカネズマブ(Tmax 7-14日)と同様、毎月皮下投与が必要である(Taylor, 2018)。 逆に、エプチネスマブ(Tmax 4.8時間)は3カ月に1回の静脈内投与で、フレマネズマブやガルカネスマブよりも会合が早く、解離が遅い。 mAbsは大きなタンパク質であるため、BBBを容易に通過することができない。 CGRP受容体の一部はBBBの外にあるため、抗CGRP mAbsの作用が可能になります(Edvinsson, 2018)。 結合前に、抗体はピノサイトーシスを介して血管内皮細胞に入る。 大きな見かけの分布容積は、組織およびmAbの結合の関連する容量に依存し得る(Loboら、2004年;Taylor、2018年)。 エレヌマブは、CGRP結合ポケットを含むヒトGタンパク質共役型受容体カルシトニン受容体様受容体CALCRL(CGRPおよびアドレノメデュリンの受容体に必要)とRAMP1の細胞外ドメインの融合タンパク質を標的とする唯一のものであり、最も新しいアプローチです(Edbinsson et al.、2018年)。 ヒト神経芽細胞腫細胞(SK-N-MPC)において、-CGRPとヒトCGRP受容体の結合をKi 0.02 ± 0.01 nMで競合的に阻害することが実証されています(Shi et al.,2016)。 エレヌマブは、SK-N-MPCで実施した機能アッセイにおいて、IC50が2.3 ± 0.9 nMのCGRP刺激cAMP蓄積の強力かつ完全な拮抗作用を発揮した(Shi et al.) さらに、それは、10μMの試験された最高濃度まで、アドレノメデュリン、カルシトニン、およびアミリン受容体を含む他のヒトカルシトニンファミリー受容体にアゴニスト/アンタゴニスト効果を示さないCGRP受容体に5000倍の選択性をもたらす(Shi et al.、2016年)。 フレマネズマブは、異なる血管に対してその効果を発揮する可能性があり、実際、前収縮したヒト大脳動脈、髄膜動脈および末梢腹部動脈におけるCGRP誘導血管拡張の濃度依存的阻害を引き起こす(Ohlssonら、2018年)。 さらに、CGRPは神経細胞やグリア細胞、グリムパティック(リンパ様)にも作用すると考えられ、後者はオーラの発現に関与している(Messlinger, 2018参照)。 肝酵素による代謝がない可能性が高いため、薬物間相互作用を回避できる可能性がある。 排泄は、アミノ酸の腎蛋白分解により行われる。 臨床試験では、これらの抗体は、強調された注射部位の痛みを除けば、全体的に良好な忍容性があると報告されているが、ADAの産生を通じた免疫原性が懸念されている(Taylor, 2018年)。 ガルカネスマブの単回および複数回投与の異なるレジメンによる治療を評価する二重盲検無作為化プラセボ対照臨床試験(ClinicalTrials.gov NCT 01337596)中、治療した患者のうち11人(26%)が、用量反応およびPKおよびPDに対する検出効果なしに治療緊急ADAの低力価(1:10〜1:80)(3人で既存の抗体は力価が増加)を呈しました(Monteith他、2017年)。 ADAの存在は、薬剤の除去を加速させ、最悪の場合、最終臓器障害を助長する可能性があるため、免疫原性の研究は不可欠である(Taylor, 2018)。 抗片頭痛mAbの主な特徴を表1にまとめた。”2873″

Table 1. fremanezumab、eptinezumab、galcanezumab、およびerenumabの主な特徴。
結論
片頭痛は、再発頭痛の90%以上を占める、障害を与え衰弱させる神経血管痛の状態で、その傾向は遺伝し得る(MacGregor、2017年)。 Divalproexナトリウム、バルプロ酸ナトリウム、トピラマート、メトプロロール、プロプラノロール、チモロールは、片頭痛予防のための強い、レベルAの証拠が証明されています(米国神経学会および米国頭痛協会、2015)。 しかし、三環系抗うつ薬、βブロッカー、5-HT2拮抗薬エルゴット、抗てんかん薬などの古典的な経口予防治療薬はすべて片頭痛用に開発されておらず、片頭痛患者の45%までしか、月間の片頭痛の日数を50%減少させることができず(D’Amico and Tepper, 2008)、忍容性に欠け、服用率が低いためでもありました。 薬の持続性と中止については、米国のレトロスペクティブな請求分析で検討され(Heppら、2017)、その結果、最初に使用した薬への持続性が低く、薬物クラスに依存せずに6カ月までに中止する量が多いことが示唆されている。 片頭痛の生理病理に関与する三叉神経節、脳幹から高次領域への経路において、神経炎症と中枢性感作を持続させるCGRPの基本的な役割から、CGRPとその受容体に対する新規mAbが開発されています。 最初の低分子CGRP拮抗薬は肝毒性を示すが、mAbsは血管拡張を阻害するため、毒性代謝物も心血管副反応も生じなかった(Deen et al.、2017年参照)。 中枢性の副作用も強調されなかった。 CGRPをブロックすることの潜在的な長期的効果はまだ研究される必要があるが、これらの抗体の基本的な利点は、毎月またはより少ない頻度の注射を可能にする長い半減期に由来し、これは治療の順守およびその次の効果を著しく改善し得る(Deen et al.、2017年)。 したがって、抗CGRP mAbsは、無反応性片頭痛に対する治療薬の有効なツールとなり得るが、有効性と安全性(すなわち、毒性代謝物の生成、ADAによる免疫原性、中和抗体および組織交差反応および副作用)の深いモニタリングが必須である(Taylor、2018年)。 実際、古いバイオテクノロジー製品からの証拠は、抗腫瘍壊死因子α(TNFα)mAbによる治療は、これらの薬剤がmAbを分解し得るが、標的に結合する前にその作用を中和し得る抗体の産生を誘発するので、最初の治療反応の(一次非反応者と対照的に)二次的失敗を受け得ることを示している(Pradoら、2017を参照されたい)。 免疫原性は、グリコシル化、mAbの種類、エピトープの数、製剤中の不純物によって影響を受ける可能性があります(Prado et al.、2017年参照)。 さらに、いくつかの明らかに説明のつかない重篤な副作用が、抗TNFαの免疫原性と関連している。 局所的および全身的な過敏性反応、感染症に対する感受性の増加を伴う免疫不全、および死に至ることさえある免疫複合体形成が強調されている(Prado et al.、2017年参照)。 したがって、治療診断学(theranostics)の使用は、これらの薬学的装置の知識と正しい管理を改善する可能性がある(Bendtzen, 2013; Prado et al., 2017)
著者貢献
MTC、LAM、PT、GBが研究を考案した。 DSは試験結果の収集、文献の分析、原稿執筆を行った。 AA、LR、MNは文献調査に参加した。 最終原稿は全著者が読み、承認した。
Conflict of Interest Statement
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する
American Academy of Neurology and American Headache Society (2015). 付録a:臨床医のためのエビデンスに基づくガイドラインの要約、更新:成人におけるエピソード性片頭痛予防のための薬物療法。 Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). 個別化医療:腫瘍壊死因子α拮抗薬の合理的使用に不可欠なセラノミクス(治療診断学)。 Discov. Med. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). 静脈内または皮下経路で投与された免疫グロブリンの薬物動態。 Immunol. Allergy Clin. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). 片頭痛と緊張型頭痛の世界、地域、国の負担、1990-2016年:世界疾病負担調査2016のための系統的分析。 Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). 片頭痛の予防法:一般原則と患者の受容性。 Neuropsychiatr. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). 片頭痛患者におけるCGRPの遮断-長所と短所の検討。 J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V.,など (2018).All. ARISE:エピソード性片頭痛に対するエレンマブの第3相ランダム化試験。 Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., and Lance, J. W. (1983). 片頭痛における頭蓋外血管の変化と痛みの発生源。 Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J.Y. , Ossipov, M.H., Dodick, D.W., and Porreca, F. (2014). 新規片頭痛治療薬のためのTRPチャネルの標的化(Targeting TRP channels for novel migraine therapeutics). ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L.(2015). 片頭痛治療におけるCGRP受容体拮抗薬およびCGRPとその受容体に対する抗体。 Br. J. Clin. Pharmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). 片頭痛のCGRP経路は治療の有力なターゲットとして。 Headache 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K.A., Warfvinge, K.and Krause, D. N. (2018). 新しい片頭痛治療のターゲットとしてのCGRP – ベンチからクリニックへのトランスレーションの成功。 Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari,S., Warfvinge,K., Blixt,F. W., and Edvinsson,L. (2013). 末梢性三叉神経系におけるCGRPおよびCGRP受容体を貯蔵する神経線維の分化。 J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans,M. S., Cheng, X., Jeffry, J. A., Disney, K. E., and Premkumar, L. S. (2012). スマトリプタンは三叉神経細胞におけるTRPV1チャネルを阻害する。 Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B. , and Goadsby, P. J. (2001). 急性片頭痛治療における経口トリプタン(セロトニン5-HT(1B/1D)アゴニスト):53試験のメタアナリシス(Meta-analysis of 53 trials. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., and Lainez, M. J. A. (2018). エピソード性または慢性片頭痛の成人患者におけるガルカネスマブの予防効果は持続的である:第3相ランダム化二重盲検プラセボ対照EVOLVE-1、EVOLVE-2、およびREGAIN試験からのデータ。 J. Headache Pain 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., and Martelletti, P. (2017). カルシトニン遺伝子関連ペプチド受容体は、エピソード性片頭痛の人々の管理のための新規ターゲットとして:エレンマブの現在のエビデンスと安全性プロファイル。 J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., and Martelletti, P. (2015). 片頭痛治療のための新薬。 Expert Opin. エマージング。 Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., and Ekman, R. (1990). 片頭痛時のヒトの脳外循環における血管作動性ペプチドの放出。 Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., and Akerman, S. (2017a). 片頭痛の病態生理:感覚処理の障害。 Physiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J.H., Zhang, F., et al. (2017b). エピソード性片頭痛に対するエレンマブの対照試験。 N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P.,など (2017). 慢性片頭痛患者における片頭痛予防薬の経口薬の持続性と切り替えパターン:レトロスペクティブな請求分析。 Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J.、他 (2012)(2012). 片頭痛と冠動脈疾患を持つ患者におけるテルカジェパントの無作為化比較試験。 Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., and Reuter, U. (2018)(2018). 片頭痛の予防的治療のためのCGRPモノクローナル抗体. Curr. Pain Headache Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). 片頭痛治療のための新薬:最新情報。 Expert Opin. エマージング。 Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., and Olesen, J. (2002年). CGRPは片頭痛の原因的な役割を担っている可能性がある。 Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E.D., Hansen, R.J., and Balthasar, J.P. (2004). 抗体の薬物動態と薬力学。 J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor,E. A. (2017). 片頭痛のこと Ann. Intern. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti、P. (2017).。 片頭痛スペクトラムにおけるCGRP(r)モノクローナル抗体の応用:ニーズと優先順位。 BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). CGRPの大洪水-三叉神経血管系におけるソース、シンク、シグナル伝達部位。 J. Headache Pain 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Radd, E., Scherer, J. C., et al (2017). 健康なボランティアにおけるCGRP結合モノクローナル抗体LY2951742(Galcanezumab)の安全性、忍容性、薬物動態、薬力学。 Front. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., and Edvinsson, L. (2018). Fremanezumabは、ヒトの大脳動脈、中膜動脈、腹部動脈におけるCGRPによる拡張をブロックする。 J. Headache Pain 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). 生物学的抗TNF薬:治療失敗と有害事象の根底にある免疫原性. Expert Opin. Drug Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S.D. (2014). カルシトニン遺伝子関連ペプチド:生理学と病態生理. Physiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U. , Terwindt, G., Mitsikostas, D. D., et al. (2019). 片頭痛予防のためのカルシトニン遺伝子関連ペプチドまたはその受容体に作用するモノクローナル抗体の使用に関する欧州頭痛連盟のガイドライン. J. Headache Pain 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., D., Dodick, Silberstein, S.、他 (2018)(2018). PROMISE-1(Prevention of migraine via intravenous eptinezumab safety and efficacy-1)試験の主要結果:頻回エピソード性片頭痛の予防に対するeptinezumabの有効性と安全性を評価する第3相ランダム化二重盲検プラセボ対照試験(S20.001). Neurology 90(15 Suppl.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al.(2016).の論文。 カルシトニン遺伝子関連ペプチド受容体に対する強力かつ選択的なヒトモノクローナル抗体、AMG 334の薬理学的特性評価。 J. Pharmacol. Exp. Ther. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018年). エピソード性片頭痛の予防に対するガルカネスマブの有効性と安全性:EVOLVE-2第3相ランダム化比較臨床試験の結果。 Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). エピソード性片頭痛の予防のためのガルカネスマブの評価:EVOLVE-1無作為化臨床試験。 JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., and Katsarava, Z. (2018). 片頭痛は50代以下の障害の第一の原因:今、保健政治家は注目するだろうか? J. Headache Pain 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R.(2018). CGRP、アミリン、免疫学、頭痛医学. Headache 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al (2017). 脳脊髄液中の片頭痛バイオマーカー:システマティックレビューとメタアナリシス。 Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A.L. H., Snoer, A., Beske, R.P., Guo, S., Hoffmann, J., Jensen, R.H., et al. (2018). 群発頭痛発作に対するカルシトニン遺伝子関連ペプチドの注入の効果:無作為化臨床試験。 JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker,C. S., Conner,A. C., Poyner,D. R., and Hay,D. L. (2010). カルシトニン遺伝子関連ペプチド受容体によるシグナル伝達の制御. Trends Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., and Balthasar, J.P. (2008). モノクローナル抗体の薬物動態とファーマコダイナミクス。 Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos,D. N., and Sandkuhler, J. (2014). Neurogenic neuroinflammation: Neuronal activityに反応した炎症性CNS反応。 Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C.G., Kaiser, E.A., and Silberstein, S.D. (2017). 片頭痛のためのCGRPモノクローナル抗体:根拠と進歩。 BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar
.