イオン性化合物と共有結合性化合物の物性
一般に、イオン性化合物と共有結合性化合物は異なる物理特性をもっています。 イオン性化合物は硬い結晶性固体を形成し、高温で融解し、蒸発しにくい。 これらの性質は、イオン性固体の特徴的な内部構造に由来する。図2.7.4の(a)に模式的に示すように、正と負のイオンが交互に並び、強い静電引力によって結合した3次元的な構造を示している。 一方、共有結合性化合物の多くは、図9.5.1の(b)に示すように、分子内の原子は強い分子内共有結合(分子内の力)によって結合しているにもかかわらず、比較的弱い分子間力(分子間の力)によって結合した個々の分子から構成されています。 共有結合を持つ物質は、分子間相互作用の強さによって、室温・常圧で気体、液体、固体のいずれにもなる。 共有結合を持つ分子固体は、低温で溶けて蒸発しやすい柔らかい結晶を形成する傾向がある
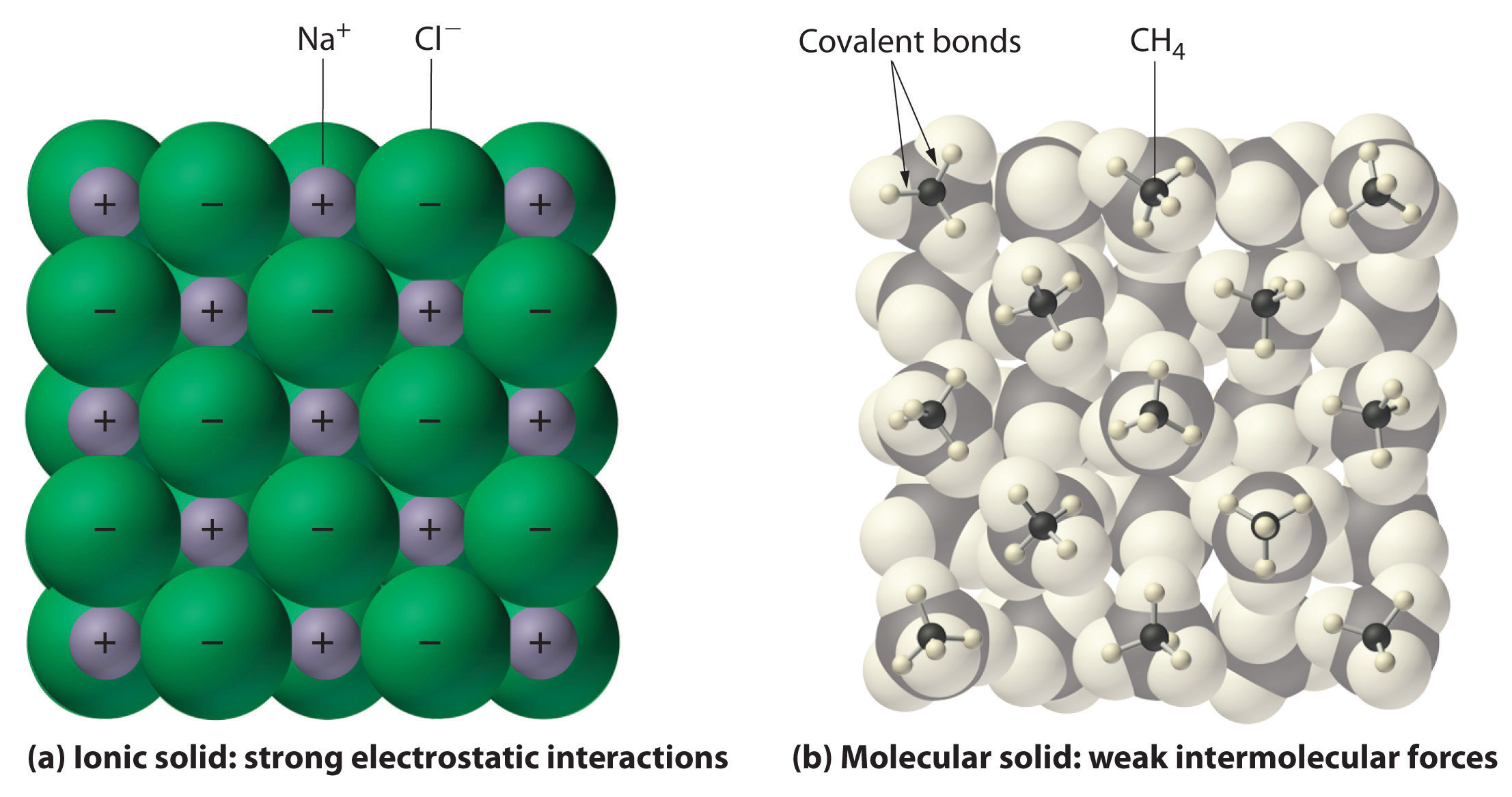
図9.5.1: イオン性固体および共有結合性固体における相互作用。 (a)塩化ナトリウム(NaCl)のようなイオン性固体中の正負の荷電イオンは、強い静電相互作用によって結合されている。 (b)分子性固体の代表格である固体メタンにおいて、メタン分子が比較的弱い分子間力によって結合している様子を示している。
炭化水素
分子性固体は、双極子-双極子相互作用、ロンドン分散力、水素結合、またはこれらの任意の組み合わせによって互いに保持されている原子または分子から構成されています。 固体ベンゼンの分子の配置は次の通りである:

図9.5.2: 固体ベンゼンの構造。 固体ベンゼンでは分子の平面が平行ではなく、90°の角度で並んでいる。
分子性固体では分子間相互作用がイオン結合や共有結合に比べて比較的弱いため、柔らかく低融点で気化しやすい( \(ΔH_{fus}) and ΔH_{vap} are low )傾向にあり、分子性固体ではイオン結合や共有結合に比べて分子間にある相互作用が弱い( ΔH_{vap} is low )。 類似の物質では、ロンドン分散力の強さは分子量の増加とともに滑らかに増加する。 例えば、芳香環が1つ、2つ、3つ結合したベンゼン(C6H6)、ナフタレン(C10H8)、アントラセン(C14H10)の融点は、それぞれ5.5℃、80.2℃、215℃であり、この融点が高いほど、ロンドン分散力の強さは大きくなる。 融解エンタルピーもベンゼン(9.95 kJ/mol) < ナフタレン (19.1 kJ/mol) < アントラセン (28.8 kJ/mol) と系列内で滑らかに増加している。 しかし、結晶中に効率よく詰め込むことができない形状の分子は、分子間相互作用を最適化するための配置ができないため、融点や融解エンタルピーは予想外に低くなりがちである。 このため、トルエン (C6H5CH3) と m- キシレンの融点はそれぞれ -95°C と -48°C であり、より軽いが対称的な類似物であるベンゼンの融点よりもかなり低い。
自己修復ゴムは、重要な商用アプリケーションが期待できる分子固体の例である。 この材料は伸びることができますが、粉々に折られると、弱さを示すことなく、水素結合ネットワークの再構築により再び結合することができます。 他の応用例としては、接着剤や自己修復する自転車のタイヤへの利用が研究されている

図 9.5.3: トルエンとm-キシレン。 トルエンとm-キシレンはフェニル環にメチル基が結合しているため、固体のベンゼンのように環がうまくパッキングされない
。