24-6C ニトロ化合物の反応
ニトロ化合物は熱力学的にかなり不安定で、例えばニトロメタンの分解熱は次の化学量論によると、(67.)である。4 \: \text{kcal mol}^{-1})
このような反応のかなりのエネルギーと速い速度を利用して、ニトロ化合物を爆薬として商業的に利用しているのである。 TNT のようないくつかのニトロ化合物では、衝撃に弱いという利点もある。
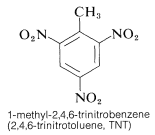
TNT は単純な衝撃では容易に爆発せず、爆発せずに燃焼することさえある。 しかし、一旦起爆が始まると、分解は急速に伝播する。 適度な取り扱い安定性と高い熱力学的ポテンシャルという特徴から、ニトロ化合物は特に有用である。 このほか、PETN(17-3C項)、シクロナイト(16-4C項)、ピクリン酸、テトリルなどが爆薬として有用である:
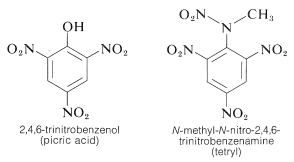
香族ポリニトロ化合物の重要な特徴は、特にアルキル基で置換した香族炭化水素と「電荷移動」錯体を形成できる点である。 2,4,6-トリニトロベンゼノール(ピクリン酸)と芳香族炭化水素との錯体は結晶性固体となることが多く、芳香族炭化水素の分離・精製・同定に有用である。 これらの物質は「炭化水素ピクレート」と呼ばれるが、実際には塩ではないので、この名称は誤解を招きやすい。 さらに、芳香族炭化水素とトリニトロベンゼンとの間にも同様の錯体が形成されるが、これは錯体形成に水酸基ではなくニトロ基が必須であることを示している。 これらの錯体の結合は、ハロゲンとアルケンやベンゼンなどとの(22-4D, 10-3C)項にあるような、電子に富む物質と電子に乏しい物質の間の引力によるものである。 電荷移動錯体という記述名から、ドナー(電子豊富)分子からアクセプター(電子不足)分子への電子移動が起こるVB構造を持つことが示唆される。 また、少なくとも1成分が電子系であることから、”tea complex “と呼ばれることもある。 ポリニトロ化合物と芳香族炭化水素の電荷移動型錯体は、芳香環が平行面に並ぶサンドイッチ型構造をとるが、必ずしも中心が一致している必要はない。 たとえば、ベンゼンとテトラシアノエテンは、それぞれ単独では無色ですが、混ぜると明るいオレンジ色の錯体を形成します。 電荷移動錯体では、両成分が関与する電子の非局在化によって励起状態が安定化される可能性が高くなるため、成分に対して吸収波長が長くなることが予想されるのである。
ニトロ化合物の還元は、さまざまな還元剤で容易に起こり、そのような還元は芳香族アミンの特に有用な合成を可能にする(セクション23-12B):
ニトロ化合物のアミンへの還元は、6当量の還元剤を要する:
人はこのような還元が単一のステップで起こることは期待しないであろう。 実際、還元は段階的に行われ、一連の中間体を経て進行するが、酸溶液中の強力な還元剤では、せいぜい一過性の存在に過ぎない。 2当量の還元剤で逐次形成される中間体は、ニトロソ化合物, \(ce{R-N=O})と、(ce{N})-置換アザノール(ヒドロキシルアミン), \(ce{RNHOH}):
{longrightarrow} である。 \ʕ-̫͡-ʔ \ЪЪЪ \ʕ-̫͡-ʔ \underset{-\ce{H_2O}}{\overset{2 \left}{\longrightarrow}} \ce{RNH_2}}
このように、対応するニトロ化合物から亜鉛と塩化アンモニウムの溶液を用いて、直接(N}) – アリール置換アザノールを得ることができる。 しかし、亜鉛と塩酸ではアミンが得られる:
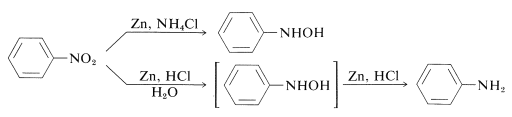
これらの反応の違いは、溶液の酸性度に伴う還元速度にある。 また、塩化アンモニウムは、”weak acid “であり、塩化アンモニウム溶液のpHは6程度である。
制御された条件下で “weak ache{N}”のアリラザノールを酸化するとニトロソ化合物が生成する。 この反応はアルコールのケトンへの酸化(Section 15-6B)と似ていない:
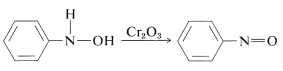
アリールニトロ化合物をあまり強力でない還元剤、特にアルカリ媒体で還元すると、二分子の還元生成物の不思議なコングロマリットと思われるような物が得られる。 たとえばニトロベンゼンの場合、
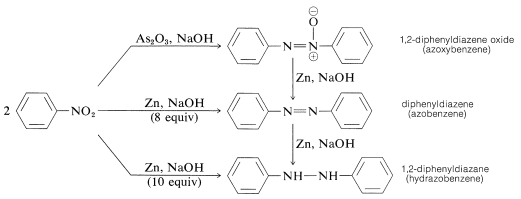
これらの物質はすべて錫と塩酸でベンゼンアミンに還元されることがある。 その結果、それぞれはニトロ化合物のアミンへの還元における中間体である可能性があるが、必ずしもそうであるとは限らない。 二分子還元生成物の形成は、ニトロソ化合物とアザノールまたはアミンとの間の塩基による反応と、おそらく最初に生成した物質のさらなる還元の結果である。
いくつかのポリニトロベンゼン誘導体は重要な除草剤としての用途を持っている。 その例として、♪♪♪(♪♪ce{N}^3})、♪♪(♪♪♪ce{N}^3})-ジエチル-6-トリフルオロメチル-2,4-ジニトロ-1,3-ベンゼンジアミンと♪♪(♪♪ce{N})、(♪♪♪ce{N})-ジプロミル-4-トリフルオロメチル-2,6-ジニトロベンゼンアミンを挙げることができる。
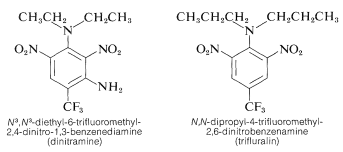
土壌に混ぜると雑草の苗を殺すが、綿、大豆、落花生などの作物の苗は殺さない物質。 活性は高く、通常、雑草をよく防除するためには、約 \(0.08℃: \text{g m}^{-2}) しか必要としない。
ニトロアルカンの最も重要な反応は、第一および第二化合物の⑴の水素が関与する反応である。 例えば、ニトロメタンは十分な酸性であるため、水酸化物水溶液に溶ける。 6012>
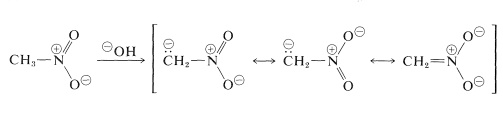
このイオンの興味深い性質は、溶液を酸性にすると、ニトロメタンの不安定でかなり強い酸性の異性体(アシ体という)が生成し、これがゆっくりと安定なニトロ体に戻っていくことである。
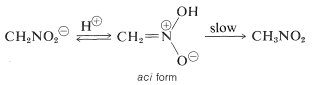
カルボニル化合物のエノール塩を酸性化しても同様の変化が起こるが、主な違いは単純なケトンのエノールと比較してアシ・ニトロ化合物がはるかに長命なことである(セクション17-1Bを参照)。
一級および二級ニトロ化合物は、適当なカルボニル化合物と塩基性触媒を用いてアルドール付加やマイケル付加を起こす。
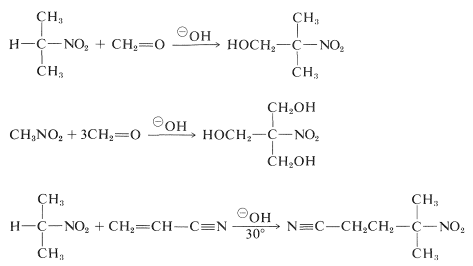
残念ながら、カルボニル化合物の塩基触媒によるアルキル化に類似したアルキル化反応は、一般に高次ニトロ化合物の合成には有用でない。なぜなら、第一級ニトロ化合物の共役塩基の♪(♪)アルキル化は♪(♪)アルキル化より遅い。