ほとんどの医療は、「平均的な患者」向けに一律に設計されており、ある患者には成功するが、他の患者にはそうでない場合がある。 プレシジョンメディシン(個別化医療)は、人々の遺伝子や環境、ライフスタイルの違いを考慮し、病気の予防や治療をオーダーメイドで行う革新的なアプローチであり、時に「個別化医療」とも呼ばれます。 精密医療の目標は、適切な患者に適切な治療を適切な時期に行うことです。
精密医療の進歩により、すでに強力な新発見や、個人の遺伝子構成や腫瘍の遺伝子プロファイルなど、個人の特定の特性に合わせたFDA承認の治療法が生み出されています。 さまざまながんの患者が、患者ケアの一環として日常的に分子検査を受けることで、医師は生存の可能性を高め、副作用への曝露を減らす治療法を選択することができます。 次世代シーケンス(NGS)検査は、人のゲノムの大きな部分を迅速に特定、または「シーケンス」することができ、精密医療の臨床応用における重要な進歩となっています。
患者、医師、研究者は、これらの検査を利用して、ヒト疾患の診断、治療、理解を深めるのに役立つ遺伝子変異を見つけることができます。
プレシジョンメディシンの推進におけるFDAの役割
FDAは、患者や臨床医が正確かつ臨床的に意味のある検査結果を得られるよう、NGS検査の正確さを確保するよう努めています。
NGSを通じて生成される膨大な量の情報は、FDAに新規規制課題を提起しています。 現在の規制アプローチは、単一の疾患または状態(血糖値やコレステロール値など)を検出する従来の診断には適切ですが、これらの新しい配列決定技術には、1つで数百万の検査に相当するものが含まれています。 このため、FDAは産業界、研究所、学界、患者や専門家団体の関係者と協力して、急速に進化するこの技術に対応する柔軟な規制アプローチを開発しました。このアプローチでは、コンセンサス規格、クラウドソースデータ、最先端のオープンソースコンピューティング技術を活用してNGS検査開発をサポートします。 このアプローチは、検査と研究におけるイノベーションを可能にし、正確で信頼性の高い遺伝子検査へのアクセスを加速します。
Streamlining FDA’s Regulatory Oversight of NGS Tests
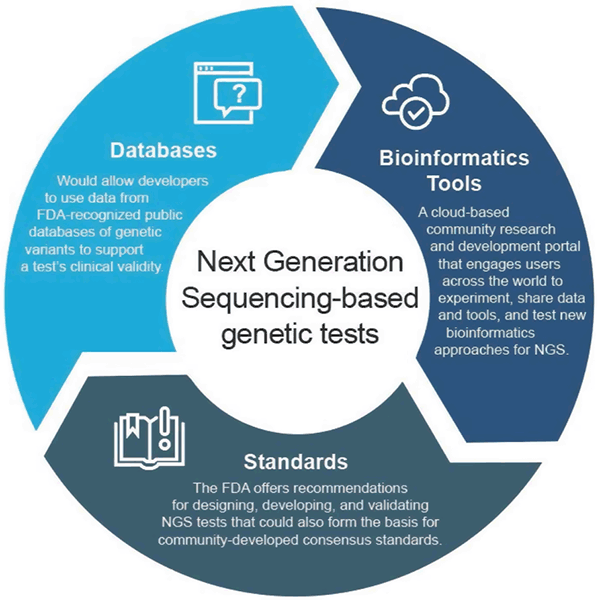
2018年4月に、FDAはNGSベースの検査の臨床および分析の妥当性を裏付けるデータの提出とレビューを効率化するアプローチを推奨する2つの最終ガイドランを発表しました。 これらの推奨は、効率的かつ柔軟な規制監督アプローチを提供することを目的としています。技術の進歩に伴い、基準は急速に進化し、NGSのような急成長分野の適切な測定基準を設定するために使用することが可能です。 同様に、臨床的な証拠が改善されれば、新たな主張が支持される可能性がある。 この適応的なアプローチは、最終的に検査開発者間の革新を促進し、これらの新しい技術への患者のアクセスを改善するでしょう。
Clinical Databases Guidance
The final guidance “Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” is allowing developers to use data from FDA recognizedized public database of genetic variants to support a test’ clinical validity and outline of how database administrators can seek recognition for their database if they meet certain quality recommendations…(遺伝子変異データベースを用いた臨床試験の妥当性を支持するための公的ヒト遺伝子変異データベースの使用について)。 このアプローチは、データ共有のインセンティブを高め、より効率的な市場投入の道を提供します。
データベース認定に関する詳細は、FDAのRecognition of Public Human Genetic Variants Databasesウェブページで入手可能です。
分析バリデーションガイダンス
最終ガイダンス「Considerations for Design, 開発。 and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs Intended to Aid in the Diagnosis of Suspected Germline Diseases) 」では、NGS検査の設計、開発、バリデーションに対する推奨事項が提示されています。 また、このガイダンスでは、標準化団体(SDO)によるNGS関連標準の開発にコミュニティが参加することを奨励しています。なぜなら、標準は技術や知識の変化に応じてより迅速に進化することができ、したがって、NGSのような急成長分野の特定の性能閾値などの適切な測定基準の設定に使用することができるためです。
FDA’s Bioinformatics Platform
FDA は、世界中のユーザーがデータやツールを共有し、NGS 処理に対する既存および新しいバイオインフォマティクス アプローチのテスト、パイロット、検証を行う、クラウドベースのコミュニティ研究開発ポータルである precisionFDA を設立しました。 ゲノミクスコミュニティの個人および組織は、http://precision.fda.gov.
.
Questions?
.
FDAの精密医療の取り組みについて質問がある場合は、[email protected] にご連絡ください。
What FDA Officials Are Saying
- FDA finalizes guidances to accelerate the development of reliable, 次世代シーケンサーを用いた有益な検査
NGS Final Guidances
- Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 444KB)
- Considerations for Design.XXXXXX (PDF) – 4.0MB (4.0MB) Development, 疑われる生殖細胞病の診断を支援することを目的とした次世代シーケンス(NGS)ベースの体外診断用医薬品(IVD)の分析バリデーション – ステークホルダーおよび食品医薬品局スタッフのためのガイダンス(PDF -)。 869KB)
Reports and Discussion Papers
- Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests (PDF – 424KB)
- Report: Paving the Way for Personalized Medicine (Archived)
Past Meetings
- 07/27/16: Webinar – Next Generation Sequencing (NGS) Draft Guidances:
- 2016年7月27日:ウェビナー – 次世代シーケンサー(NGS)ガイダンス(案):患者および医療関係者への影響
- 2016年7月27日:ウェビナー – 次世代シーケンサー(NGS)ガイダンス(案)。 技術的および規制的側面
- 11/13/2015: 公開ワークショップ-ヒト遺伝子変異の臨床的関連性を確立するためのデータベースの使用
- 11/12/2015: 次世代シーケンサーの体外診断用検査の分析性能評価に対する標準ベースのアプローチ
- 02/20/2015: 次世代シーケンス診断検査に関するFDAの規制監視の最適化パブリックワークショップ