Clinical record
12ヶ月以内にオルニチン・トランスカルバミラーゼ欠損症の患者2名が我々の集中治療室に転入してきた. 両者とも以前は健康な男性であり、当初は軽微な処置の後に何の変哲もないが進行性の神経症状を呈した(Box 1の症例概要)
それぞれの患者は、考えられる前駆症状(いずれの場合もコルチコステロイドの単回投与)から約24~48時間後に最初の神経症状(頭痛、精神的緩慢、不協調)を呈した。 患者1では、48時間後の眠気から、支離滅裂、目のかすみ、激しい動揺へと進行し、2日後には挿管が必要となった。 患者2では、48時間後の頭痛、吐き気、目のかすみ、心窩部痛は、その後2日間で錯乱と遅い発話に進行し、翌日には昏睡を呈し、挿管が必要となった。
周辺病院への来院時に、血液検査(全血球数、腎機能検査、肝酵素値、凝固プロファイル、炎症マーカー)、腰椎穿刺、脳画像(CTおよびMRイメージング)を含む、広範囲にわたる病理検査が各患者に対して実施された。 4343>
重大な高アンモニア血症の発見は、来院後約36-48時間まで遅延した。 患者は当院に搬送されたとき、昏睡状態であった。 高アンモニア血症の原因としては、肝疾患に伴う蛋白負荷の増加や、バルプロ酸ナトリウムなどの薬剤による尿素サイクル酵素の機能障害などが挙げられるが、医師は最も一般的な原因について熟知しているはずである。 あまり一般的ではないが、血中アンモニア濃度を上昇させる重要な原因は、遺伝性の尿素サイクル異常症(UCD)である。
UCDは先天性代謝異常の一種で、推定総発生率は1:80001~1:30 0002である。 尿素生合成に関与する6つの酵素と2つの輸送タンパク質のいずれかの機能不全によって引き起こされ、その過程は主に肝臓で行われる。 尿素サイクルは、アミノ酸の異化作用によって生成されたアンモニアを処理するための末端経路である。 アンモニアは神経毒であり、血中濃度が50μmol/Lを超えて急性に上昇した場合、神経症状を引き起こす可能性がある。 100μmol/Lを超えるアンモニア濃度は黄疸を引き起こす可能性があるが、より軽度の上昇はその発生時の臨床的背景の中で解釈されるべきである。 OTC 欠損症は X 連鎖遺伝であるため、男性に多く発現するが、女性の保菌者は出産などの大きなストレスの後に減弱することがある3。 タンパク質負荷、感染症、全身性コルチコステロイド、急激な体重減少、手術、外傷、化学療法など、尿素サイクルの要求が高まる状況はすべて、UCD患者の脱水を促進させる可能性があります5。 冠動脈バイパス手術後に、これまで診断されていなかった尿素欠乏症で死亡した44歳の男性のケースは、2007年に本誌で報告された6
我々の論文で述べた2人の患者では、副腎皮質ホルモンの単回投与が最初の促進事象で、長期の空腹状態が悪循環を持続させて、重度の高アンモニア血症を引き起こした。
成人の高アンモニア血症は、頭痛、錯乱、闘争行動を伴う激越、構音障害、運動失調、幻覚、視覚障害などの精神・神経症状を呈することがあり、3毒性代謝性脳症を反映する症状である。
この2例は、早期に治療を開始しなければ、認知障害と脳浮腫が悪化し、昏睡、発作、頭蓋内圧亢進による死亡に至るという、進行性の高アンモニア血症の経過を示している。
患者の認知障害が不均衡で進行性であることの代替説明がない場合、代謝的病因の可能性を探る重要な手がかりとしてとらえる必要がある。 4343>
代謝性スクリーニングの一環として、血中アンモニア濃度の測定は、このような場合、できるだけ早い機会に実施されなければならない。 アンモニア値が高い場合は、代謝の専門家に相談し、血漿アミノ酸プロファイルを作成し、尿中有機酸とオロチン酸を測定し、高アンモニア血症の緊急治療を開始する必要がある。
尿素サイクル連動型高アンモニア血症昏睡の治療には、次の3つの要素がある。
-
血液透析または血液濾過によるアンモニアの物理的除去、
インスリン/ブドウ糖および脂質注入による異化状態の逆転、および一時的にタンパク質を保留し、利用可能になれば窒素捕捉剤を開始することである。
これらの措置は、代謝専門医の指導のもと、興奮や昏睡を管理できる集中治療室で開始されなければならない。 アンモニア濃度は、透析によって急速に低下させることができる。その除去量は流量に依存するため、ボックス2に示すように、間欠的血液透析が最も効果的なクリアランス方法である。 4343>
治療開始時の重度の神経障害は大きな懸念材料であるが、良好な神経学的回復が可能であるため、それ自体が治療を差し控える理由となるべきでない。 このことは、治療開始時に脱力姿勢であったにもかかわらず、回復した中年患者の事例報告に示されている5
我々は、原因不明の意識状態の変化がある患者、または認知障害が同時発生の全身疾患とは不釣り合いであると考えられる場合に、早期にアンモニア値を評価することを提唱している。 必要なケアの多くは、第三集中治療室以外でも開始することができる。 神経学的転帰と生存率は、介入のタイミングに決定的に左右されるため、来院時の治療開始が不可欠である。
実践のための教訓
-
尿素サイクル障害は、全身性疾患、タンパク質負荷の増加、手術または副腎皮質ホルモンなどの誘因によって、成人期に初めて現れることがあります。
-
間欠的血液透析のセッションは、迅速なアンモニアコントロールに非常に有効であり、迅速な修正には連続血液濾過より優れている。
-
高アンモニア血症の緊急処置は、破壊的神経損傷を防ぐために早期に実施されるべきである。
Box 1 – 2人の患者のケースヒストリー
Patient 1.高コレステロール血症。 24歳、男性
病歴
- 閉塞性睡眠時無呼吸症候群、目立った家族歴なし、高機能者
- 前兆がある可能性。
Progress
- 術後48時間で朦朧と嗜眠、24時間で支離滅裂に進行
- 12時間後に激しい動揺で挿管
- その後48時間でGCS5~6に低下した。 アンモニア値、334μmol/L(RR、< 50μmol/L)。 6時間後に頭蓋内圧が上昇(瞳孔散大、脳CTで脳浮腫)、前頭部血腫を合併し、減圧頭蓋切除術に至る。 避難を要する
- 長期集中治療室および入院
Outcome
- 最小意識状態の持続(22ヶ月時)
- 介護施設に退院
- 血漿および尿中の生化学分析はOTC不足に一致(尿オロチ酸高値、尿素高値、OTC欠乏症)
- 血漿および尿の生化学分析はOTC欠乏症に一致(血漿および尿の生化学分析はOTC欠乏症に一致)。 血漿中グルタミン濃度高、血漿中オルニチン、シトルリン、アルギニン濃度低)
- 遺伝子検査でOTC欠損症に関連するOTC遺伝子変異を確認
患者2さん。 39歳、男性
病歴
- 慢性膝痛、目立った家族歴なし、高機能者
- 考えられる前駆症状は。 膝痛のため膝にコルチゾン注射
Progress
- 注射後48時間で頭痛、吐き気、上腹部痛、視界不良、協調不能
- その後48時間で混乱に進行した。 言語障害
- GCS低下、挿管必要
- 痙攣活動
- 脳CT繰り返し、脳浮腫
- アンモニア濃度低下
。 652μmol/L(RR、<50μmol/L)、疾患別治療開始、頭蓋内圧モニター挿入、頭蓋内圧コントロールできず、緩和決定
Outcome
- 脳死へ進み臓器提供(肝提供を除く。 禁忌)
- OTC欠乏症と一致する生化学的所見(尿オロチン酸の高度上昇、血漿グルタミン濃度高、アルギニン濃度低)
- 遺伝子検査でOTC欠乏症に関連するOTC遺伝子変異を確認
GCS = グラスゴー昏睡点(Glasgow coma score). RR = 基準範囲; CT = コンピュータ断層撮影; OTC = オルニチン・トランスカルバミラーゼ。
ボックス 2 – 患者 2 人のアンモニア レベルと治療に対する反応*
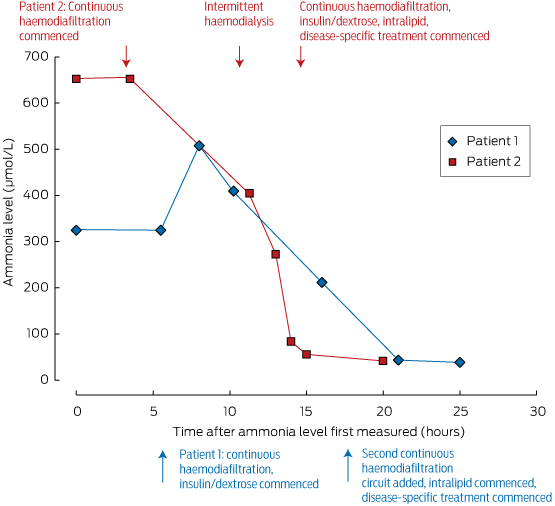
* 患者 2 の血清アンモニア レベルが、間欠血液透析開始後(最初の測定から約 10 時間)急速に低下したことに注目してください。