急性心筋梗塞(AMI)の機械的合併症は、心室中隔欠損(VSD)、乳頭筋破裂または機能不全、心臓自由壁破裂、心室瘤、動的左室(LV)流出路(OT)閉鎖、右室(RV)不全である。 これらの条件はすべて、心原性ショックを伴うLV不全につながる可能性があります。
AMIの機械的合併症とその危険因子を十分に理解することが、臨床医の早期診断につながります。 患者の良好な転帰のためには、迅速な診断と適切な薬物療法、そして適時の外科的介入が必要である。 心筋梗塞の機械的合併症による院内死亡の重要な因子として、高齢、心原性ショック、心肺機能不全が挙げられる。
心室自由壁破裂
VFWRは、AMIの最も深刻な合併症である。 VFWRは通常、大きな経皮的梗塞と先行する梗塞拡大を伴う。 死亡原因としては心室機能不全に次いで多く,AMIに伴う死亡の15~30%を占める。 VFWRは機械的合併症の中で最も致命的であることは明らかで,急性心膜血症と心タンポナーデによる死亡につながる。 この合併症の発生率は、24時間収縮期血圧のコントロールの改善、再灌流療法、βブロッカー、ACE阻害剤の使用の増加、ヘパリンの使用の減少により、年々減少している。
全米心筋梗塞登録(NRMI)のデータでは、血栓溶解療法を受けた患者の院内死亡率(12.1%)が、受けなかった患者のそれ(6.1%)よりも高くなることが示されている。 Thrombolysis in Myocardial Infarction Phase II(TIMI II)試験では、16%の患者が治療後18時間以内に心臓破裂により死亡した。 VFWRの危険因子としては、70歳以上の高齢、女性、心筋梗塞の既往なし、心電図上のQ波、STEMI初期における高血圧、コルチコステロイドまたはNSAID使用、STEMI発症後14時間以上の線溶療法、などが挙げられます。 狭心症の既往、AMIの既往、多枝冠動脈疾患、慢性心不全のある患者は、コラテラルや虚血性プレコンディショニングが発達しているので、LVのVFWRを発症する可能性は他の患者より低いと考えられます。
VFWRの臨床像
VFWRは劇的であり、急性または時に亜急性に偽動脈瘤として現れ、最も頻繁にLVの前壁または外壁を侵す。 ほとんどのVFWRはAMI後の最初の1週間以内に発生する。
BeckerらはVFWRを以下の3つのタイプに分類している。
-
Type I – 前部梗塞に多く、早期(24時間以内)に発生する突然のスリット状の裂け目
-
Type II – 前部梗塞に多く、早期に発生する突然のスリット状の裂け目 Type III -前部梗塞に多く発生する突然のスリット状の裂け目 心筋梗塞と生存心筋の境界での心筋梗塞の侵襲
-
Type III-早期に動脈瘤を形成し、梗塞が大きく拡大する
Type IIIは通常Type IやIIよりも遅く破裂する。 血栓溶解療法はBeckerのI型およびII型VFWRの心臓破裂の発生を促進する。 重症拡大梗塞(III型)では、血栓溶解療法により心破裂の発生率は低下する。
心筋破裂または穿孔を隣接する心膜と血腫が塞ぐことにより、偽動脈瘤が形成される。 仮性動脈瘤の壁面は、狭頸部によって心室腔と連通する動脈瘤性のoutpouchingとして最もよく可視化される。 この壁は心膜と組織化した血栓および/または血腫で構成されている。 真の動脈瘤が心筋壁のすべての要素を持ち、比較的広い底部を持つのに対し、心筋の要素を持たないものである。 偽動脈瘤の大きさは様々で、破裂の危険性が高い。
VFWRの臨床症状は、急性期、部位、および破裂の大きさによって異なる。 急性VFWRの患者は、激しい胸痛、突然の電気機械的解離または不全収縮、血行動態の崩壊、そしておそらく死亡を呈する。 約3分の1の患者は亜急性の経過をたどり、失神、低血圧、ショック、不整脈、長引く再発性の胸痛などの症状を呈する。
VFWRの診断
VFWRの早期診断と介入は患者の生存に不可欠である。 AMI患者が激しい胸痛、ショックまたは不整脈を呈し、電気機械的解離が突然発生した場合、高い疑い指数が必要とされる。 心電図による切迫したVFWRの徴候の特異度は低いが、洞性頻脈、心室内伝導障害、持続性または再発性のST上昇などが含まれる。 診断上の重要な所見は、切迫した心タンポナーデの臨床的および心エコー的徴候を伴う、中程度から大きめの心嚢液貯留である。 心タンポナーデと電気機械的解離を有する患者では、中等度から重度の心嚢液貯留により死亡リスクが高まる。 最初の心タンポナーデがない患者は、死亡率は低いものの、後期の破裂がまだ起こる可能性があるため、追跡調査を行う必要がある。 心エコーで心嚢液が貯留していないことは、高い陰性的中率を示す。
MRIは優れた画質を提供し、心室偽性動脈瘤(すなわち、心膜に拘束され血栓を伴う破裂したLV)の部位と構造を特定することが可能である。 しかし,MRIは時間がかかり,画像診断装置の持ち運びができないため,急性期での使用には限界がある。
VFWRの治療
最も重要な予防策は早期の再灌流療法であり,経皮的冠動脈形成術が望ましい方法である。 線溶療法はVFWRのリスクを全体的に低下させるが,STEMI発症後14時間以上経過しての使用は早期破裂のリスクを高める可能性がある。
VFWRに対する標準的な治療は,血行動態が安定した後の緊急外科手術である。
Pifarréらは、収縮期後負荷を減少させ拡張期心筋灌流を改善するために、大動脈内バルーンポンプの配備を推奨した。
いくつかの外科的手法が適用されており、梗塞切除、ポリエチレンテレフタレートポリエステル繊維(ダクロン:デュポン社、ウィルミントン、デトロイト)またはポリテトラフルオロエチレンフッ素樹脂(テフロン:デュポン)製の生体接着パッチによる接着、梗塞切除なしのプレデター縫合糸の使用、などがある。
死亡率は著しく高く、患者の術前の血行動態に大きく依存する。 早期の診断,血行動態を安定させるための上記のような措置の迅速な実施,迅速な外科的修復が生存率を向上させることができる。 無作為化試験Acornのフォローアップでは、僧帽弁手術後の左心室構造と機能の長期的な改善が、5年という長きにわたって証明された。 これらのデータは、重度の左室機能障害を有する非虚血性心不全で、医学的に最適化されているが、重大な僧帽弁閉鎖不全症の症状が残っている患者に対して、Acorn CorCapデバイスと組み合わせた僧帽弁修復術を支持するエビデンスを提供するものである。
心室中隔破裂
VSRは、まれではあるが、AMIの生命を脅かす合併症である。 最適な内科的および外科的治療にもかかわらず、VSRを有する患者は高い院内死亡率を有する。 血栓溶解療法以前の時代には,VSRは心筋梗塞患者の1~3%に発生していた。 再灌流と心筋救済が改善されたため、血栓溶解療法によりその発生率は0.2〜0.34%に減少した。 VSRの二峰性の分布は、最初の24時間に高い発生率を示し、3〜5日目に別のピークがあり、AMI後2週間以上経過するとほとんど発生しなくなることが特徴である。
血栓溶解薬を投与された患者において,AMIの症状発現から中隔破裂までの時間の中央値は,Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries (GUSTO-I) 試験では1日,Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shockでは16時間であった。 (SHOCK)試験では16時間。
中隔破裂の危険因子には,高齢(>65歳),女性,一枝疾患,広範囲の心筋梗塞,中隔側副血行不良が含まれる。 血栓溶解薬が登場する以前は,高血圧と狭心症の既往がないことがVSRのリスクファクターであった。 再灌流を行わないAMI患者では、梗塞後3〜5日以内に凝固壊死が起こる。 好中球が壊死部に移動してアポトーシスを起こし、溶菌酵素を放出し、壊死した心筋の崩壊を早める。 一部の患者では、大きな硬膜内血腫を伴う梗塞があり、これが組織内に剥離し、早期の中隔破裂に至る。 中隔破裂の大きさは数mmから数cmである。
VSRはその長さ、経過、および位置により単純型と複雑型に分類される。 単純性中隔破裂では、穿孔は中隔の両側で同じ高さにあり、中隔を横切る直接的な貫通が存在する。
中隔破裂は、LAD動脈の閉塞により広範囲の中隔梗塞を引き起こした大規模な前方MIを持つ患者で最も一般的である。 これらの梗塞は下方のリード(II、III、aVF)にST上昇とQ波を伴い、したがってこれらの心電図変化は中隔破裂でより一般的に見られる。 これらの破裂は一般に頂部で単純である。
下部MI患者における中隔破裂は比較的まれである。
VSRの臨床症状
AMIに合併したVSRの症状には胸痛、息切れ、低血圧、両心室障害、数時間から数日以内のショックが含まれる。 患者はしばしば新しく、大きく、きつい胸部雑音を呈する。 この雑音は左胸骨下縁で最も大きく、触知可能な胸骨傍収縮期熱振動を伴う。 中隔破裂に合併した心原性ショックの患者では、雑音とスリルの識別が困難な場合がある。 一方、急性心筋梗塞の患者では、しばしば心尖部の柔らかい収縮期雑音があり、スリルはない。
VSRの診断
カラーフロードップラー画像による心エコーは、VSRを特定するのに最も適した診断方法である。 (下図参照)その感度、特異度は100%と高いことが報告されています。 また、以下のような用途に使用することができます。
-
中隔破裂の部位と大きさの特定
-
LVとRVを評価する。 機能
-
RV収縮期血圧の推定
-
左-右の定量化シャント
診断を確定するには、通常、心臓カテーテル検査が必要である。 左から右へのシャントの程度を定量化し、VSRを他の状態(例:僧帽弁閉鎖不全症)と区別し、さらに冠動脈を可視化する。
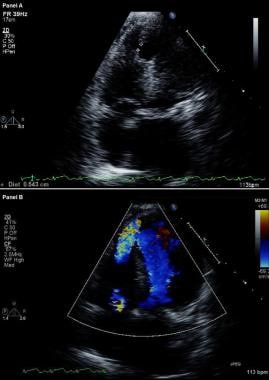 心筋梗塞の合併症。 修正2次元心エコー図(上)とカラーフロードプラ画像(下)。 最近前部心筋梗塞を発症した患者において、頂部4室像で心室間隔の破断と大きな頂部心室中隔欠損を介した心室間の自由な連通を示す。
心筋梗塞の合併症。 修正2次元心エコー図(上)とカラーフロードプラ画像(下)。 最近前部心筋梗塞を発症した患者において、頂部4室像で心室間隔の破断と大きな頂部心室中隔欠損を介した心室間の自由な連通を示す。 VSRの患者では、右心カテーテル検査で右心房からRVへの酸素飽和度のステップアップが見られるが、一方、MRの患者では酸素飽和度のステップアップは見られない。 肺動脈楔入トレースにおける大きなV波の存在は、重症急性期MRの診断を裏付けるものである。 しかし、質の良い心エコーやドップラー検査が行われれば、この検査は通常不要である。
VSRの治療
VSRの管理の鍵は、迅速な診断と血行動態の安定化、血管造影、手術への積極的な取り組みにある。 最適なアプローチは、酸素投与による血行動態の安定化、大動脈内バルーンポンプによる機械的サポート、血管拡張薬(後負荷、したがってLV圧および左-右シャントを軽減する)、利尿薬、強心薬の投与などである。
冠動脈の解剖学的構造を明らかにするために心臓カテーテル検査が必要であり、これに続いて緊急に外科的修復を行う。
外科的に修復された脳梗塞後の心室中隔破裂の連続患者52人の研究では、30日死亡率は36%(n = 19)であることがわかった。 30日以内に生存した患者のほとんどは、術前にショック状態であった。 研究者らは、心室中隔破裂の患者には、術前のショック状態の改善と積極的な冠動脈再灌流が必要であると結論づけた。
薬物療法は手術前の一時的な安定化のみを目的としており、ほとんどの患者の状態は急速に悪化し、手術の介入がない場合は死亡するためである。 GUSTO-I試験では,外科的修復を受けたVSR患者の30日死亡率は内科的治療を受けた患者より低く(47% vs 94%),1年死亡率も低かった(53% vs 97%)。 Lemeryらは、内科的治療を受けた患者の30日生存率が24%であったのに対し、外科的治療を受けた患者の30日生存率は47%であったと報告している。
米国心臓病学会(ACC/AHA)によるAMIに合併した中隔破裂患者の治療に関するガイドラインでは、臨床状態にかかわらず、緊急の外科的介入を強調しています。 中隔破裂の外科的管理には、以下の要素が含まれます。
-
低体温心肺バイパスの迅速な確立
-
術後出血、残存中隔欠損を避けるため、梗塞部からの中隔破裂へのアプローチと中隔および心室壁のすべての壊死、脆弱辺縁部の切除を行うこと。
-
人工材料を用いて中隔および心室壁を再建し、心室の幾何学的配置と心機能を維持する
中隔破裂の経皮的閉鎖は比較的新しい方法で、外科的修復に代わるものとして一部の患者に使用されており、重症患者の急性安定化のために行われているものです。
いくつかの研究では,周術期死亡率と冠動脈血行再建術(冠動脈バイパス移植術)の併用との関係を示すことができなかった。 中隔破裂による心原性ショック患者は、最も予後が悪い。 SHOCK試験では、中隔破裂による心原性ショック患者(87.3%)の院内死亡率は、他のすべての原因による心原性ショック患者(純粋なLV不全で59.2%、急性MRで55.1%)よりも高いことが明らかになった。
外科的修復を生き延びた患者において、中隔欠損の再発または残存率は約28%と報告されており、関連する死亡率は高い。
繰り返しの外科的介入は、臨床心不全または2以上の肺-全身分画を有する患者に適応される。
急性僧帽弁閉鎖不全症
MRはAMIによく見られる合併症で、局所的および全体的なLVリモデリングに起因し、心不全および死亡の独立した予測因子となる。 MRは典型的にはAMIの7~10日後に発症するが、この発症はMRのメカニズムによって異なる可能性がある。
軽度から中等度のMRは臨床的に沈黙していることが多く、AMIの初期に行われるドップラー心エコー検査で検出される。 そのような場合、MRが血行動態を悪化させることはほとんどない。
Speckle trackingと3次元心エコーは、変性僧帽弁逆流症手術後の逆LVリモデリングの評価において重要な画像手段であることが証明された。 中隔壁と側壁の拡張機能の微妙な局所的変化を術前に確認することができ、僧帽弁修復後の疾患再発の指標として、紹介時期を最適化し、潜在的な原因を認識するのに役立った。
乳頭筋や腱膜の破裂による重症急性MRでは、心源性ショックを伴う急激な血行動態の悪化が起こる。 急性重症MRは死亡率が高いため,迅速な診断,血行動態の安定化,迅速な外科的介入が必要である。
報告されているMRの発生率は,使用した診断方法,心不全の有無,報告されたMRの程度,実施した治療の種類,梗塞発症から検査までの時間などいくつかの要因によって異なる可能性がある。 心原性ショックを呈した心筋梗塞患者を対象としたSHOCK試験では,中等度から重度のMRの発生率が39.1%であったことが報告されている。 Kinnらの報告によると、血管形成術による再灌流は血栓溶解療法と比較して、急性期MRの発生率を82%減少させた(0.31% vs 1.73%)。
MRの危険因子は、高齢、女性、大きな梗塞、以前のAMI、虚血の再発、多枝冠動脈疾患、および心不全である
AMI後のMRはいくつかのメカニズムによって引き起こされる可能性がある。 乳頭筋の破裂は最もよく報告される機序である。
このような破裂はAMI患者の1%に起こり、前外側乳頭筋よりも後内側乳頭筋がよく侵されるが、これは前外側乳頭筋の血液供給が単一であるのに対し後内側乳頭筋は二重供給であるためである。 乳頭筋の破裂は心尖弁の脱落を引き起こし、重症の心筋梗塞を引き起こします。
大きな後梗塞は、非対称的な環状拡張と乳頭筋の機能および形状の変化により、急性のMRを引き起こす。 症状の重さは心室機能によって異なる。 急性重症のMRの臨床的特徴としては、息切れ、疲労、新しい頂部収縮期雑音、閃輝性肺水腫、ショックなどがある。
新しい収縮期雑音は収縮前期から中期だけで、収縮期はないこともある。 左房圧が急激に上昇し、左房と心室の間の圧力勾配が小さくなるため、慢性的なMRと比較して、雑音が小さくなるか、あるいは消失することもある。 雑音は左胸骨下縁よりも心尖部で最もよく聞こえ、スリルも伴うことはまれである。 MRの診断
血行動態が変化するため、臨床医は新しい全周性雑音に依存してMRを診断したり、その重症度を評価したりすることはできない。 胸部X線検査は、臨床的に有意な心拡大を伴わない急性期における肺水腫の証拠を示すことがある。
カラーフロードップラー画像による心エコー検査は、MRを検出するための標準的な診断手段である。 経胸壁心エコーは最初のスクリーニングとして望ましいが、経食道心エコーは、特に乳頭筋破裂の疑いが高い場合に、急性MRの重症度と正確なメカニズムを定義する上で非常に貴重である。 MRの治療
血行動態の安定性の判断、急性MRの正確なメカニズムの解明、および迅速な治療は、すべて良好な転帰のために必要である。 低血圧でない患者には、利尿薬、ニトロプルシドナトリウム、硝酸塩を用いた後負荷の軽減などの内科的管理を行う。
血行動態が悪化した患者には、大動脈内バルーン逆流を速やかに施行する必要がある。 この介入は通常、後負荷と逆流量を大幅に減少させ、外科的修復の準備として心拍出量を改善させる。
乳頭筋破裂の治療には緊急外科手術が選択される。 外科的アプローチには、僧帽弁の修復または置換が含まれる場合がある。 乳頭筋壊死がない場合、僧帽弁修復は僧帽弁置換よりも生存率を向上させる。 この違いは、弁下装置が通常温存されるからである。 僧帽弁修復術はまた、人工弁の故障に関連する合併症を排除する。
乳頭筋および/または心室自由壁の広範な壊死を有する患者では、僧帽弁置換術が好ましい方法である。 手術時に行われる冠動脈バイパス術(CABG)は、短期および長期の生存率を向上させることが1つの研究で示された。
緊急手術を安全に回避できる唯一の状況は、再発性虚血による間欠的MRの場合である。 このような患者では、心筋再灌流を成功させることが有効である。
Dynamic LVOTO
もともと肥大型心筋症にのみ存在すると考えられていたが、様々な研究者が急性前胸部MIの合併症としてdynamic LVOTOの存在を報告している。 また、dynamic LVOTOの存在は、心筋破裂の病因の一つであるとも考えられている。
遠位LAD梗塞の患者では、LVの基部および中部の代償性運動亢進により、力学的にdynamic LVOTOが生じる。 非梗塞部位の壁運動亢進の予測因子としては、多枝病変がないこと、女性であること、梗塞関連血管の流量が多いことが挙げられる。 基部心筋の収縮力の増大は、ベンチュリー効果により僧帽弁逆流を引き起こす。
このように心筋が損傷している状態でLVOTOが増加すると、収縮末期心室内圧が上昇し、弱くなった壊死した梗塞部の壁応力が増加する完璧な環境を形成する。 LVOTOの臨床症状
患者はAMIの典型的な徴候や症状に加えて、呼吸困難、発汗、冷たく湿った四肢などの自律神経症状複合体の通常の症状を示すことがある。
これらの患者は、重度の起坐呼吸、呼吸困難、乏尿を伴う心原性ショックに急速に進行し、脳低灌流による精神状態の変化が見られることがある。 僧帽弁の収縮期前方運動(SAM)による新しい収縮期駆出性雑音、腋窩に放射する新しい全収縮期雑音を呈することがある。 S3ギャロップ、肺ラ音、低血圧、頻脈がみられることもあるが、後者の身体徴候は急性期には全く認められないこともある。
経胸壁心エコーまたは経食道心エコー(TTE/TEE)は、診断に適した検査であり、運動亢進セグメント、LVOTO、僧帽弁SAMを正確に特徴づけることができる。
LVOTOの治療ベータ遮断薬を慎重に追加して心筋収縮力の過度の減少を考慮すること。 また、後負荷増強(フェニルフェリン)による緩やかな容量蘇生により、前負荷を増加させ、LVOTOやSAMを減少させることができます。 後負荷増強薬は避けた方が良いだろう。 血管拡張薬、強心薬、バルーンポンプもLVOTOを増加させるので避けるべきである。
RV failure
下部心筋梗塞でしばしば見られるように、心筋梗塞後の軽度のRV機能不全はよく見られるが、ほとんどの場合、LVへの影響は少ない。 RVは薄壁で酸素要求量が少ないため、全心周期で冠動脈灌流が行われ、広範囲の不可逆的な梗塞はまれであると推測されている
典型的なRV不全は、低血圧(LV前負荷不足による)および肺野が明確で頸静脈膨張が認められることがある。 古典的にRV不全の設定で記述されているが、この三徴は臨床の場で純粋な形で見られることはまれである。 ほとんどの患者は、自律神経症状を伴う低出力心原性ショックまたはLV不全を呈する。
8cmH2O以上の頸静脈圧とクスマウルサインの存在は、重度のRV不全に対して高い感度と特異性を有している。
時々卵円孔を介した右から左へのシャントが持続的な低酸素血症を引き起こすことがある。 心電図では、V4RリードのST上昇に連動して、下方のST上昇を呈する。 胸部X線写真では、通常、上葉静脈の膨張を認めず、淡々とした印象である。
RV不全の診断
2次元(2D)心エコーと磁気共鳴画像(MRI)は非常に有用である。
Swan-Ganzカテーテル検査の所見は通常、PCWPが低く、RA圧が高いことを示唆する。
RV不全の治療
PCWPを15mmHg程度に保つための輸液を行い、一時的にRV前負荷を増加させることが有効である。 しかし、最終的な治療には冠動脈循環を再確立することが必要である。 稀な重症RV不全例では、広範な両室病変がある場合、一時的またはブリッジ治療としてRV補助装置(AD)を用いた機械的循環補助を検討する必要がある。