Introdução: Clínica de enxaqueca
Migraina consiste em dor de cabeça unilateral acompanhada por um conjunto de outros sintomas sensoriais, autonómicos e cognitivos e foi identificada pelo estudo global da carga da doença (GBD) 2016 como a sexta doença mais prevalente e uma das principais causas de incapacidade em todo o mundo, muitas vezes ocorrendo em idade de trabalho e em mulheres jovens adultas e de meia-idade (Colaboradores, 2018). Portanto, a enxaqueca representa uma questão social muito séria em termos de anos de vida vividos com deficiência (DDI) e a causa mais importante de DDI entre 15 e 49 anos de idade (ver Steiner et al., 2018). O peso dessa doença não foi identificado até recentemente porque: a enxaqueca não é uma causa de incapacidade permanente ou morte; a dor de cabeça ocorre ocasionalmente na população em geral (Collaborators, 2018). Embora não se conheça uma patogénese definitiva para a enxaqueca, a circulação extracraniana está envolvida (Drummond e Lance, 1983). A evolução clínica da enxaqueca é articulada em diferentes fases seguintes ou concomitantes: premonitória, aura, cefaléia e pós-dromo (semelhante à fase premonitória) (Goadsby et al., 2017a). A fase premonitória inclui a irritabilidade, a ânsia por alimentos, o pescoço duro e pode ocorrer de 2 a 72 h antes do ataque e continua durante as outras fases. De acordo com as definições da Classificação Internacional dos Transtornos da Dor de Cabeça, terceira edição (ICHD-3):
– a aura é caracterizada por um ou mais défices neurológicos transitórios e reversíveis, dos quais pelo menos um tem de ter uma localização unilateral, que se desenvolvem durante 5 min ou mais e dos quais cada défice dura entre 5 e 60 min;
– a enxaqueca consiste em ataques de cefaleias com duração de 4-72 h acompanhados de náuseas, fotofobia e fonofobia, ou ambos (ver Goadsby et al., 2017a).
Alodinia cutânea, definida como a percepção de dor após estímulos não dolorosos, ocorre em mais de 70% dos pacientes (Lambru et al., 2018). A dor de cabeça severa atenua para parar durante a fase pós-dromo, enquanto outros sintomas como astenia, sonolência e fotofobia continuam afetando o paciente, mostrando assim a complexa base neural subjacente à enxaqueca (Lambru et al., 2018). Dependendo dos dias por mês afectados, a enxaqueca é classificada como episódica (menos de 15 dias de enxaqueca ou dor de cabeça) ou crónica (pelo menos 15 dias, entre os quais 8 ou mais são dias de enxaqueca) (ver Goadsby et al., 2017b). Este aspecto influencia notavelmente o impacto da doença e as opções terapêuticas (Giamberardino et al., 2017). Com 1 a 3 ataques por mês é possível usar apenas drogas sintomáticas abortivas, enquanto que se ocorrerem 4 a 14 ataques por mês é obrigatório adicionar tratamentos preventivos; estes últimos tratamentos são necessários para evitar a cronificação da doença (Giamberardino e Martelletti, 2015; Giamberardino et al, 2017) e para reduzir o risco de dor de cabeça de uso excessivo de medicamentos e enxaqueca refratária (Martelletti, 2017).
Patofisiologia da enxaqueca e do Peptídeo Relacionado ao Género Calcitonina (CGRP)
A causa exacta dos ataques de enxaqueca ainda não é bem conhecida, mas a investigação actual tem vindo a salientar a importância dos processos de sensibilização dentro do sistema trigeminovascular e de todo o tronco cerebral, bem como a observação da redução da matéria cinzenta nas áreas de processamento da dor (ver Goadsby et al., 2017a). Do gânglio trigêmeo contendo o corpo celular pseudo-unipolar primário aferentes sinapse nos vasos sanguíneos e no complexo trigeminocervical a partir do qual fibras de segunda ordem sinapse em neurônios talamocorticais de terceira ordem e em locus coeruleus, cinza periaquedular e hipotálamo (Goadsby et al., 2017a). As fibras nociceptivas do gânglio trigêmeo e dos gânglios da raiz dorsal cervical inervam os vasos da dura-máter e seus terminais liberam neuropeptídeos vasoativos como o peptídeo relacionado ao gênero calcitonina (CGRP), induzindo vasodilatação. A expressão da CGRP, CLR e RAMP1 nos vasos da dura-máter humana é mostrada nas Figuras 1A-C. De fato, as fibras nervosas autônomas vasculatura extracerebral inervante contêm várias moléculas vasoativas neurotransmissoras: noradrenalina, serotonina, acetilcolina, neuropeptídeo Y (NPY), polipeptídeo intestinal vasoativo (VIP), substância P (SP), neuroquinina A (NU), e CGRPG (Goadsby et al., 1990). Os antagonistas do receptor CGRP agem bloqueando a informação nociceptiva da dura-máter: ela é processada nos núcleos talâmicos a partir dos quais ela reage às regiões corticais mais elevadas. Estes inputs do sistema trigeminovascular são submetidos à modulação pela via descendente do tronco cerebral: os agonistas receptores de 5-hidroxitriptamina (5HT)1B/1D, ou seja, os triptanos, agem através deste sistema e contrabalançam a vasodilatação ocorrida. Enquanto propranolol e topiramato como tratamento preventivo, estes últimos medicamentos são utilizados em episódios agudos de enxaqueca. Em particular, além de sua atividade vasoconstritora, os triptanos atuando diretamente nos receptores pré-sinápticos 5HT1B/D inibem a liberação de mediadores como a CGRP envolvida na nocicepção. Além disso, foi demonstrado experimentalmente que o sumatriptano inibe a corrente interna mediada por potencial vanilóide receptor transitório 1 (TRPV1) nos gânglios do trigêmeo (Evans et al., 2012). A CGRP é liberada durante ataques de enxaqueca e exibe vários papéis como o neuropeptídeo mais vasoativo cujos níveis craniovasculares aumentam no curso do distúrbio (Goadsby et al., 1990). A CGRP tem demonstrado sofrer alterações também no líquido cefalorraquidiano (van Dongen et al., 2017). Os estímulos para alteração da excitabilidade central e os seguintes episódios de dor de enxaqueca têm sido investigados há muito tempo. A estimulação das fibras nervosas pode estimular tanto os potenciais de ação ortodrómica quanto antidrómica e, em particular, a ativação de aferentes sensoriais primários peptidérgicos duros que expressam o potencial receptor transitório (TRP) podem induzir a liberação de várias moléculas, incluindo a CGRP, que desencadeia reações inflamatórias do tecido conhecido como inflamação neurogênica (Xanthos e Sandkuhler, 2014). Em particular, a CGRPC está envolvida na nocicepção craniana e no epifenômeno da vasodilatação ligando seus receptores nos vasos sanguíneos meníngeos e cerebrais (Deen et al., 2017). Estes processos promovem a sensibilização das fibras do trigêmeo de segunda ordem levando estímulos dolorosos amplificados para regiões mais elevadas como tálamo, hipotálamo e córtex, originando assim enxaqueca (Dussor et al., 2014). Os TRPs são submetidos a ativação em resposta a vários estímulos irritantes ambientais como variações de temperatura e pH que em indivíduos predispostos podem desencadear dor de enxaqueca. A CGRP é produzida pela emenda alternativa tecidual específica do gene da calcitonina CALC I no cromossomo 11, também codificadora da calcitonina. Pelo contrário, β CGRP é produzido a partir do gene CALC II localizado em um site diferente do cromossomo 11. α O neuropeptídeo CGRP está presente no sistema nervoso central como α isoforma de 37 aminoácidos e sua transdução de sinal é mediada por dois receptores.
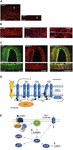
Figura 1. Ocorrência e caminho da CGRP na enxaqueca. Expressão da CGRP, CLR, e RAMP1 em vasos de dura-máter humana: (A) imunoreactividade da CGRP é encontrada em fibras finas na adventícia; (B) secções transversais e longitudinais mostrando a expressão da RAM1 no citoplasma das células musculares lisas; (C) coexpressão da CLR e da RAM1 na camada de células musculares lisas. (D) componentes do receptor CGRP e resíduos importantes para sinalização e internalização do receptor. O receptor CGRP é formado por CLR (azul), RAMP1 (amarelo), e RCP (laranja). Os resíduos funcionalmente importantes são mostrados como abreviações de uma única letra. Os resíduos de aminoácidos são numerados desde o início do peptídeo de sinal N-terminal previsto (Swiss-Prot Q16602). Vários aminoácidos dentro do terminal C da CLR (∼N400-C436) e I312 na junção ICL3/TM5 são necessários para a internalização efetiva mediada por CGRP. Características importantes do receptor CGRP, incluindo a “dobra” TM6 (P343) e a suposta oitava hélice (∼G388-W399) no CLR são ilustradas. C′, C-terminal; ECL, laço extracelular; ICL, laço intracelular; N′, N-terminal; TM, transmembrana. (E) Sinalização intracelular mediada por receptor CGRP: Gαs a sinalização aumenta a atividade AC (verde), elevando o AMPc intracelular, ativando o PKA e posteriormente muitos potenciais efetores a jusante. Painéis (A-C) são adaptados de Eftekhari et al. (2013) e painel (D,E) de Walker et al. (2010), respectivamente, com permissão.
O primeiro é conhecido como receptor de CGRP canônico e é um receptor acoplado à proteína Gαs que requer a proteína modificadora da atividade receptora (RAMP) 1 para ser funcional (Goadsby et al., 2017a). O segundo é o receptor do subtipo 1 da amilina humana (AMY1): a amilina pertence à família do gene da calcitonina e tem atividade hormonal. Quando a CGRP se liga ao seu receptor, ela é submetida à internalização dependente de dinamina/clatrina após ter sido complexada com β-arrestin (ver Walker et al., 2010). Alterações conformacionais ocorrem induzindo ativação da adenilato ciclase (AC), aumento do AMPc e ativação da proteína quinase A (PKA) que pode promover vasodilatação através da ativação direta da óxido nítrico sintase endotelial e respostas dolorosas. Este último receptor pode ser acoplado ao Gαq/11 com a ativação da fosfolipase C (PLC), à proteína quinase ativada por mitógeno (MAPK) e à liberação de NO (ver Walker et al., 2010) (ver Figuras 1D,E para representação esquemática da sinalização intracelular mediada por receptor CGRP). A administração de CGRP para enxaquecas desencadeia ataques e esta evidência apóia seu papel central na patogênese da enxaqueca (Lassen et al., 2002). Ainda não foi identificado um sistema de terminação de sinal: A CGRP é metabolizada por neprilysina, enzima de decomposição da insulina e enzima de conversão da endotelina-1 e um sistema de transporte ativo de recaptação foi hipotético (ver Russell et al., 2014). Além disso, quando o receptor é ativado transitoriamente pelo CGRP é internalizado em endossomos e rapidamente reciclado de volta à membrana celular, enquanto a estimulação crônica do receptor induz dessensibilização e degradação lisossômica (ver Russell et al, 2014).
Intervenções farmacológicas na via CGRP
Migraine é um distúrbio neurovascular incapacitante multifacetado e a terapia atual com triptanos orais é eficaz em ataques agudos, embora cerca de 40% dos pacientes sejam resistentes ao tratamento (Ferrari et al., 2001; Edvinsson, 2015). Estes seletivos agonistas 5-HT1B/1D, dos quais o mais comumente utilizado é o sumatriptan, principalmente ativo por via subcutânea, exercem sua ação terapêutica através da vasoconstrição dos vasos cranianos, e inibição do sistema trigeminal e trigeminocervical (ver Ferrari et al., 2001). Entretanto, a vasoconstrição representa um limite para os efeitos colaterais cardiovasculares desses fármacos. Além disso, o tratamento com triptanos não pode durar mais do que 9 dias por mês, devido ao risco de dor de cabeça induzida por drogas. Em 2010 a toxina botulínica tipo A (BoNT-A) foi aprovada pela Food and Drug Administration (FDA) na prevenção da enxaqueca em enxaquecas crónicas não responsivas e a sua administração complexa (requer injecção em 31 locais) limita a adesão dos pacientes. Devido ao papel central desempenhado pela CGRP na fisiopatologia da enxaqueca, foram desenvolvidos antagonistas do seu receptor. Estes fármacos pertencem à classe dos gepantes. Telgecepant, o primeiro gepante oral, resultou bem tolerado em enxaquecas afetadas por doença arterial coronária (ClinicalTrials.gov NCT00662818, Ho et al., 2012), mas apresentou hepatotoxicidade, portanto, apesar da pesquisa contínua sobre estas pequenas moléculas, foi proposta uma nova abordagem que consiste no desenvolvimento de anticorpos monoclonais (mAbs) para a CGRP (nezumabs) ou receptor CGRP (numabs). Acredita-se que estes medicamentos inibem a ação das moléculas circulantes de CGRP para prevenir ataques de enxaqueca e, como não atravessam a barreira do cérebro sanguíneo (BBB) devido ao seu tamanho, os locais de ação devem estar no sistema trigeminal (Edvinsson, 2015). Em particular, os vasos duros não estão incluídos no BBB. Além disso, a CGRP provavelmente não cruza a BBB e atua como modulador parácrino, já que é expressa por meio neurônio do gânglio trigêmeo que não apresenta o receptor CGRP, expresso pelas células gliais do satélite e os 30% do soma neuronal do gânglio trigêmeo (ver Yuan et al., 2017). Atualmente, há quatro mAbs, eptinezumab, fremanezumab, galcanezumab e erenumab estudados em ensaios clínicos para enxaqueca episódica e crônica. Os três primeiros mAbs são anticorpos humanizados direcionados à PCRG, enquanto o erenumabe é um anticorpo humano direcionado ao seu receptor canônico. A meia-vida destes medicamentos é bastante longa, não permitindo assim mais do que uma administração por mês e isto é uma questão de interesse, uma vez que os mAbs precisam ser administrados por via intravenosa ou subcutânea. Em particular, o eptinezumabe só é administrado por via intravenosa (Israel et al., 2018). O ensaio fase III PROMISE 1 (PRevention Of Migraine via Intravenous eptinezumab Safety and Efficacy 1) (ClinicalTrials.gov NCT02559895) avaliou a eficácia do Eptinezumab na prevenção de enxaquecas episódicas frequentes. Os resultados mostraram uma redução significativa no desfecho primário que consiste na diminuição dos dias mensais de enxaqueca (MMD) da linha de base média de 8,5 dias durante as semanas 1-12 a 4,3 MMD com a dose de 300 mg, 3,9 com 100 mg e 4,0 com 30 mg em relação aos 3,2 dias de placebo (Saper et al., 2018). Para a avaliação do eptinezumabe na prevenção da enxaqueca crônica, 1121 participantes foram inscritos no PROMISE 2 (ClinicalTrials.gov NCT02974153). O Galcanezumab foi avaliado quanto à eficácia na prevenção da enxaqueca episódica no estudo duplo-cego, randomizado e placebo-controlado EVOLVE-1 fase 3 (ClinicalTrials.gov NCT02614183) dissecado em 4 períodos e no estudo clínico duplo-cego, randomizado e controlado EVOLVE-2 fase 3 (ClinicalTrials.gov NCT02614196). No EVOLVE-1 ambas as doses de galcanezumab (120 e 240 mg) atingiram o resultado primário de redução significativa da enxaqueca mensal de 4,7 dias e 4,6 dias, respectivamente, em comparação com os 2,8 dias do placebo (Stauffer et al., 2018). Nos pacientes do EVOLVE-2 receberam injeção mensal de 120 ou 240 mg de galcanezumab. Os dias médios mensais de enxaqueca foram reduzidos de 4,3 e 4,2 dias, respectivamente, em comparação com os 2,3 dias de redução obtidos com placebo (p < 0,001) (Skljarevski et al., 2018). Também foram atingidos os pontos finais secundários de redução da deficiência funcional avaliada através do escore do domínio Role Function-Restrictive (R-FR) do questionário Migraine-Specific Quality of Life Questionnaire (MSQ) e a melhoria do escore do Patient Global Impression of Severity (PGI-S) e do Patient Global Disability Assessment (MIDAS; time point = mês 6) (Skljarevski et al., 2018). 147 (65,0%) e 163 (71,5%) dos pacientes tratados com galcanezumab, 120 e 240 mg, respectivamente, e 287 (62,3%) com placebo apresentaram eventos adversos, entre os quais infarto agudo do miocárdio e ataque isquêmico transitório dentro de um grupo de sete pacientes em tratamento com galcanezumab 240 mg (Skljarevski et al., 2018). Não houve diferenças estatisticamente significativas na variação média da pressão arterial sistólica/diastólica em relação à linha de base. Os 19 (8,6%), 11 (5,1%) e 2 (0,5%) pacientes nos grupos galcanezumab 120 mg, galcanezumab 240 mg e placebo, respectivamente, mostraram anticorpos antifármacos emergenciais (ADA) para o tratamento. No ensaio REGAIN fase III que avaliou o galcanezumabe contra a enxaqueca crónica, as MMD foram reduzidas de 4,8 dias com 120 mg e de 4,6 dias com dose de 240 mg em comparação com 2,7 de placebo (ver Yuan et al., 2017). Além disso, foi demonstrado que o tratamento com galcanezumab foi dotado de persistência estatisticamente significativa do efeito (Forderreuther et al., 2018). Fremanezumab foi investigado no ensaio HALO fase III para o tratamento preventivo da enxaqueca (ClinicalTrials.gov NCT02638103). Reduziu as MMDs de enxaqueca episódica a 12 semanas de 3,7 dias a 225 mg mensais durante 3 meses e de 3,4 dias a 675 mg uma vez em regime de dose trimestral quando comparado com a diminuição de 2,2 dias de placebo (ver Yuan et al., 2017). A eficácia do erenumabe na prevenção da enxaqueca episódica foi estudada na fase 3, estudo randomizado, duplo-cego e placebo controlado ARISE (ClinicalTrials.gov NCT02483585). As MMDs foram reduzidas em 70 mg de erenumab subcutânea mensal de 2,9 dias em comparação com 1,8 dias de placebo (p < 0,001) e foi eficaz nos desfechos secundários de pelo menos 50% de redução das MMDs e mudança nos dias mensais de tratamento da medicação específica para migrações (MSMD) (Dodick et al., 2018). A proporção de pacientes com eventos adversos foi semelhante entre o grupo tratado com mAb e o placebo; 4,3% testaram positivo para anticorpos anti-corpos de ligação à er er er erenumab até a semana 12, um dos quais transientemente positivo para anticorpos neutralizantes, mas apenas na semana 4 (Dodick et al., 2018). Também o ensaio clínico fase III STRIVE (ClinicalTrials.gov NCT02456740) avaliou a eficácia do erenumabe para a prevenção da enxaqueca episódica. O erenumabe foi administrado a 70 ou 140 mg mensais durante 6 meses (Goadsby et al., 2017b). O número médio basal de MMD foi 8,3 e as doses de 70 mg e 140 mg reduziram-no de 3,2 e 3,7, respectivamente, em comparação com 1,8 dias de placebo (com p < 0,001 para cada dose vs. placebo) (Goadsby et al., 2017b). Também durante os últimos 3 meses de tratamento cada dose de erenumabe cumpriu os pontos finais secundários de pelo menos 50% de redução em relação à linha de base no número médio de dias de enxaqueca por mês e redução em relação à linha de base tanto no Diário de Impacto da Função Física da Enxaqueca (MPFID-EA) nas atividades cotidianas (MPFID-EA) como no paramento físico (MPFID-PI) (Goadsby et al., 2017b). Nos doentes com anticorpos anti-reumáticos, apenas um no grupo tratado com 70 mg testou positivo para anticorpos neutralizantes e o mAb foi globalmente bem tolerado em termos de níveis de creatinina, toxicidade hepática, contagem total de neutrófilos e função electrocardiográfica (Goadsby et al., 2017b). De acordo com os autores, um dos limites deste estudo é que foram excluídos os pacientes que não haviam demonstrado resposta terapêutica a mais de duas classes de drogas preventivas de migrações (Goadsby et al., 2017b). Além disso, existem estudos clínicos que investigam a eficácia do fremanezumab (NCT02945046 e NCT02964338) e do galcanezumab (NCT 02397473 e NCT02438826) no grupo de prevenção da dor de cabeça (ver Israel et al., 2018), ou seja, dor de cabeça primária caracterizada por dor unilateral grave na área periorbital acompanhada de lacrimejamento, vermelhidão conjuntival e rinorréia (Vollesen et al., 2018). De fato, foi demonstrado que a infusão intravenosa contínua por bomba de infusão de 1,5 μg/min de CGRP por 20 min (em 2 dias separados por pelo menos 7 dias) a pacientes com cefaléia episódica (fase ativa ou de remissão) ou cefaléia crônica em cluster provocou ataques tipo cluster em pacientes em fase ativa ou com cefaléia crônica em cluster, mas não em fase de remissão (ClinicalTrials.gov NCT02466334) (Vollesen et al., 2018). As principais vantagens do PK dos mAbs são representadas pela longa semi-vida de eliminação, limitando assim a necessidade de dosagem diária e liberação por proteólise. Devido aos efeitos dos gepantes no fígado e devido às propriedades vasodilatadoras da PCRC, os riscos mais temidos da inibição da sinalização da PCRC consistem na hipótese de hepatotoxicidade e risco teórico cardiovascular (Yuan et al., 2017). A European Headache Federation (EHF) produziu diretrizes sobre o uso de mAbs anti-CGRP aplicados ao método Grading of Recommendation, Assessment, Development and Evaluation (GRADE) e, quando não possível, contando com a opinião de um painel de especialistas (Sacco et al., 2019).
Farmacocinética (PK)/Farmacodinâmica (PD) Relação de mAbs Anti-Migraine®111>
O desenvolvimento de mAbs representou uma abordagem completamente nova para inibir o caminho da CGRP. A principal melhoria da DP obtida usando mAbs em vez de pequenas moléculas é que é mais fácil visar o amplo local de ligação entre os receptores CGRP (Taylor, 2018). As principais vantagens da PK dos mAbs são representadas pela longa meia-vida de eliminação sem necessidade de dosagem diária e liberação por proteólise e os riscos mais temidos da inibição da sinalização da CGRP consistem na hipótese de hepato-toxicidade, devido aos efeitos dos gepantes no fígado, e no risco teórico cardiovascular, devido às propriedades vasodilatadoras da CGRP. Entretanto, após o percurso destes mAbs desde sua produção até o alvo, o primeiro obstáculo que estas moléculas encontram é a sua administração devido à sua escassa biodisponibilidade oral. Portanto, é necessária uma via parenteral de administração e, para favorecer a adesão ao tratamento, a meia-vida precisa ser longa (Taylor, 2018). Imunoglobulinas (Ig)G1, 2, ou 4 são as possibilidades (Wang et al., 2008; Taylor, 2018). Além da origem da IgG, eventuais reactividade cruzada e modificações individuais do catabolismo podem afectar a meia-vida (Bonilla, 2008; Taylor, 2018). A tecnologia utilizada para produzir mAbs depende do uso de hibridomas compostos de células em divisão contínua que produzem determinados clones de um único tipo de anticorpo, com pouca ou nenhuma variabilidade (Taylor, 2018). Com base na origem dos aminoácidos que compõem os mAb, é possível distinguir entre quiméricos (imunização de roedores; manutenção da região de ligação do fragmento de roedor com o antígeno Fab, mas introdução da região cristalizável de fragmento humano Fc), humanizados (zumabs, com regiões determinantes da complementaridade do rato, CDRs, enxertados em regiões Fab humanas) e humanos (introdução de toda a sequência do gene do anticorpo humano no rato que se torna humanizado, como por exemplo o XenoMouse) mAbs (ver Taylor, 2018). Os CDRs influenciam o ajuste ao alvo. Entre os 4 mAbs anti-migraine só erenumab é humano, enquanto os CDRs enxertados são de rato para fremanezumab, coelho para eptinezumab e provavelmente rato para galcanezumab (ver Taylor, 2018). Em particular, o único mAb receptor anti-CGRP é o erenumab, que é um humano IgG2λ, e os outros três mAbs dirigidos contra sítios de CGRP são: eptinezumab, um IgG1k humanizado geneticamente modificado; fremanezumab, um IgG2k humanizado; galcanezumab, um IgG4 humanizado (Edvinsson et al., 2018). Erenumab (Tmax 3-14 dias) requer administração subcutânea mensal, assim como fremanezumab (Tmax 3-20 dias) e galcanezumab (Tmax 7-14 dias) (Taylor, 2018). Pelo contrário, o eptinezumabe (Tmax 4.8 h) é administrado por via intravenosa uma vez a cada 3 meses; associa-se mais rapidamente e dissocia-se mais lentamente que o fremanezumabe e o galcanezumabe. Como os mAbs são proteínas de grande tamanho, eles não podem atravessar facilmente o BBB. Alguns receptores CGRP estão fora do BBB, permitindo assim a ação dos mAbs anti-CGRP (Edvinsson, 2018). Antes da ligação, o anticorpo entra nas células endoteliais vasculares através da pinocitose. Grandes volumes de distribuição aparente podem depender do tecido e da capacidade de ligação do mAb (Lobo et al., 2004; Taylor, 2018). Erenumab é a abordagem mais inovadora, uma vez que é a única a visar uma proteína de fusão dos domínios extracelulares dos receptores de calcitonina tipo receptor de proteína G humana CALCRL (necessária nos receptores para CGRP e adrenomedullin) e RAMP1 incluindo a bolsa de ligação CGRP (Edvinsson et al., 2018). Foi demonstrado que inibe competitivamente a ligação do -CGRP ao receptor CGRP humano em células de neuroblastoma humano (SK-N-MC) com um Ki de 0,02 ± 0,01 nM (Shi et al., 2016). Erenumab exerceu potente e pleno antagonismo do acúmulo de cAMPc estimulado por CGRP com um IC50 de 2,3 ± 0,9 nM em ensaios funcionais realizados em SK-N-MC (Shi et al., 2016). Além disso, resultou 5000 vezes mais seletivo para o receptor CGRP mostrando nenhum efeito agonista/antagonista em outros receptores da família da calcitonina humana, incluindo adrenomedulina, calcitonina e receptores de amilina até a maior concentração testada de 10 μM (Shi et al., 2016). Fremanezumab pode exercer seu efeito em diferentes vasos; na verdade, causa inibição dependente da concentração da PCRC induzida vasodilatação em artérias cerebrais, meníngeas e periféricas abdominais humanas pré-contratadas (Ohlsson et al., 2018). Além disso, a PCRC pode atuar também sobre neurônios e células gliais e sobre a glymphatic (linfática), sendo esta última implicada na expressão da aura (ver Messlinger, 2018). A provável ausência de metabolismo pelas enzimas hepáticas pode evitar as interacções medicamentosas. A eliminação ocorre através da proteólise renal de aminoácidos. Apesar dos ensaios clínicos relatarem que estes anticorpos são globalmente bem tolerados, para além da dor realçada no local da injecção, existe preocupação com a sua imunogenicidade através da produção de ADA (Taylor, 2018). Durante um ensaio clínico duplo-cego, randomizado e controlado por placebo (ClinicalTrials.gov NCT 01337596) avaliando o tratamento com diferentes regimes de doses únicas e múltiplas de galcanezumabe, 11 dos doentes tratados (26%) apresentaram baixos títulos (1:10 – 1:80) de ADA emergente do tratamento (em 3 doentes os anticorpos pré-existentes aumentaram em título), sem resposta da dose e efeitos detectados na PK e PD (Monteith et al., 2017). O estudo da imunogenicidade é essencial porque a presença de ADA pode acelerar a remoção de medicamentos ou, pior ainda, promover danos aos órgãos finais (Taylor, 2018). As principais características dos mAbs anti-migradores estão resumidas na Tabela 1.

Tabela 1. Principais características do fremanezumab, eptinezumab, galcanezumab e erenumab.
Conclusão
Migraine é uma condição neurovascular dolorosa incapacitante e debilitante, representando mais de 90% dos casos de dor de cabeça recorrente e para a qual a tendência pode ser herdada (MacGregor, 2017). Divalproex sódico, valproato de sódio, topiramato, metoprolol, propranolol e timololol têm se mostrado fortes, nível A, evidências para a prevenção da enxaqueca (American Academy of Neurology and American Headache Society, 2015). No entanto, todos os tratamentos clássicos de prevenção oral, incluindo antidepressivos tricíclicos, beta bloqueadores, antagonistas de 5-HT2 ergots e medicamentos anti-epilépticos não foram desenvolvidos para a enxaqueca e proporcionam uma redução de 50% no número de dias mensais de dor de enxaqueca apenas até 45% dos enxaquecas (D’Amico e Tepper, 2008), também por causa da baixa aderência devido à escassa tolerabilidade. A persistência e descontinuação da medicação foi examinada em uma análise retrospectiva das reivindicações dos EUA (Hepp et al., 2017) e os resultados sugerem baixa persistência ao fármaco inicial utilizado e alta quantidade de descontinuação em 6 meses, independentemente da classe do fármaco. Devido ao papel fundamental da CGRP na sustentação da neuroinflamação e sensibilização central na via de passagem do gânglio trigêmeo e tronco encefálico para regiões mais elevadas envolvidas na fisiopatologia da enxaqueca, foram desenvolvidos novos mAbs em direção à CGRP e seu receptor. As primeiras pequenas moléculas antagonistas da CGRP mostraram induzir toxicidade hepática, mas os mAbs não produziram metabólitos tóxicos ou reações laterais cardiovasculares por causa da inibição da vasodilatação (ver Deen et al., 2017). Os efeitos colaterais centrais também não foram destacados. Os potenciais efeitos a longo prazo do bloqueio da PCRC ainda precisam ser estudados, mas uma vantagem fundamental desses anticorpos deriva de sua longa meia-vida, permitindo injeções mensais ou menos freqüentes, o que pode melhorar notavelmente a aderência ao tratamento e sua eficácia posterior (Deen et al., 2017). Assim, os mAbs anti-CGRP poderiam representar ferramentas eficazes no arsenal terapêutico contra a enxaqueca não responsiva; no entanto, é obrigatória uma monitorização profunda da eficácia e segurança (ou seja, produção de metabolitos tóxicos, imunogenicidade com ADA, anticorpos neutralizantes e reactividade cruzada dos tecidos e efeitos secundários) (Taylor, 2018). De fato, evidências de produtos biotecnológicos mais antigos mostram que terapias com fator de necrose tumoral α (TNFα) mAbs podem estar sujeitas a falha secundária (em contraste com não-respondedores primários) da resposta terapêutica inicial, pois esses medicamentos induzem a produção de anticorpos que podem degradar o mAb, mas também neutralizar sua ação antes de se ligar ao alvo (ver Prado et al., 2017). A imunogenicidade pode ser influenciada pela glicosilação, tipo de mAb, número de epitopos e impurezas na formulação (ver Prado et al., 2017). Além disso, vários efeitos secundários graves aparentemente inexplicáveis estão associados à imunogenicidade da anti-TNFα. Reacções de hipersensibilidade local e sistémica, imunodeficiência com aumento da susceptibilidade a infecções e formação de complexos imunológicos que podem levar mesmo à morte foram destacados (ver Prado et al., 2017). Portanto, o uso de diagnóstico terapêutico (teranóstico) pode melhorar o conhecimento e a correta gestão destes dispositivos farmacológicos (Bendtzen, 2013; Prado et al., 2017).
Author Contributions
MTC, LAM, PT, e GB conceberam o estudo. DS coletou os resultados do estudo, analisou a literatura e escreveu o manuscrito. AA, LR, e MN participaram da pesquisa bibliográfica. Todos os autores leram e aprovaram o manuscrito final.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
American Academy of Neurology and American Headache Society (2015). Apêndice a: resumo da diretriz baseada em evidências para clínicos, atualização: tratamento farmacológico para a prevenção da enxaqueca episódica em adultos. Continuum 21, 1165-1166. doi: 10.1212/01.CON.0000470901.87438.80
PubMed Abstract | CrossRef Full Text | Google Scholar
Bendtzen, K. (2013). Medicina personalizada: teranóstico (diagnóstico terapêutico) essencial para o uso racional dos antagonistas do fator alfa da necrose tumoral. Discov. Médica. 15, 201-211.
PubMed Abstract | Google Scholar
Bonilla, F. A. (2008). Farmacocinética da imunoglobulina administrada por via intravenosa ou subcutânea. Imunol. Clínica de alergia. North Am. 28, 803-819. doi: 10.1016/j.iac.2008.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Collaborators, G. B. D. H. (2018). Global, regional, and national burden of enxaqueca and tension-type headache, 1990-2016: a systematic analysis for the global burden of disease study 2016. Lancet Neurol. 17, 954-976. doi: 10.1016/S1474-4422(18)30322-3
CrossRef Full Text | Google Scholar
D’Amico, D., and Tepper, S. J. (2008). Profilaxia da enxaqueca: princípios gerais e aceitação do paciente. Neuropsiquiatra. Dis. Treat. 4, 1155-1167.
PubMed Abstract | Google Scholar
Deen, M., Correnti, E., Kamm, K., Kelderman, T., Papetti, L., Rubio-Beltran, E., et al. (2017). Bloqueio do CGRP em pacientes com enxaqueca – uma revisão dos prós e contras. J. Headache Pain 18:96. doi: 10.1186/s10194-017-0807-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Dodick, D. W., Ashina, M., Brandes, J. L., Kudrow, D., Lanteri-Minet, M., Osipova, V., et al. (2018). ARISE: um ensaio aleatório fase 3 de erenumab para enxaqueca episódica. Cephalalgia 38, 1026-1037. doi: 10.1177/0333102418759786
PubMed Abstract | CrossRef Full Text | Google Scholar
Drummond, P. D., e Lance, J. W. (1983). Alterações vasculares extracranianas e a origem da dor de cabeça na enxaqueca. Ann. Neurol. 13, 32-37. doi: 10.1002/ana.410130108
PubMed Abstract | CrossRef Full Text | Google Scholar
Dussor, G., Yan, J., Xie, J. Y., Ossipov, M. H., Dodick, D. W., and Porreca, F. (2014). Direcionamento dos canais TRP para a nova terapêutica da enxaqueca. ACS Chem. Neurosci. 5, 1085-1096. doi: 10.1021/cn500083e
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2015). Antagonistas do receptor CGRP e anticorpos contra CGRP e seu receptor no tratamento da enxaqueca. Br. J. Clin. Farmacol. 80, 193-199. doi: 10.1111/bcp.12618
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L. (2018). A via CGRP na enxaqueca como um alvo viável para as terapias. Dor de cabeça 58(Suppl. 1), 33-47. doi: 10.1111/head.13305
PubMed Abstract | CrossRef Full Text | Google Scholar
Edvinsson, L., Haanes, K. A., Warfvinge, K., and Krause, D. N. (2018). CGRP como alvo de novas terapias de enxaqueca – tradução bem sucedida da bancada para a clínica. Nat. Rev. Neurol. 14, 338-350. doi: 10.1038/s41582-018-0003-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Eftekhari, S., Warfvinge, K., Blixt, F. W., e Edvinsson, L. (2013). Diferenciação das fibras nervosas que armazenam os receptores CGRP e CGRP no sistema trigeminovascular periférico. J. Pain 14, 1289-1303. doi: 10.1016/j.jpain.2013.03.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, M. S., Cheng, X., Jeffry, J. A., Disney, K. E., e Premkumar, L. S. (2012). Sumatriptan inibe os canais TRPV1 nos neurônios do trigêmeo. Headache 52, 773-784. doi: 10.1111/j.1526-4610.2011.02053.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferrari, M. D., Roon, K. I., Lipton, R. B., e Goadsby, P. J. (2001). Triptans orais (serotonina 5-HT(1B/1D) agonistas) no tratamento de enxaquecas agudas: uma meta-análise de 53 ensaios. Lancet 358, 1668-1675. doi: 10.1016/S0140-6736(01)06711-3
CrossRef Full Text | Google Scholar
Forderreuther, S., Zhang, Q., Stauffer, V. L., Aurora, S. K., e Lainez, M. J. A. (2018). Os efeitos preventivos do galcanezumabe em pacientes adultos com enxaqueca episódica ou crônica são persistentes: dados da fase 3, estudos aleatórios, duplo-cegos, placebo-controlados EVOLVE-1, EVOLVE-2, e REGAIN. J. Dor de cabeça 19:121. doi: 10.1186/s10194-018-0951-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., Affaitati, G., Costantini, R., Cipollone, F., e Martelletti, P. (2017). O receptor do peptídeo relacionado ao gênero calcitonina como um novo alvo para o manejo de pessoas com enxaqueca episódica: evidência atual e perfil de segurança do erenumabe. J. Pain Res. 10, 2751-2760. doi: 10.2147/JPR.S128143
PubMed Abstract | CrossRef Full Text | Google Scholar
Giamberardino, M. A., e Martelletti, P. (2015). Medicamentos emergentes para o tratamento da enxaqueca. Pareceres de especialistas. Emergentes. Drugs 20, 137-147. doi: 10.1517/14728214.2015.999040
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Edvinsson, L., e Ekman, R. (1990). Liberação de peptídeo vasoativo na circulação extracerebral de humanos durante enxaqueca. Ann. Neurol. 28, 183-187. doi: 10.1002/ana.410280213
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Holland, P. R., Martins-Oliveira, M., Hoffmann, J., Schankin, C., e Akerman, S. (2017a). Patofisiologia da enxaqueca: um transtorno do processamento sensorial. Fisiol. Rev. 97, 553-622. doi: 10.1152/physrev.00034.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Goadsby, P. J., Reuter, U., Hallstrom, Y., Broessner, G., Bonner, J. H., Zhang, F., et al. (2017b). Um ensaio controlado de erenumab para enxaqueca episódica. N. Engl. J. Med. 377, 2123-2132. doi: 10.1056/NEJMoa1705848
PubMed Abstract | CrossRef Full Text | Google Scholar
Hepp, Z., Dodick, D. W., Varon, S. F., Chia, J., Matthew, N., Gillard, P., et al. (2017b). Persistência e padrões de troca de medicamentos profiláticos para enxaqueca oral entre pacientes com enxaqueca crônica: uma análise retrospectiva das alegações. Cephalalgia 37, 470-485.
PubMed Abstract | Google Scholar
Ho, T. W., Ho, A. P., Chaitman, B. R., Johnson, C., Mathew, N. T., Kost, J., et al. (2012). Estudo randomizado e controlado do telcagepant em pacientes com enxaqueca e doença arterial coronária. Headache 52, 224-235. doi: 10.1111/j.1526-4610.2011.02052.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Israel, H., Neeb, L., e Reuter, U. (2018). Anticorpos monoclonais CGRP para o tratamento preventivo da enxaqueca. Moeda. Dor de cabeça Rep. 22:38. doi: 10.1007/s11916-018-0686-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambru, G., Andreou, A. P., Guglielmetti, M., and Martelletti, P. (2018). Medicamentos emergentes para o tratamento da enxaqueca: uma actualização. Opinião de especialistas. Emerg. Drugs 23, 301-318.
Google Scholar
Lassen, L. H., Haderslev, P. A., Jacobsen, V. B., Iversen, H. K., Sperling, B., e Olesen, J. (2002). CGRP pode ter um papel causador de enxaqueca. Cephalalgia 22, 54-61. doi: 10.1046/j.1468-2982.2002.00310.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lobo, E. D., Hansen, R. J., e Balthasar, J. P. (2004). Antibody pharmacokinetics and pharmacodynamics (Farmacocinética e farmacodinâmica). J. Pharm. Sci. 93, 2645-2668. doi: 10.1002/jps.20178
PubMed Abstract | CrossRef Full Text | Google Scholar
MacGregor, E. A. (2017). Enxaqueca. Ann. Estagiária. Med. 166, ITC49-ITC64. doi: 10.7326/AITC201704040
PubMed Abstract | CrossRef Full Text | Google Scholar
Martelletti, P. (2017). A aplicação de anticorpos monoclonais CGRP(r) no espectro da enxaqueca: necessidades e prioridades. BioDrugs 31, 483-485. doi: 10.1007/s40259-017-0251-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Messlinger, K. (2018). A grande inundação CGRP – fontes, pias e locais de sinalização no sistema trigeminovascular. J. Dor de cabeça 19:22. doi: 10.1186/s10194-018-0848-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteith, D., Collins, E. C., Vandermeulen, C., Van Hecken, A., Raddad, E., Scherer, J. C., et al. (2017). Segurança, tolerabilidade, farmacocinética e farmacodinâmica do anticorpo monoclonal de ligação CGRP LY2951742 (Galcanezumab) em voluntários saudáveis. Frente. Pharmacol. 8:740. doi: 10.3389/fphar.2017.00740
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohlsson, L., Kronvall, E., Stratton, J., e Edvinsson, L. (2018). Fremanezumab bloqueia a dilatação induzida por CGRP nas artérias cerebral, meninges médias e abdominais humanas. J. Dor de cabeça 19:66. doi: 10.1186/s10194-018-0905-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Prado, M. S., Bendtzen, K., and Andrade, L. E. C. (2017). Medicamentos biológicos anti-TNF: imunogenicidade subjacente ao fracasso do tratamento e eventos adversos. Opinião de especialistas. Medicamentos Metab. Toxicol. 13, 985-995. doi: 10.1080/17425255.2017.1360280
PubMed Abstract | CrossRef Full Text | Google Scholar
Russell, F. A., King, R., Smillie, S. J., Kodji, X., and Brain, S. D. (2014). Peptídeo relacionado ao gênero Calcitonin: fisiologia e fisiopatologia. Fisiol. Rev. 94, 1099-1142. doi: 10.1152/physrev.00034.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sacco, S., Bendtsen, L., Ashina, M., Reuter, U., Terwindt, G., Mitsikostas, D. D., et al. (2019). European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J. Dor de cabeça 20:6. doi: 10.1186/s10194-018-0955-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Saper, J., Lipton, R., Kudrow, D., Hirman, J., Dodick, D., Silberstein, S., et al. (2018). Resultados primários do ensaio PROMISE-1 (prevenção da enxaqueca por via intravenosa, segurança e eficácia do eptinezumabe-1): estudo fase 3, randomizado, duplo-cego e placebo-controlado para avaliar a eficácia e segurança do eptinezumabe na prevenção de enxaquecas episódicas frequentes (S20.001). Neurologia 90(15 Sup.), S20.001.
Google Scholar
Shi, L., Lehto, S. G., Zhu, D. X., Sun, H., Zhang, J., Smith, B. P., et al. (2016). Caracterização farmacológica do AMG 334, um potente e seletivo anticorpo monoclonal humano contra o receptor do peptídeo relacionado ao gênero calcitonina. J. Pharmacol. Exp. Ter. 356, 223-231. doi: 10.1124/jpet.115.227793
PubMed Abstract | CrossRef Full Text | Google Scholar
Skljarevski, V., Matharu, M., Millen, B. A., Ossipov, M. H., Kim, B. K., and Yang, J. Y. (2018). Eficácia e segurança do galcanezumab para a prevenção de enxaqueca episódica: resultados do ensaio clínico aleatório controlado EVOLVE-2 Fase 3. Cephalalgia 38, 1442-1454. doi: 10.1177/0333102418779543
PubMed Abstract | CrossRef Full Text | Google Scholar
Stauffer, V. L., Dodick, D. W., Zhang, Q., Carter, J. N., Ailani, J., and Conley, R. R. (2018). Avaliação de galcanezumab para a prevenção de enxaqueca episódica: o ensaio clínico aleatório EVOLVE-1. JAMA Neurol. 75, 1080-1088. doi: 10.1001/jamaneurol.2018.1212
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiner, T. J., Stovner, L. J., Vos, T., Jensen, R., e Katsarava, Z. (2018). A enxaqueca é a primeira causa de incapacidade em menos de 50 anos: será que os políticos da saúde vão agora tomar atenção? J. Dor de cabeça 19:17. doi: 10.1186/s10194-018-0846-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, F. R. (2018). CGRP, amilina, imunologia, e medicina da dor de cabeça. Dor de cabeça 59, 131-150. doi: 10.1111/head.13432
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dongen, R. M., Zielman, R., Noga, M., Dekkers, O. M., Hankemeier, T., van den Maagdenberg, A. M., et al. (2017). Biomarcadores de enxaqueca no líquido cefalorraquidiano: uma revisão sistemática e uma meta-análise. Cephalalgia 37, 49-63. doi: 10.1177/0333102415625614
PubMed Abstract | CrossRef Full Text | Google Scholar
Vollesen, A. L. H., Snoer, A., Beske, R. P., Guo, S., Hoffmann, J., J., Jensen, R. H., et al. (2018). Efeito da infusão de peptídeo relacionado ao gênero calcitonina nos ataques de cefaléia em cluster: um ensaio clínico randomizado. JAMA Neurol. 75, 1187-1197. doi: 10.1001/jamaneurol.2018.1675
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, C. S., Conner, A. C., Poyner, D. R., e Hay, D. L. (2010). Regulação da transdução de sinal por receptores de peptídeos relacionados com o gênero calcitonina. Tendências da Pharmacol. Sci. 31, 476-483. doi: 10.1016/j.tips.2010.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, E. Q., e Balthasar, J. P. (2008). Farmacocinética e farmacodinâmica de anticorpos monoclonais. Clin. Pharmacol. Ther. 84, 548-558. doi: 10.1038/clpt.2008.170
PubMed Abstract | CrossRef Full Text | Google Scholar
Xanthos, D. N., e Sandkuhler, J. (2014). Neuroinflamação neurogênica: reações inflamatórias do SNC em resposta à atividade neuronal. Nat. Rev. Neurosci. 15, 43-53. doi: 10.1038/nrn3617
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, H., Lauritsen, C. G., Kaiser, E. A., e Silberstein, S. D. (2017). CGRP anticorpos monoclonais para enxaqueca: raciocínio e progresso. BioDrugs 31, 487-501. doi: 10.1007/s40259-017-0250-5
PubMed Abstract | CrossRef Full Text | Google Scholar