Useimmat lääketieteelliset hoidot on suunniteltu ”keskivertopotilaalle” yhden koon lähestymistapana, joka saattaa onnistua joillakin potilailla mutta ei toisilla. Tarkkuuslääketiede, joka tunnetaan joskus nimellä ”yksilöllistetty lääketiede”, on innovatiivinen lähestymistapa sairauksien ennaltaehkäisyn ja hoidon räätälöintiin, jossa otetaan huomioon ihmisten geeneissä, ympäristöissä ja elämäntavoissa olevat erot. Tarkkuuslääketieteen tavoitteena on kohdentaa oikeat hoidot oikeille potilaille oikeaan aikaan.
Tarkkuuslääketieteen edistysaskeleet ovat jo johtaneet tehokkaisiin uusiin keksintöihin ja FDA:n hyväksymiin hoitomuotoihin, jotka on räätälöity yksilöiden erityispiirteiden, kuten henkilön geneettisen koostumuksen tai yksilön kasvaimen geneettisen profiilin mukaan. Erilaisia syöpiä sairastaville potilaille tehdään rutiininomaisesti molekyylitestejä osana potilaan hoitoa, minkä ansiosta lääkärit voivat valita hoitoja, jotka parantavat eloonjäämismahdollisuuksia ja vähentävät altistumista haittavaikutuksille.
- Next Generation Sequencing (NGS) Tests
- FDA:n rooli täsmälääketieteen edistämisessä
- Streamlining FDA’s Regulatory Oversight of NGS Tests
- Clinical Databases Guidance
- FDA:n bioinformatiikka-alusta
- Kysymyksiä?
- Mitä FDA:n virkamiehet sanovat
- NGS Final Guidances
- NGS Final Guidances
- Raportit ja keskusteluasiakirjat
- Pasting the Way for Personalized Medicine (Archived) Pasting the Way for Personalized Medicine (Archived) Pasting the Way for Personalized Medicine (Archived) Pasting the Way for Personalized Medicine: Implications for Patients and Providers
Next Generation Sequencing (NGS) Tests
Tarkkuuslääketieteellinen hoito on vain niin hyvää kuin testit, jotka ohjaavat diagnoosia ja hoitoa. Seuraavan sukupolven sekvensointitesteillä (NGS) voidaan nopeasti tunnistaa tai ”sekvensoida” suuria osia ihmisen genomista, ja ne ovat merkittävä edistysaskel täsmälääketieteen kliinisissä sovelluksissa.
Potilaat, lääkärit ja tutkijat voivat käyttää näitä testejä löytääkseen geneettisiä variantteja, jotka auttavat heitä diagnosoimaan, hoitamaan ja ymmärtämään paremmin ihmisen sairauksia.
FDA:n rooli täsmälääketieteen edistämisessä
FDA työskentelee varmistaakseen NGS-testien tarkkuuden, jotta potilaat ja lääkärit voivat saada täsmällisiä ja kliinisesti mielekkäitä testituloksia.
NGS-testien avulla tuotetun tiedon valtava määrä asettaa FDA:lle uudenlaisia sääntelykysymyksiä. Nykyiset sääntelyn lähestymistavat soveltuvat tavanomaisiin diagnostiikkatesteihin, jotka havaitsevat yhden sairauden tai tilan (kuten veren glukoosi- tai kolesterolipitoisuuden), mutta nämä uudet sekvensointitekniikat sisältävät miljoonia testejä vastaavan määrän testejä yhdessä. Tämän vuoksi FDA on tehnyt yhteistyötä teollisuuden, laboratorioiden, korkeakoulujen sekä potilas- ja ammattijärjestöjen sidosryhmien kanssa kehittääkseen joustavan sääntelyn, joka soveltuu tähän nopeasti kehittyvään tekniikkaan ja jossa hyödynnetään konsensusstandardeja, joukkoresurssien tuottamia tietoja ja uusinta avoimen lähdekoodin laskentatekniikkaa NGS-testien kehittämisen tukemiseksi. Tämä lähestymistapa mahdollistaa innovoinnin testauksessa ja tutkimuksessa ja nopeuttaa tarkkojen ja luotettavien geenitestien saatavuutta.
Streamlining FDA’s Regulatory Oversight of NGS Tests
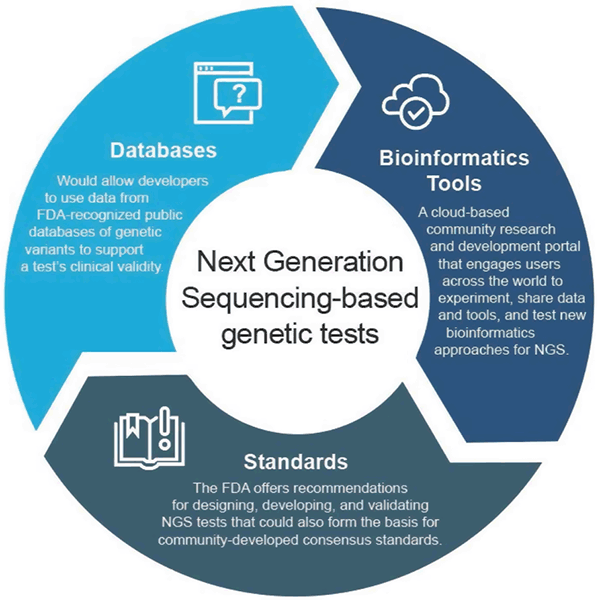
Huhtikuussa 2018 FDA julkaisi kaksi lopullista ohjetta, joissa suositellaan lähestymistapoja, joilla voidaan virtaviivaistaa NGS-pohjaisten testien kliinistä ja analyyttistä validiteettia tukevien tietojen toimittamista ja tarkistamista. Näiden suositusten tarkoituksena on tarjota tehokas ja joustava lähestymistapa viranomaisvalvontaan: teknologian kehittyessä standardit voivat kehittyä nopeasti ja niitä voidaan käyttää asianmukaisten mittareiden asettamiseen nopeasti kasvaville aloille, kuten NGS:lle. Vastaavasti kliinisen näytön parantuessa voidaan tukea uusia väitteitä. Tämä mukautuva lähestymistapa edistäisi viime kädessä innovaatioita testien kehittäjien keskuudessa ja parantaisi potilaiden mahdollisuuksia käyttää näitä uusia teknologioita.
Clinical Databases Guidance
Lopullisessa ohjeessa ”Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics” kehittäjät voivat käyttää FDA:n tunnustamista geneettisten varianttien julkisista tietokannoista saatuja tietoja testin kliinisen validiteetin tukena, ja ohjeessa selostetaan, miten tietokantojen ylläpitäjät voivat hakea tunnustusta tietokannoistaan, jos ne täyttävät tietyt laatusuositukset. Tämä lähestymistapa kannustaa tietojen jakamiseen ja tarjoaa tehokkaamman tien markkinoille.
Lisätietoa tietokantojen tunnustamisesta on saatavilla FDA:n Recognition of Public Human Genetic Variants Databases -verkkosivulta. Ohjeissa kannustetaan myös yhteisöä osallistumaan NGS:ään liittyvien standardien kehittämiseen standardeja kehittävien organisaatioiden toimesta, koska standardit voivat kehittyä nopeammin tekniikan ja tietämyksen muuttuessa, ja näin ollen niitä voidaan käyttää asianmukaisten mittareiden, kuten erityisten suorituskykykynormien, asettamiseen NGS:n kaltaisille nopeasti kasvaville aloille.
FDA:n bioinformatiikka-alusta
FDA loi precisionFDA:n, pilvipohjaisen yhteisöllisen tutkimus- ja kehitysportaalin, joka osallistaa käyttäjiä ympäri maailmaa jakamaan tietoja ja työkaluja nykyisten ja uusien bioinformatiikan lähestymistapojen testaamiseksi, pilotoimiseksi ja validoimiseksi NGS-käsittelyssä. Genomitutkimusyhteisön yksityishenkilöt ja organisaatiot voivat saada lisätietoja ja ilmoittautua mukaan osoitteessa http://precision.fda.gov.
Kysymyksiä?
Ota yhteyttä, jos sinulla on kysyttävää FDA:n täsmälääketieteen ponnisteluista osoitteessa [email protected].
Mitä FDA:n virkamiehet sanovat
- FDA viimeistelee ohjeet luotettavien, hyödyllisiä seuraavan sukupolven sekvensointiin perustuvia testejä
NGS Final Guidances
- Use of Public Human Genetic Variant Databases to Support Clinical Validity for Genetic and Genomic-Based In Vitro Diagnostics – Guidance for Stakeholders and Food and Drug Administration Staff (PDF – 444KB)
NGS Final Guidances
- Suunnittelun huomioiminen, Development, and Analytical Validation of Next Generation Sequencing (NGS) – Based In Vitro Diagnostics (IVDs) Intended to Aid in Diagnosis of Suspected Germline Diseases – Guidance for Stakeholders and Food and Drug Administration Staff (pdf – 869KB)
Raportit ja keskusteluasiakirjat
- Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests (PDF – 424KB)
- Report: Paving the Way for Personalized Medicine (Archived)