Ihmiseen kuuluvista Neisseria- ja sukulaislajeista kolme lajia – N. mucosa, M. catarrhalis ja K. denitrificans – pelkistävät nitraattia. Nitraattireduktiotesti on kriittinen testi N. gonorrhoeae:n ja K. denitrificansin erottamiseksi toisistaan, erityisesti silloin, kun K. denitrificansin kannat näyttävät värjätyissä preparaateissa gramnegatiivisilta diplokokeilta.
Periaate
Bakteerilajit voidaan erottaa toisistaan sen perusteella, kuinka hyvin ne kykenevät pelkistämään nitraattia nitriitiksi tai typpikaasuiksi. Ihmisperäisistä Neisseriaceae-suvuista Neisseria mucosa-, Moraxella catarrhalis- ja Kingella denitrificans -kannat pelkistävät nitraattia. M. catarrhalis ja K. denitrificans -kannat on tunnistettu virheellisesti N. gonorrhoeae -bakteeriksi. Nitraattireduktiotesti mahdollistaa näiden nitraattipositiivisten lajien erottamisen N. gonorrhoeae -lajista (nitraattinegatiivinen). Nitraatin pelkistyminen voi joissakin lajeissa liittyä anaerobiseen hengitykseen.
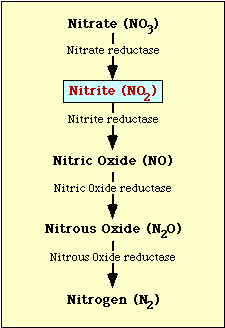
Kuvassa 1 on esitetty nitraatin pelkistymiseen liittyvä biokemiallinen reitti. Nitraatti pelkistyy nitriitiksi, joka voi sitten pelkistyä typpioksidiksi, typpioksidiksi tai typeksi (kuva 1).
Kuva l. Nitraatin pelkistymisreitti.
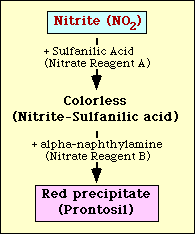
Nitraatin pelkistymistesti perustuu nitriitin havaitsemiseen elatusaineesta sen jälkeen, kun organismia on inkuboitu. Jos nitriittiä on elatusaineessa, se reagoi sulfaniilihapon (nitraattireagenssi A) kanssa muodostaen värittömän kompleksin (nitriitti-sulfaniilihappo). Tämä kompleksi tuottaa sitten punaisen saostuman (prontosil), kun testiin lisätään nitraattireagenssi B (alfa-naftyyliamiini), kuten kuvassa 2 on esitetty.
Kuvassa 2 on esitetty. Kaavamainen esitys nitriitin osoittamisesta väliaineesta.
Punainen väri syntyy väliaineeseen vain silloin, kun väliaineessa on nitriittiä. Punaisen värin puuttuminen väliaineesta sulfaniilihapon ja alfa-naftyyliamiinin lisäämisen jälkeen tarkoittaa ainoastaan sitä, että nitriittiä ei ole väliaineessa. Tälle havainnolle voi olla kaksi selitystä.
- Nitraatti ei ehkä ole pelkistynyt; kanta on nitraattinegatiivinen.
Nitraatti on saattanut pelkistyä nitriitiksi, joka on sen jälkeen pelkistynyt kokonaan typpioksidiksi, typpioksidiksi tai typeksi, joka ei reagoi nitriitin kanssa reagoivien reagenssien kanssa; kanta on nitraattipositiivinen.
Mikä tahansa testialusta, joka antaa negatiivisen tuloksen nitraattireagenssien lisäämisen jälkeen, on testattava tarkemmin sen määrittämiseksi, kumpi näistä kahdesta tulkinnasta pitää paikkansa.
Onnistunut nitraattireduktiotesti on riippuvainen siitä, että testi suoritetaan oikeissa olosuhteissa.
- Reaktio toteutuu parhaiten, jos emäksinen väliaine tukee organismin kasvua. Vaikka jotkin Neisseria-lajit eivät kasva hyvin liemialustoilla, nitraattireduktiotesti voidaan kuitenkin suorittaa onnistuneesti alustalla, joka ei tue kasvua, inokuloimalla alustaa voimakkaasti, jotta saadaan riittävästi valmiiksi muodostunutta entsyymiä reaktion tapahtumista varten.
Nitraattireaktio tapahtuu vain anaerobisissa olosuhteissa. Nitraattia sisältävä väliaine annostellaan putkiin siten, että pinta-alan ja syvyyden suhde on pieni, mikä rajoittaa hapen diffuusiota väliaineeseen, esim. 5 ml väliaine annostellaan halkaisijaltaan 13 mm:n putkeen. Neisseria ja sukulaislajit käyttävät väliaineessa olevan hapen ja tuottavat nopeasti anaerobiset olosuhteet, jotka ovat ihanteelliset nitraatin pelkistymiselle.
Nitraatin pelkistymistesti suoritetaan väliaineessa, joka sisältää 0,2 % kaliumnitraattia. Väliaineeseen inokuloidaan runsaasti epäillyn organismin puhdasta viljelmää ja sitä inkuboidaan 35 C:n ja 36,5 C:n välillä 48 tunnin ajan inkubaattorissa hiilidioksidilisällä tai ilman sitä.
Nitraatin pelkistyminen havaitaan Griessin Llosvayn reagensseilla, sulfaniilihapolla ja alfa-naftyyliamiinilla. Sulfaniilihappo (nitraattireagenssi A) lisätään inkubointiseokseen ja se muodostaa kompleksin (nitriitti-sulfaniilihappo) väliaineessa mahdollisesti olevan nitriitin kanssa. Kun inkuboituun väliaineeseen lisätään alfa-naftyyliamiinia (nitraattireagenssi B), väliaineessa mahdollisesti olevan nitriitti-sulfaniilihappokompleksin kanssa muodostuu punainen sakka (prontosil).
Organismi voidaan ilmoittaa nitraattipositiiviseksi, jos elatusaineeseen kehittyy punainen väri sen jälkeen, kun elatusaineeseen on lisätty nitraattireagenssit A ja B, mikä osoittaa, että organismi on pelkistänyt nitraatin nitriitiksi.
Punaisen värin puuttuminen molempien reagenssien lisäämisen jälkeen ei automaattisesti tarkoita, että organismi ei pysty pelkistämään nitraattia. Kannat ovat saattaneet pelkistää nitraatin nitriitiksi ja sitten pelkistää nitriitin kokonaan typpikaasuiksi, joita ei havaita, kun nitraattireagensseja A ja B lisätään väliaineeseen. Jos väliaine ei muutu väriltään sulfaniilihapon ja alfa-naftyyliamiinin lisäämisen jälkeen, inkuboituun väliaineeseen lisätään pieni määrä (”veitsenkärki”) sinkkipölyä. Sinkkipöly katalysoi nitraatin pelkistymistä nitriitiksi kemiallisesti. Jos eliöt eivät ole pelkistäneet nitraattia, eli ne ovat nitraattinegatiivisia, sinkkipöly pelkistää nitraatin ja inkuboituun väliaineeseen kehittyy punainen väri 15 minuutin kuluessa. Jos inkuboituun väliaineeseen ei synny väriä sinkkipölyn lisäämisen jälkeen, organismit eivät ole ainoastaan pelkistäneet nitraattia nitriitiksi vaan myös pelkistäneet nitriittiä typpikaasuiksi; nämä organismit ovat myös nitraattipositiivisia.
Vaikka nitraattisäiliön mukana toimitetaan käänteisiä Durham-putkia kaasuntuotannon havaitsemiseksi, kaasuntuotantoa ei kirjata ylös Neisseria-lajin osalta. Vaikka jotkin lajit saattavat pelkistää nitraattia nitriitin jälkeen typpikaasuiksi, kaasua ei välttämättä kerry putkeen. Kaasun kertyminen riippuu kaasun tuotantonopeudesta. Kun kaasua tuotetaan hyvin hitaasti, se saattaa liueta väliaineeseen eikä kerääntyä Durham-putkeen.
Näytevaatimukset
Optimaalinen näyte: Epäillyn gramnegatiivisen, oksidaasipositiivisen diplokokin (Neisseria spp. tai M. catarrhalis) puhdas viljelmä suklaa-agarilla, jota inkuboidaan hiilidioksidilla rikastetussa ilmakehässä 35 C:n ja 36,5 C:n välillä 18-24 tunnin ajan.
Ei hyväksyttävä näyte: Isolaattien viljelyt suklaa-agarilla, jota on inkuboitu hiilidioksidilla rikastetussa ilmakehässä 35 C:ssa – 36,5 C:ssa yli 24 tuntia.
Testituloksiin vaikuttavia tekijöitä:
- Testialustan inokulaation on oltava riittävän runsas, jotta reaktio valmiiksi muodostuneilla entsyymeillä voi tapahtua. Riittämätön inokulaatio ei ehkä salli organismien kuluttaa happea niin, että syntyy anaerobiset olosuhteet, joissa nitraatin pelkistyminen voi tapahtua.
Liian suuri määrä inkuboitavaan putkeen lisättyä sinkkipölyä voi johtaa siihen, että nitraatti pelkistyy nitriittiä nopeammin nitriittikaasujen ohi typpikaasuiksi niin, että nitriittiä ei havaita.
Näytteen säilyvyys:
- Testit tulisi tehdä vain 24 tunnin viljelmistä kerätystä inokulumista.
- Nitraattiväliaine on inokuloitava 30 minuutin kuluessa siitä, kun viljelmä on poistettu inkubaattorista; viljelmän pitkäaikainen altistaminen huoneenlämmössä voi johtaa entsyymiaktiivisuuden vähenemiseen.
Väliaine/reagenssit
Väliaine: Nitraattiliemi (Sydäninfuusioliemi, joka sisältää 0,2 % kaliumnitraattia)
Sydäninfuusioliemi (Difco), 25,0 g
Kaliumnitraatti, 2,0 g
Tislattu vesi, 1000,0 ml
- Luota ainekset tislattuun veteen; säädä liuoksen pH-arvo 7:ään.0.
- Jaota 5 ml:n alivuotiot liemestä 16 mm x 100 mm:n putkiin, joissa on kaasuinsertit (Durham-putket, 6 mm x 50 mm).
Autoklavoi 15 min 121 C:ssa.
Varastoi elatusaine 4 C:sta 10 C:een (jäähdytettynä), kunnes se käytetään. Lämmitä väliaine huoneenlämpöiseksi ennen inokulaatiota.
Reagenssit: Sulfaniilihappoliuos (Nitraattireagenssi A): 0,8 % 5N etikkahapossa
Kemiallinen nimi: 4-Aminobentseenisulfonihappo
Säilytä Nitraattireagenssi A 15C-30C:ssa (huoneenlämmössä) enintään 3 kuukautta pimeässä. Reagenssit voidaan säilyttää tummanruskeissa lasiastioissa; pullot voidaan kääriä alumiinifolioon pimeyden varmistamiseksi.
Alfa-naftyyliamiiniliuos (Nitraattireagenssi B): 0,6 % 5N etikkahapossa
Kemiallinen nimi: N,N-dimetyyli-1-naftyyliamiini
Varastoi nitraattireagenssi B 2C-8C:ssa (jäähdytettynä) enintään 3 kuukautta pimeässä. Reagenssit voidaan säilyttää tummanruskeissa lasiastioissa; pullot voidaan kääriä alumiinifolioon pimeyden varmistamiseksi.
Sinkkijauhe, reagenssilaatu: Säilytetään huoneenlämmössä (15C – 30C)
Varoitus: Etikkahappo on syövyttävää. Kosketus iholle voi aiheuttaa rakkuloita ja palovammoja. Kosketustapauksessa huuhtele silmät ja iho välittömästi runsaalla vedellä (vähintään 15 min. ajan)
Laadunvalvonta/Testausmenetelmä
QC-kannat:
- Nitraattireduktaasi-positiivinen kontrolli: Kingella denitrificans, CDC 10,236
- Nitraattireduktaasinegatiivinen kontrolli: Neisseria gonorrhoeae, ATCC 43069
QC-kannat säilytetään -70 C:ssa liuoksessa, joka sisältää 20 % glyserolia sisältävää tryptistä soijalientä. Kontrollikantojen reaktiot on vahvistettava pakastevarastoja valmistettaessa. QC-kannat voidaan säilyttää -70 C:ssa enintään 2 vuotta.
Menettely:
QC-kannat testataan samalla tavalla kuin kliiniset isolaatit. QC-kannat on subkulturoitava vähintään kerran alkuperäisen viljelmän jälkeen pakastetusta näytteestä ennen testin suorittamista. Kliiniset isolaatit voidaan subkulturoida valikoivasta väliaineesta tai puhdistetuista subkulteista. Varmista, että viljelmät ovat puhtaita.
- Sulata -70 C:ssa säilytettyjen kontrollikantojen injektiopullot.
- Nauhota levyt suklaa-agarille tai täydennetylle GC-agarille eristämistä varten. Inkuboidaan 35C-36,5C:ssa hiilidioksidilla rikastetussa ilmakehässä 18-24 h.
-
Valmistetaan steriilillä pyyhkäisypuikolla raskas suspensio hyvin eristetyistä pesäkkeistä isolaatin puhdasviljelmästä, jota on inkuboitu suklaa-alustalla 35C-36 C:ssa.5 C:ssa hiilidioksidilla rikastetussa ilmakehässä 18-24 h. Inokuloidaan testialusta niin, että saadaan raskas sameus.
Huomautus: N. gonorrhoeae -kannat ja jotkin muut Neisseria spp. eivät välttämättä kasva tällä alustalla. Näin ollen reaktio voi olla riippuvainen valmiiksi muodostuneesta entsyymistä.
- Inkuboidaan inokuloitua elatusainetta ja inokuloimatonta elatusainetta kontrolloivaa elatusaineputkea 35 C:n ja 36,5 C:n välillä hiilidioksidilla rikastetussa ilmakehässä 48 tunnin ajan.
-
48 tunnin inkuboinnin jälkeen lisätään kumpaankin putkeen Pasteur-pipeteillä 5 tippaa reagenssia #A ja sen jälkeen 5 tippaa reagenssia #B. Ravista putkea hyvin reagenssien sekoittamiseksi väliaineeseen.
Tutki suspensiota vaaleanpunaisen värin varalta, jonka pitäisi kehittyä muutamassa minuutissa, jos väliaine on vielä lämmin. Reaktio voi kestää hieman kauemmin, jos väliaine on kylmä reagensseja lisättäessä.
Jos suspensio muuttuu vaaleanpunaiseksi ennen Zn-jauheen lisäämistä, reaktio on positiivinen ja testi on suoritettu. Älä suorita vaihetta 4.
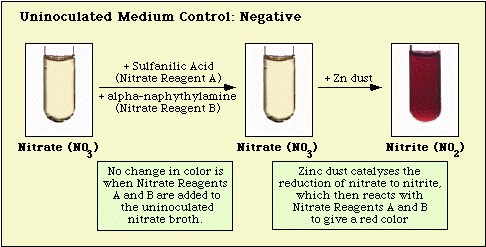
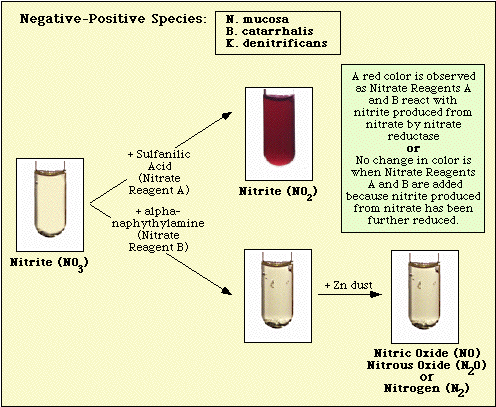
Reaktiot, jotka on havaittu inokuloimattomalla väliaineen kontrollilla ja nitraattinegatiivisilla ja nitraattipositiivisilla isolaateilla, on esitetty kuvassa 3, kuvassa 4 ja kuvassa 5.
-
Jos suspensio on väritön reagenssien A ja B lisäämisen jälkeen, lisää väliaineeseen pieni määrä (4-5 mg; ”terävän veitsen kärki”) sinkkipölyä. Ravista putkea voimakkaasti ja anna sen seistä huoneenlämmössä 10-15 minuuttia.
Jos väliaine pysyy värittömänä Zn-jauheen lisäämisen jälkeen, testitulos on positiivinen.
Jos väliaine muuttuu vaaleanpunaiseksi Zn-jauheen lisäämisen jälkeen, tulos on negatiivinen. - Lue ja kirjaa tulokset ylös.
Luku 3. Havaittu reaktio inokuloimattomalla nitraattimediumilla.
Kuva 4. Nitraattinegatiivisilla lajeilla havaittu reaktio.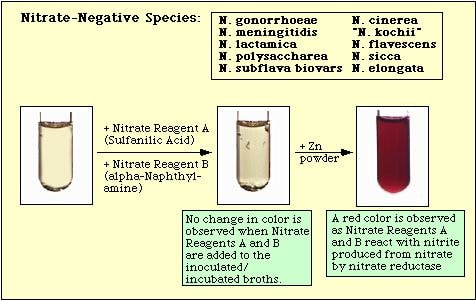
Kuva 5. Nitraattipositiivisilla lajeilla havaitut reaktiot.
Laadunvalvonta-aikataulu:
- Nitraattireduktaasin QC-testi tehdään joka päivä, kun kliinisiä isolaatteja testataan.
Ongelmat & Ratkaisut
Nitraattireduktiotesti voi antaa vääriä negatiivisia tai vääriä positiivisia tuloksia, jos väliaineita ei ole tuotettu täsmällisesti tai testiä ei ole suoritettu tarkasti. Reaktio tässä testissä on riippuvainen useista tekijöistä.
- Epäonnistuminen vaaleanpunaisen värin havaitsemisessa inokuloimattomassa väliaineen kontrolliputkessa Zn-pölyn lisäämisen jälkeen voi johtua (1) siitä, että väliaine ei sisällä nitraattia, tai (2) siitä, että väliaineeseen on lisätty liikaa sinkkipölyä, joka on katalysoinut nitraatin pelkistymistä nitriitin jälkeen typpikaasuiksi. Yksinkertaisin ratkaisu on hankkia lisää nitraattiselostetta varmistamalla, että nitraattia on lisätty perussuolaan. Vaihtoehtoisesti väliaineeseen voidaan inokuloida positiivinen kontrollikanta, mutta reaktio on testattava lyhyemmän inkubaatioajan jälkeen; N. mucosa -kannat tuottavat positiivisen nitriittireaktion muutaman tunnin inkubaation jälkeen. Jos väliaineen vahvistetaan sisältävän nitraattia, toista testi, kunnes olet määrittänyt oikean määrän lisättävää sinkkipölyä. On ratkaisevan tärkeää tietää, kuinka paljon sinkkipölyä testiin lisätään. Liian suuren sinkkipölymäärän lisääminen voi johtaa vääriin positiivisiin tuloksiin.
- Jos inokuloimattomassa elatusaineen kontrollissa havaitaan vaaleanpunainen väri sen jälkeen, kun elatusaineeseen on lisätty nitraattireagenssit A ja B, elatusaine on saastunut nitriitillä. Ainoa ratkaisu on hankkia uusi erä elatusainetta, joka ei ole nitriitillä saastunut.
- Nitraattia sisältävässä elatusaineessa positiivisen kontrollikannan, Kingella denitrificansin, epäonnistuminen positiivisen reaktion antamisessa tapahtuisi vain, jos kanta ei ole K. denitrificans. Tarkistetaan uudelleen positiivisen kontrollikannan identiteetti. Valitaan uusi viljelmä kontrollikannasta ja toistetaan testi. Vastaavasti, jos negatiivisella kontrollikannalla, N. gonorrhoeae, saadaan positiivinen nitraattireduktaasitesti, joko negatiivinen kontrollikanta ei ole N. gonorrhoeae tai viljelmä on saastunut nitraattipositiivisella organismilla. Tarkistetaan uudelleen gonokokin vertailukannan puhtaus ja identiteetti. Toista testi varmistetun N. gonorrhoeae -viljelmän puhtaalla viljelmällä.
- Nitraattireduktioreaktio osoittaa organismien kykyä pelkistää nitraattia, reaktio, joka tapahtuu vain anaerobisissa olosuhteissa; reaktiota ei tapahdu, jos organismit saavat jatkuvasti happea. Näin ollen reaktiota ei välttämättä tapahdu still-viljelmissä (erityisesti hitaasti kasvavilla lajeilla), joissa elatusaine on jaettu mataliin kerroksiin, jotka sallivat hapen diffundoitumisen elatusaineeseen. Hapen esiintyminen väliaineessa voidaan testata lisäämällä väliaineeseen tippa oksidaasireagenssia. Jos väliaine muuttuu violetiksi, väliaine sisältää happea, eikä nitraatin pelkistysreaktiota välttämättä tapahdu. Jos väliaine pysyy värittömänä, väliaine ei sisällä happea ja nitraattipelkistysreaktio voi tapahtua. On todettu, että N. gonorrhoeae -solut kuluttavat hapen nopeasti, jos väliaineeseen inokuloidaan riittävästi soluja. Jos oksidaasireagenssi lisätään noin 1-2 tunnin inkubaation jälkeen, väliaine pysyy kirkkaana. Koska oksidaasireagenssi tappaa elatusaineessa olevat gonokokit, elatusaine muuttuu vähitellen violetiksi putken yläosasta alkaen, kun happi diffundoituu elatusaineeseen. Jos väliaine annostellaan putkiin, joiden mitat poikkeavat edellä ehdotetuista, varmistetaan, että pinta-alan ja syvyyden suhde on vähintään yhtä suuri tai pienempi kuin edellä ehdotettu. Jos sen putken halkaisija, johon väliaine annostellaan, on edellä kuvattua halkaisijaltaan suurempi, käytetään suurempaa tilavuutta väliaineesta, jotta pinta-alan ja syvyyden suhde pysyy samana.
-
Nitraattipelkistysreaktiota ei välttämättä tapahdu, jos väliaine, jossa testi suoritetaan, ei salli organismin normaalia kasvua. Testi voidaan kuitenkin suorittaa väliaineessa, joka ei tue organismien kasvua, jos inokulaatio on riittävän tiheä, jotta valmiiksi muodostuneet entsyymit voivat kuluttaa olemassa olevan hapen loppuun ja pelkistää nitraattia nopeammin kuin happi diffundoituu väliaineeseen.
Huomautus: Tarkistaaksesi, että happi on poistettu väliaineesta, lisää 2-3 tippaa oksidaasireagenssia inokuloidun väliaineen kaksoiskappaleeseen. Jos happea on poistettu väliaineesta riittävästi, oksidaasireagenssi ei muutu välittömästi violetiksi. Jos väliaineessa on liuennutta happea, oksidaasireagenssi muuttuu violetiksi. Huomaa myös, että nitraatin pelkistymistesti voidaan suorittaa väliaineessa, johon oksidaasireagenssi on lisätty.
- Kun reagenssi A lisätään testialustaan, nitraatin pelkistymisen tuloksena syntyvä nitriitti muodostaa kompleksin sulfaniilihapon kanssa, joka tuottaa punaisen saostuman reagenssin B sisältämän alfa-naftyyliamiinin kanssa. Punaisen värin esiintyminen testialustassa ilmaisee, että nitriitti on läsnä nitraatin pelkistymisen tuloksena. Punaisen värin puuttuminen reagenssien A ja B lisäämisen jälkeen ei kuitenkaan välttämättä tarkoita, että nitraatti ei olisi pelkistynyt. Punaisen värin kehittymättä jääminen voi tarkoittaa, että 1) nitraatti ei ole pelkistynyt tai 2) nitraatin pelkistymisen tuloksena syntynyt nitriitti on itse pelkistynyt typpikaasuiksi. Sen määrittämiseksi, onko nitriitti pelkistynyt, laitetaan pieni määrä sinkkipölyä inkubointiseokseen, jos se on väritöntä reagenssien A ja B lisäämisen jälkeen. Sinkkipöly katalysoi nitraatin pelkistymistä nitriitiksi; punaisen värin pitäisi kehittyä väliaineeseen, joka sisältää vielä pelkistymätöntä nitraattia. On kuitenkin tärkeää, ettei sinkkipölyä lisätä liikaa; ylimääräinen sinkkipöly katalysoi tuosta nitraatista tuotetun nitriitin pelkistymistä, mikä johtaa värittömään väliaineeseen ja testin virheelliseen tulkintaan positiiviseksi (väärä positiivinen tulos).
- Positiivinen nitraattireduktaasitesti saadaan negatiivisella kontrollikannalla, N. gonorrhoeae:lla, sinkkipölyn lisäämisen jälkeen, mikä viittaa siihen, että nitraatti on pelkistetty enemmän kuin mitä on tapahtunut, luultavasti sen vuoksi, että testiin on lisätty liian paljon sinkkipölyä. Toista testi ja varmista, että sinkkipölyä lisätään hyvin vähän. Vaaleanpunainen väri, joka osoittaa, että organismi ei ole pelkistänyt nitraattia, saattaa kehittyä 10-15 minuutissa. Älä lisää sinkkipölyä! Odota, että väri kehittyy. Jos väriä ei ole kehittynyt 30 minuutissa, tulkitse testi positiiviseksi.
Testin rajoitukset
Jos testi suoritetaan oikein ja laadunvalvontakannat antavat asianmukaiset tulokset, tälle testille ei pitäisi olla rajoituksia. On huolehdittava siitä, että kaikki testin osat suoritetaan oikein.
Sukua tai lajia ei voida tunnistaa pelkän nitraattireduktiotestin perusteella.
Tulokset, tulkinta ja raportointi
Isolaatit voidaan ilmoittaa nitraattipositiivisiksi, jos inokuloidussa elatusaineessa havaitaan nitriittiä (vaaleanpunaista väriä) sen jälkeen, kun reagensseja A ja B on lisätty, tai jos elatusaineessa ei ole väriä sen jälkeen, kun siihen on lisätty sinkkipölyä.
Isolaatit voidaan ilmoittaa nitraattinegatiivisina, jos nitriittiä ei havaita (väri ei muutu) reagenssien A ja B lisäämisen jälkeen tai jos inokuloituun elatusaineeseen syntyy vaaleanpunainen väri sinkkipölyn lisäämisen jälkeen.
Kirjallisuusluettelo
Knapp JS, Clark VL. Neisseria gonorrhoeae -bakteerin anaerobinen kasvu yhdistettynä nitriitin pelkistymiseen. Infect Immun 1984;46:176-181.
Skerman VBD. 1967. p.218 – 220. Opas bakteerisukujen tunnistamiseen. The Williams & Wilkins Co., Baltimore, MD.
.