Kemiallinen kinetiikka
Kemiallinen kinetiikka
Olet ehkä perehtynyt happo-emästitrauksiin, joissa käytetään fenoliftaleiinia loppupisteindikaattorina. Et ehkä ole kuitenkaan huomannut, mitä tapahtuu, kun liuoksen, joka sisältää fenolftaleiinia ylimääräisen emäksen läsnä ollessa, annetaan seistä muutaman minuutin ajan. Vaikka liuos on aluksi vaaleanpunaisen värinen, se muuttuu vähitellen värittömäksi, kun fenolftaleiini reagoi voimakkaasti emäksisessä liuoksessa olevan OH-ionin kanssa.
Alla olevasta taulukosta käy ilmi, mitä tapahtuu fenolftaleiinin konsentraatiolle liuoksessa, joka alun perin sisälsi 0,005 M fenolftaleiinia ja 0,61 M OH-ionia. Kuten näet, kun nämä tiedot piirretään alla olevaan kuvaajaan, fenolftaleiinipitoisuus pienenee kymmenkertaisesti noin neljän minuutin aikana.
Kokeelliset tiedot fenolftaleiinin ja ylimääräisen emäksisen aineen välisestä reaktiosta
Kokeet, kuten edellä olevan taulukon tiedot antaneen kaltaiset kokeet, luokitellaan kemiallisen kinetiikan mittauksiksi (kreikankielisestä kantasanastosta, joka tarkoittaa ”liikkua”). Yksi näiden kokeiden tavoitteista on kuvata reaktionopeutta nopeutta, jolla reaktantit muuttuvat reaktiotuotteiksi.
Käsitettä nopeus käytetään usein kuvaamaan määrän muutosta, joka tapahtuu aikayksikköä kohti. Inflaationopeus on esimerkiksi vakiotavaroiden keskimääräisen hinnan muutos vuodessa. Nopeus, jolla esine kulkee avaruudessa, on matka, joka kuljetaan aikayksikköä kohti, kuten mailia tunnissa tai kilometriä sekunnissa. Kemiallisessa kinetiikassa kuljettu matka on yhden reaktiokomponentin pitoisuuden muutos. Reaktionopeus on siis yhden reagoivan aineen![]() (X)
(X)![]() pitoisuuden muutos
pitoisuuden muutos![]() t, joka tapahtuu tietyn ajanjakson
t, joka tapahtuu tietyn ajanjakson![]() t aikana.
t aikana.
![]()
Harjoitustehtävä 1:
Käytä yllä olevan taulukon tietoja laskeaksesi nopeus, jolla fenoliftaleiini reagoi OH-ionin kanssa kullakin seuraavista ajanjaksoista:
a) Ensimmäisen ajanjakson aikana, jolloin fenoliftaleiinin konsentraatio laskee 0,0050 M:sta 0,0045 M:ään.
(b) Toisen aikajakson aikana, kun konsentraatio laskee 0,0045 M:stä 0,0040 M:iin.
(c) Kolmannen aikajakson aikana, kun konsentraatio laskee 0,0040 M:stä 0,0035 M:iin.
Klikkaa tästä tarkistaaksesi vastauksesi harjoitustehtävään 1.
Klikkaa tästä nähdäksesi ratkaisun harjoitusongelmaan 1.
![]()
Reaktion hetkelliset nopeudet ja reaktion nopeuslaki
Fenolftaleiinin ja OH-ionin välisen reaktion nopeus ei ole vakio, vaan se muuttuu ajan myötä. Kuten useimmat reaktiot, tämänkin reaktion nopeus vähenee asteittain, kun reaktioaineita kuluu. Tämä tarkoittaa, että reaktionopeus muuttuu, kun sitä mitataan.
Tämän aiheuttaman virheen minimoimiseksi mittauksissamme on suositeltavaa mitata reaktionopeus ajanjaksoina, jotka ovat lyhyitä verrattuna reaktion tapahtumiseen kuluvaan aikaan. Voimme esimerkiksi yrittää mitata äärettömän pientä konsentraation muutosta![]() d(X)
d(X)![]() , joka tapahtuu äärettömän lyhyen ajanjakson aikana. Näiden määrien suhdetta kutsutaan reaktion hetkelliseksi nopeudeksi.
, joka tapahtuu äärettömän lyhyen ajanjakson aikana. Näiden määrien suhdetta kutsutaan reaktion hetkelliseksi nopeudeksi.
![]()
Reaktion hetkellinen nopeus millä tahansa hetkellä voidaan laskea reagoivan aineen (tai tuotteen) konsentraation kuvaajasta ajan suhteen. Alla olevasta kuvaajasta nähdään, miten fenoliftaleiinin hajoamisen reaktionopeus voidaan laskea konsentraation ja ajan välisestä kuvaajasta. Reaktionopeus millä tahansa ajanhetkellä on yhtä suuri kuin tähän käyrään kyseisellä hetkellä piirretyn tangentin kaltevuus.
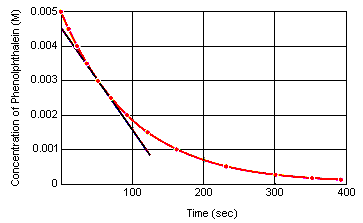
Hetkellinen reaktionopeus voidaan mitata minä tahansa ajankohtana reagoivien aineiden sekoittumishetken ja reaktion tasapainotilan saavuttamisen välisenä aikana.Ekstrapoloimalla nämä tiedot takaisin reagenssien sekoittumishetkeen saadaan reaktion alkuhetkellinen nopeus.
![]()
Nopeuslait ja nopeusvakiot
Erityisen mielenkiintoisen tuloksen saa, kun reaktion hetkellinen nopeuslaskee eri pisteissä pitkin käyrää edellisessä jaksossa esitetyssä kuvaajassa. Reaktionopeus tämän käyrän jokaisessa pisteessä on suoraan verrannollinen fenolftaleiinin konsentraatioon kyseisellä hetkellä.
Nopeus = k(fenolftaleiini)
Koska tämä yhtälö on kokeellinen laki, joka kuvaa reaktion nopeutta, sitä kutsutaan reaktion nopeuslaiksi. Suhteellisuusvakio k tunnetaan nimellä nopeusvakio.
Harjoitustehtävä 2:
Laske fenoliftaleiinin ja OH-ionin välisen reaktion nopeusvakio, jos reaktion hetkellinen nopeus on 2,5 x 10-5 moolia litrassa sekunnissa, kun fenoliftaleiinin konsentraatio on 0,0025 M.
Klikkaa tästä tarkistaaksesi vastauksesi harjoitustehtävään 2.
Klikkaa tästä nähdäksesi Harjoitustehtävän 2 ratkaisun.
Harjoitustehtävä 3:
Käytä fenoliftaleiinin ja OH-ionin välisen reaktion nopeusvakio laskeaksesi reaktion alkuhetken nopeuden edellisessä taulukossa luetelluille kokeellisille tiedoille.
Klikkaa tästä tarkistaaksesi vastauksesi harjoitustehtävään 3.
Klikkaa tästä nähdäksesi ratkaisun harjoitustehtävään 3.
![]()
Erolaisia tapoja ilmaista reaktion nopeus
Reaktion nopeuden mittaamiseen on yleensä useampi kuin yksi tapa. Voimme tutkia esimerkiksi vetyjodidin hajoamista mittaamalla nopeuden, jolla joko H2 tai I2 muodostuu seuraavassa reaktiossa, tai nopeuden, jolla HI kuluu.
2 HI(g) H2(g) + I2(g)
Kokeellisesti havaitsemme, että I2:n muodostumisnopeus on verrannollinen HI:n konsentraation neliöön millä tahansa hetkellä.
![]()
Mitä tapahtuisi, jos tutkisimme H2:n muodostumisnopeutta?Tasapainoyhtälön perusteella voidaan päätellä, että H2:n ja I2:n on muodostuttava täsmälleen samalla nopeudella.
![]()
Mitä kuitenkin tapahtuisi, jos tutkisimme HI:n kulumisnopeutta tässä reaktiossa? Koska HI kuluu, sen konsentraation muutoksen on oltava negatiivinen luku. Konvention mukaan reaktion nopeus ilmoitetaan aina positiivisena lukuna. Siksi meidän on vaihdettava etumerkki ennen kuin ilmoitamme reaktionopeuden reaktiossa kuluvan aktantin osalta.
![]()
Negatiivinen etumerkki tekee kaksi asiaa. Matemaattisesti se muuttaa HI:n konsentraation negatiivisen muutoksen positiiviseksi nopeudeksi. Fysikaalisesti se muistuttaa meitä siitä, että reagoivan aineen konsentraatio pienenee ajan myötä.
Mikä on H2:n tai I2:n muodostumista seuraamalla saadun reaktionopeuden ja HI:n häviämistä seuraamalla saadun nopeuden välinen suhde? Reaktion stoikiometrian mukaan jokaista tuotettua H2- tai I2-molekyyliä kohti kuluu kaksi HI-molekyyliä. Tämä tarkoittaa, että HI:n hajoamisnopeus on kaksi kertaa nopeampi kuin H2:n ja I2:n muodostumisnopeus. Tämä suhde voidaan muuntaa matemaattiseksi yhtälöksi seuraavasti.
![]()
Siten nopeusvakio, joka saadaan tutkimalla H2:n ja I2:n muodostumisnopeutta tässä reaktiossa (k), ei ole sama kuin nopeusvakio, joka saadaan tarkkailemalla HI:n kulumisnopeutta (k’)
Harjoitustehtävä 4:
Laskekaa HI:n häviämisnopeus seuraavassa reaktiossa hetkellä, jolloin I2:ta muodostuu 1:n nopeudella.8 x 10-6 moolia litrassa sekunnissa:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
Klikkaa tästä tarkistaaksesi vastauksesi harjoitustehtävään 4.
Klikkaa tästä nähdäksesi harjoitustehtävän 4 ratkaisun.
![]()
Nopeuslaki vs. reaktion stoikiometria
1930-luvulla Sir Christopher Ingold ja työtoverit Lontoon yliopistossa tutkivat seuraavien kaltaisten korvausreaktioiden kinetiikkaa.
CH3Br(aq) + OH-(aq)
CH3OH(aq) + Br-(aq)
He havaitsivat, että tämän reaktion nopeus on verrannollinen molempien reagoivien aineiden pitoisuuksiin.
Nopeus = k(CH3Br)(OH-)
Kun he suorittivat samanlaisen reaktion hieman erilaisella lähtöaineella, he saivat samanlaisia tuotteita.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)
Mutta nyt reaktionopeus oli verrannollinen vain yhden reagoivan aineen konsentraatioon.
Nopeus = k((CH3)3CBr)
Tulokset havainnollistavat tärkeän seikan: Alueen reaktion nopeuslakia ei voida ennustaa reaktion stoikiometrian perusteella, vaan se on määritettävä kokeellisesti. Joskus nopeuslaki on yhdenmukainen sen kanssa, mitä odotamme reaktion stoikiometrian perusteella.
2 HI(g) H2(g) + I2(g)
Nopeus = k(HI)2
Usein, se ei kuitenkaan ole.
| 2 N2O5(g) |
Nopeus = k(N2O5) |
![]()
Molekyylien mukaisessa järjestyksessä
Jotkut reaktiot tapahtuvat yksivaiheisena. Reaktio, jossa klooriatomi siirtyy ClNO2:sta NO:oon muodostaen NO2:n ja ClNO:n, on hyväesimerkki yksivaiheisesta reaktiosta.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Muut reaktiot tapahtuvat sarjana yksittäisiä vaiheita. Esimerkiksi N2O5 hajoaa NO2:ksi ja O2:ksi kolmivaiheisella mekanismilla.
| Vaihe 1: | N2O5 |
|
| Vaihe 2: | NO2 + NO3 |
|
| Vaihe 3: | NO + NO3 |
Reaktion vaiheet luokitellaan molekyylisyyden mukaan,joka kuvaa kulutettujen molekyylien määrää. Kun kuluu yksi molekyyli, vaihetta kutsutaan yksimolekyyliseksi. Kun kuluu kaksi molekyyliä, kyseessä on bimolekulaarinen vaihe.
Harjoitustehtävä 5:
Määritä kunkin reaktiovaiheen molekyylisyys reaktiossa, jossa N2O5 hajoaa NO2:ksi ja O2:ksi.
Klikkaa tästä tarkistaaksesi vastauksesi harjoitustehtävään 5.
Klikkaa tästä nähdäksesi ratkaisun harjoitustehtävään 5.
Reaktiot voidaan luokitella myös niiden järjestyksen mukaan. N2O5:n hajoaminen on ensimmäisen kertaluvun reaktio, koska reaktionopeus riippuu N2O5:n konsentraatiosta korotettuna ensimmäiseen potenssiin.
Nopeus = k(N2O5)
HI:n hajoaminen on toisen kertaluvun reaktio, koska reaktionopeus riippuu HI:n konsentraatiosta korotettuna toiseen potenssiin.
Nopeus = k(HI)2
Kun reaktion nopeus riippuu useammasta kuin yhdestä reagenssista, luokittelemme reaktion kunkin reagenssin järjestyksen mukaan.
Harjoitustehtävä 6:
Luokittele NO:n ja O2:n välisen NO2:ta muodostavan reaktion järjestys:
2 NO(g) + O2(g) ![]() 2 NO2(g)
2 NO2(g)
Aseta tälle reaktiolle seuraava nopeuslaki:
Nopeus = k(NO)2(O2)
Klikkaamalla tästä pääset tarkistaaksesi vastauksen Harjoitustehtävään 6.
Reaktion molekyylitason ja järjestyksen välinen ero on tärkeä. Reaktion tai reaktiovaiheen molekyylisyys kuvaa sitä, mitä tapahtuu molekyylitasolla. Reaktion järjestys kuvaa, mitä tapahtuu makroskooppisella tasolla. Reaktion järjestys määritetään seuraamalla, miten reaktiotuotteet ilmestyvät tai reagoivat aineet katoavat. Reaktion molekulaarisuuson jotakin, jonka päättelemme selittääksemme nämä kokeelliset tulokset.
![]()
Kemiallisten reaktioiden törmäysteoreettinen malli
Kemiallisten reaktioiden törmäysteoreettisen mallin avulla voidaan selittää havaittuja nopeuslakeja sekä yksi- että monivaiheisille reaktioille. Tässä mallissa oletetaan, että minkä tahansa reaktiovaiheen nopeus riippuu kyseiseen vaiheeseen osallistuvien hiukkasten välisten törmäysten tiheydestä.
Alla olevassa kuvassa esitetään perusta törmäysteorian mallin vaikutusten ymmärtämiselle yksinkertaisissa, yksivaiheisissa reaktioissa, kuten seuraavassa.
ClNO2(g) + NO(g) ![]() NO2(g) + ClNO(g)
NO2(g) + ClNO(g)
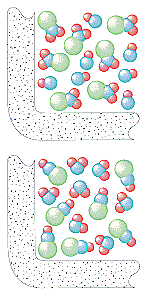
Kineettisessä molekyyliteoriassa oletetaan, että törmäysten määrä sekunnissa kaasussa riippuu hiukkasten lukumäärästä litrassa. NO2:n ja ClNO:n muodostumisnopeuden tässä reaktiossa pitäisi siis olla suoraan verrannollinen sekä ClNO2:n että NO:n pitoisuuksiin.
Nopeus = k(ClNO2)(NO)
Törmäysteorian mallissa oletetaan, että minkä tahansa reaktiovaiheen nopeus on verrannollinen kyseisessä vaiheessa kulutettujen reagenssien pitoisuuksiin. Yksivaiheisen reaktion nopeuslain pitäisi siis olla sopusoinnussa reaktion stökiometrian kanssa.
Esimerkiksi seuraava reaktio tapahtuu yksivaiheisena.
CH3Br(aq) + OH-(aq) ![]() CH3OH(aq) + Br-(aq)
CH3OH(aq) + Br-(aq)
Kun nämä molekyylit törmäävät toisiinsa oikeassa orientaatiossa, OH-ionin ei-sitoutuva elektronipari voidaan luovuttaa CH3Br-molekyylin keskellä olevalle hiiliatomille, kuten alla olevassa kuvassa näkyy.

Kun näin tapahtuu, syntyy hiili-happisidos samaan aikaan, kun hiili-bromisidos katkeaa. Tämän reaktion nettotuloksena Br -ionin tilalle muodostuuOH-ioni. Koska reaktio tapahtuu yksivaiheisena, johon liittyy kahden reagoivan aineen törmäyksiä, tämän reaktion nopeus onproportionaalinen molempien reagoivien aineiden konsentraatioon.
Nopeus = k(CH3Br)(OH-)
Eivät kaikki reaktiot tapahdu yksivaiheisina. Seuraava reaktio tapahtuu kolmessa vaiheessa, kuten alla olevassa kuvassa on esitetty.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)

Ensimmäisessä vaiheessa (CH3)3CBr-mooli dissosioituu ionipariksi.
| Ensimmäinen vaihe |  |
Positiivisesti varautunut (CH3)3C+ -ioni reagoi sitten toisessa vaiheessa veden kanssa.
| Toinen vaihe |  |
Reaktiotuote menettää sitten viimeisessä vaiheessa protonin joko OH-ionille tai vedelle.
| Kolmas vaihe |  |
Kakkos- ja kolmosvaihe tässä reaktiossa ovat hyvin paljon nopeampia kuinensimmäinen.
| (CH3)3CBr |
Hidas vaihe | ||
| (CH3)3C+ + H2O |
Nopea vaihe | ||
| (CH3)3COH2+ + OH- |
Nopea vaihe |
Kokonaisreaktionopeus on siis suurin piirtein sama kuin ensimmäisen vaiheen nopeus. Ensimmäistä vaihetta kutsutaankin tämän reaktion nopeutta rajoittavaksi vaiheeksi, koska se kirjaimellisesti rajoittaa nopeutta, jolla reaktiotuotteet voivat muodostua. Koska vain yksi reagenssi osallistuu nopeutta rajoittavaan vaiheeseen, reaktion kokonaisnopeus on verrannollinen vain tämän reagenssin konsentraatioon.
Nopeus = k((CH3)3CBr)
Tämän reaktion nopeuslaki poikkeaa siis siitä, mitä reaktion stoikiometrian perusteella voisi olettaa. Vaikka reaktiossa kuluu sekä (CH3)3CBrettä OH-, reaktion nopeus on verrannollinen vain(CH3)3CBr:n konsentraatioon.
Kemiallisten reaktioiden nopeuslait voidaan selittää seuraavillayleisillä säännöillä.
Minkä tahansa reaktiovaiheen nopeus on suoraan verrannollinen kyseisessä vaiheessa kuluvien reagenssien konsentraatioihin.
Reaktion kokonaisnopeuslaki määräytyy vaiheiden järjestyksen eli mekanismin mukaan, jonka avulla reaktantit muuttuvat reaktiotuotteiksi.
Reaktion kokonaisnopeuslakia hallitsee reaktion hitaimman reaktiovaiheen nopeuslaki.


.
