Kliiniset tiedot
Kaksi potilasta, joilla oli ornitiinitranskarbamylaasipuutos, ureasyklin häiriö, siirrettiin teho-osastollemme 12 kuukauden kuluessa. Molemmat olivat aiemmin terveitä miehiä, jotka aluksi saivat epämääräisiä mutta eteneviä neurologisia oireita pienten toimenpiteiden jälkeen (tapausten yhteenvedot laatikossa 1).
Kummallakin potilaalla ensimmäiset neurologiset oireet (päänsärky, henkinen hitaus, koordinaatiokyvyttömyys) ilmaantuivat noin 24-48 tuntia todennäköisen aiheuttajan jälkeen, joka kummassakin tapauksessa oli kortikosteroidin kerta-annos. Potilaalla 1 uneliaisuus 48 tunnin kohdalla kehittyi epäjohdonmukaisuudeksi, näön hämärtymiseksi ja vakavaksi levottomuudeksi, joka vaati intubaatiota 2 päivää myöhemmin. Potilaalla 2 päänsärky, pahoinvointi, näön hämärtyminen ja epigastrinen kipu 48 tunnin kohdalla etenivät kahden seuraavan päivän aikana sekavuudeksi ja hitaaksi puheeksi; seuraavaan päivään mennessä oli kehittynyt kooma, joka vaati intubaatiota.
Kun potilaat toimitettiin perifeeriseen sairaalaan, kummallekin potilaalle oli tehty laaja joukko patologisia tutkimuksia, mukaan lukien verikokeet (täydellinen verenkuva, munuaisten toimintakokeet, maksaentsyymiarvot, hyytymisprofiili ja tulehdusmarkkerit), lumbaalipunktio ja aivojen kuvantaminen (tietokonetomografia ja magneettikuvaus). Näiden tutkimusten tulokset olivat kaikki merkitsemättömiä.
Merkittävän hyperammonaemian toteaminen viivästyi noin 36-48 tuntia sairaalaan tulon jälkeen. Potilaat olivat koomassa, kun heidät siirrettiin sairaalaan. Potilas 1 oli pitkään tehohoitoyksikössämme, ja hänen tajuntansa oli pysyvästi minimaalisessa tilassa; potilas 2 eteni aivokuolemaan ja elinluovutukseen.
Lääkärit tuntevat hyperammonaemian tavallisimmat syyt, mukaan lukien maksasairauteen liittyvä lisääntynyt proteiinikuormitus ja lääkkeiden, kuten natriumvalproaatin, aiheuttama ureakierron entsyymihäiriö. Harvinaisempia mutta tärkeitä syitä veren kohonneisiin ammoniakkipitoisuuksiin ovat perinnölliset ureasyklin häiriöt (UCD). Vaikeimmat muodot ilmenevät varhaislapsuudessa, mutta näiden häiriöiden lievemmät muodot voivat ilmetä aikuisiässä.
UCD:t ovat synnynnäisten aineenvaihduntavirheiden ryhmä, jonka arvioitu kokonaisesiintyvyys on 1:80001-1:30 0002 syntymää. Ne johtuvat jonkin kuuden entsyymin tai kahden kuljetusproteiinin toimintahäiriöstä, jotka osallistuvat urean biosynteesiin, joka tapahtuu pääasiassa maksassa. Urea-sykli on aminohappokatabolian aikana muodostuvan ammoniakin loppusijoitusreitti. Ammoniakki on neurotoksinen, ja veren akuutti pitoisuuden nousu yli 50 μmol/l voi aiheuttaa neurologisia oireita. Vaikka ammoniakkipitoisuudet, jotka ylittävät 100 μmol/l, voivat aiheuttaa obtundaatiota, lievemmät kohoamiset on tulkittava esiintymisensä kliinisessä kontekstissa.
Kahdella potilaallamme esiintynyt UCD oli ornitiinitranskarbamylaasin (OTC) puutos, joka on yleisin ureasyklin häiriöistä. OTC:n puutos on X-sidonnainen ominaisuus, ja siksi se ilmenee yleisimmin miehillä, vaikka naispuoliset kantajat voivat dekompensoitua merkittävän stressin, kuten synnytyksen, jälkeen.3 Muut UCD:t ovat autosomaalisesti resessiivisiä ominaisuuksia.4
Ensimmäinen ilmaantuminen aikuisiässä voi johtua puutoksen lievemmästä asteesta ja usein myös proteiinin saannin rajoittamisesta itsestään opittuna käyttäytymismallina, joka mahdollistaa stabiiliuden siihen asti, kunnes ympäristöstä aiheutuva stressitekijä iskee. Tilanteet, jotka johtavat ureakierron lisääntyneisiin vaatimuksiin, kuten proteiinikuormitus, infektiot, systeemiset kortikosteroidit, nopea laihtuminen, leikkaus, trauma ja kemoterapia5 , voivat kaikki nopeuttaa dekompensaatiota henkilöillä, joilla on UCD. Tässä lehdessä kerrottiin vuonna 2007 tapauksesta, jossa 44-vuotias mies kuoli aiemmin diagnosoimattomaan OTC-puutokseen sepelvaltimoiden ohitusleikkauksen jälkeen.6
Kahdella artikkelissamme kuvatulla potilaalla yksittäinen, mutta merkittävä kortikosteroidiannos oli alkusysäyksenä, ja pitkittynyt paastoaminen jatkoi metabolista kierrettä, joka huipentui vaikeaan hyperammonemiaan.
Aikuisten hyperammonaemiassa voi esiintyä psykiatrisia tai neurologisia oireita, kuten päänsärkyä, sekavuutta, kiihtyneisyyttä ja taistelutahtoista käyttäytymistä, dysartriaa, ataksiaa, hallusinaatioita ja näön heikkenemistä,3 jotka kuvastavat toksista metabolista enkefalopatiaa. Hermostoilmiöihin voi liittyä vatsaoireita (pahoinvointi, oksentelu).
Kahden tapauksemme avulla voidaan havainnollistaa etenevän hyperammonaemian kulkua, jos hoitoa ei aloiteta ajoissa: kognitiivinen heikentyminen ja aivo-ödeema pahenevat ja kehittyvät kooma, kouristuskohtaukset ja kuolema kallonsisäisen verenpaineen vuoksi.
Kun potilaan kognitiivisen häiriön suhteettomalle ja etenevälle luonteelle ei ole vaihtoehtoista selitystä, tämä olisi otettava tärkeäksi merkiksi metabolisen etiologian mahdollisuuden tutkimiseksi. Koska heikkeneminen tapahtuu päivien kuluessa, on mahdollista ryhtyä hengenpelastaviin toimenpiteisiin, jos tila tunnistetaan ajoissa.
Veren ammoniakkipitoisuuden mittaaminen osana metabolista seulontaa olisi tällaisessa tapauksessa suoritettava mahdollisimman varhaisessa vaiheessa. Jos ammoniakkipitoisuus on koholla, on konsultoitava aineenvaihdunnan erikoislääkäriä, laadittava plasman aminohappoprofiili, mitattava virtsan orgaaniset hapot ja oroottihappo sekä aloitettava hyperammonaemian kiireellinen hoito.
Ureakiertoon liittyvän hyperammoneemisen kooman hoidon kolme osatekijää ovat:
-
ammoniakin fyysinen poisto hemodialyysillä tai hemodiafiltraatiolla;
-
katabolisen tilan kääntäminen insuliini/dekstroosi ja intralipidi-infuusioilla; ja
-
proteiinien tilapäinen pidättäminen ja typenpoistaja-aineiden käytön aloittaminen heti, kun niitä on saatavilla.
Nämä toimenpiteet on aloitettava aineenvaihduntalääkärin ohjauksessa ja tehohoitoyksikössä, jossa levottomuutta tai koomaa voidaan hallita. Ammoniakkipitoisuuksia voidaan alentaa nopeasti dialyysillä; sen poisto on riippuvainen virtausnopeudesta, joten intermittoiva hemodialyysi on tehokkain puhdistusmenetelmä, kuten laatikossa 2 on esitetty. Tästä syystä suosittelemme pikemminkin jaksottaista dialyysiä kuin jatkuvaa laskimoperäistä hemodiafiltraatiota ammoniakin hallitsemiseksi varhaisessa vaiheessa hätätilanteessa.
Vaikka vakava neurologinen heikkeneminen hoidon alkaessa on suuri huolenaihe, se ei sinänsä saisi olla peruste hoidon keskeyttämiselle, sillä hyvä neurologinen toipuminen on mahdollista. Tästä on osoituksena tapauskertomus keski-ikäisestä potilaasta, joka toipui, vaikka hoito aloitettiin dekortikaattiasennosta huolimatta.5
Kannatamme ammoniakkipitoisuuksien varhaista arviointia potilailla, joilla on selittämätön tajunnantilan muutos tai kun heidän kognitiivinen häiriönsä vaikuttaa suhteettomalta suhteessa samanaikaiseen systeemiseen sairauteen. Monet tarvittavista hoitotoimenpiteistä voidaan aloittaa muissa kuin tertiäärisissä tehohoitoyksiköissä. Hoidon aloittaminen sairaalassa, jossa potilas saapuu sairaalaan, on olennaisen tärkeää, koska kyseessä on lääketieteellinen hätätilanne; neurologinen lopputulos ja eloonjääminen riippuvat ratkaisevasti toimenpiteen ajoituksesta. Jos sairaus tunnistetaan varhain ja sitä hoidetaan asianmukaisesti, neurologisen toipumisen ennuste on hyvä.
Oppia käytäntöön
-
Urea-syklin häiriöt voivat ilmaantua ensimmäisen kerran aikuisiässä, ja ne voivat paljastua esimerkiksi systeemisen sairauden, lisääntyneen proteiinikuormituksen, leikkauksen tai kortikosteroidien kaltaisten laukaisevien tekijöiden vuoksi.
-
Ammoniakkiarvojen arviointi on yksinkertainen mutta kriittisen tärkeä koe potilailla, joilla on selittämätön tajunnan häiriö.
-
Pätkittäinen hemodialyysijakso on erittäin tehokas ammoniakin nopeaan hallintaan, ja se on parempi kuin jatkuva hemodiafiltraatio nopeaan korjaukseen.
-
Hyperammonaemian hätähoitoon on ryhdyttävä varhaisessa vaiheessa, jotta voidaan ehkäistä tuhoisa neurologinen vamma.
Laatikko 1 – Kahden potilaan sairauskertomukset
Potilas 1: 24-vuotias, mies
Sairaushistoria
- Ostobstruktiivinen uniapnea; ei merkittävää sukuhistoriaa; korkeasti toimintakykyinen yksilö
- Todennäköinen saostava tekijä: Intraoperatiivinen deksametasoni (8 mg) nenän septoplastian aikana
Kehitys
- Hämmennystä ja letargiaa 48 h leikkauksen jälkeen, joka eteni 24 h kuluessa epäjohdonmukaiseksi
- Intuboitiin 12 h myöhemmin vakavan levottomuuden vuoksi
- GCS laski 5-6:een seuraavan 48 h aikana; ammoniakkipitoisuus 334 μmol/l (RR, < 50 μmol/l); tautikohtainen hoito aloitettiin
- Kallonsisäiset paineet nousivat 6 h myöhemmin (laajentuneet pupillit ja aivojen CT-kuva aivojen turvotuksesta), mikä johti dekompressiiviseen kraniektomiaan, johon liittyi frontaalinen hematooma, vaati evakuointia
- Pitkittynyt teho-osasto- ja sairaalajakso
Tulos
- Pysyvä minimaalisesti tajuissaan oleva tila (22 kk:n iässä)
- Kotiutettiin hoitolaitokseen
- Biokemiallinen analyysi veriplasmasta ja virtsasta, jotka sopusoinnussa OVT:n puutteen kanssa (kohonnut virtsan oroottihappo; plasman glutamiinipitoisuus korkea; plasman ornitiini-, sitrulliini- ja arginiinipitoisuudet alhaiset)
- Geneettinen testaus vahvisti OTC-geenin mutaation, joka liittyy OTC-puutokseen
Potilas 2: 39-vuotias, mies
Sairaushistoria
- Krooninen polvikipu; ei mainittavaa sukuhistoriaa; korkeasti toimintakykyinen yksilö
- Todennäköinen saostava tekijä: Kortisonipistos polveen polvikivun vuoksi
Kehitys
- Päänsärky, pahoinvointi, epigastrinen kipu, näön hämärtyminen ja koordinaatiokyvyttömyys 48 h injektion antamisen jälkeen
- Edistyi seuraavien 48 h aikana sekavuudeksi, hidastunut puhe
- GCS:n asteittainen lasku, joka vaati intubaatiota
- Kouristeluaktiivisuus
- Kerta-CT aivoista osoitti aivojen turvotusta
- Ammoniakkitaso: 652 μmol/L (RR, < 50 μmol/L); tautikohtainen hoito aloitettu; kallonsisäinen painemittari asetettu; kallonsisäistä hypertensiota ei saatu hallintaan; päätös palliatiivisesta hoidosta
Tulos
- Edellytyksenä aivokuoleman toteaminen ja elinten luovuttaminen (paitsi maksan luovutus: vasta-aiheinen)
- Biokemialliset löydökset sopivat OTC-puutokseen (virtsan oroottihapon syvä kohoaminen, plasman glutamiinipitoisuus korkea, arginiinipitoisuus matala)
- Geneettiset testit vahvistivat OTC-puutokseen liittyvän OTC-geenin mutaation
GCS = Glasgow’n kooma-asteikko; RR = viitealue; CT = tietokonetomografia; OTC = ornitiinitranskarbamylaasi.
Laatikko 2 – Kahden potilaamme ammoniakkipitoisuudet ja heidän hoitovasteensa*
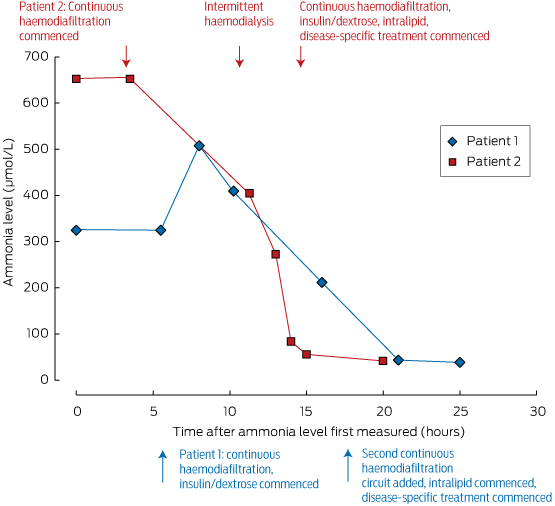
* Huomaa potilaan 2 seerumin ammoniakkipitoisuuksien nopea lasku, joka saavutettiin jaksottaisen hemodialyysin aloittamisen jälkeen (noin 10 tuntia ensimmäisen mittauksen jälkeen).