Guanosiinitrifosfaatti (tarkemmin sanottuna guanosiini-5′-trifosfaatti tai yksinkertaisuuden vuoksi myös yleisesti lyhennettynä GTP) on korkeaenerginen nukleotidi (ei pidä sekoittaa nukleosidiin), jota esiintyy sytoplasmassa tai joka on polymeroitunut muodostaen guaniiniemästä.
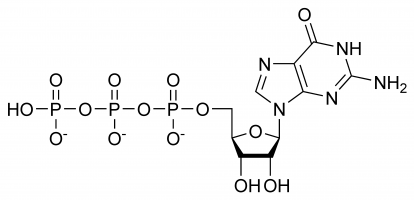
GTP:llä on valikoivia tehtäviä RNA-säikeiden muodostamisessa, se toimii proteiinisynteesin energiankuljettajamolekyylinä, koentsyyminä, cGMP:n edeltäjänä – sekundaarisena viestimolekyylinä tai efektimolekyylinä. Kaksi jälkimmäistä osoitetaan yleisesti G-proteiinin modulaation avulla. Kaikki nämä ovat seurausta sen monimutkaisesta kolmiulotteisesta rakenteesta ja erilaisista kemiallisista ryhmistä, joista se koostuu. Yksinkertaisuuden vuoksi sitä voidaan siis ajatella erilaisten funktionaalisten ryhmien sekoituksena, jotka käytännössä suorittavat eri tehtäviä erillään (vaikka toisinaan rakenne on mukana esimerkiksi silloin, kun se on vuorovaikutuksessa entsyymin ja toisen substraatin kanssa), esimerkiksi vain trifosfaatti osallistuu energian vapauttamiseen polymerisaatiota varten, kun taas vain guaniiniemäs osallistuu sen deaminointiin. On tärkeää huomata, että alussa esitetty luettelo ei kuvaa sen kemiallisia vuorovaikutussuhteita, vaan se on vain osoitus sen erilaisista kyvyistä.
GTP:ssä riboosisokeri on keskeisellä sijalla kovalenttisesti sidottujen guaniini- ja trifosfaattimolekyylien kolmiulotteisessa järjestelyssä. Tämä monosakkaridi tarjoaa hydroksyyliryhmiä kondensaatioreaktioita ja nukleofiilisiä hyökkäyksiä varten, joista jälkimmäinen on tärkeä RNA-molekyylien tuhoutumisen ja siten geeniekspression säätelyn kannalta. Guaniinimolekyyli ja trifosfaatti muodostavat kovalenttisia sidoksia C’1- ja C’5-atomien kohdalla, mutta ne voivat käyttää myös muita hydroksyyliryhmiä, kunhan syntyvä rakenne ei aiheuta yhteentörmäystä. Puriinin näkökulmasta se on sitoutunut kondensaatioreaktion tuloksena sen 9’N-atomiin, joka oli aiemmin ollut kovalenttisesti sitoutunut vetyatomiin. Koska guaniini on puriinin emäs, se luokitellaan puriinitrifosfaatiksi yhdessä adeniinitrifosfaatin (ATP) kanssa, ja se muodostuu inosiinimonofosfaatin muuntumisen kautta.
Sisältö
- 1 Harhaluulo: GTP, perusrakennusaine
- 2 Yksi monista RNA:n emästen esiasteista
- 3 GTP; universaalin ATP:n serkku
- 4 Signaalin välittämisen resurssi
- 5 Viitteet
Väärinkäsitys: GTP, perusrakennusaine
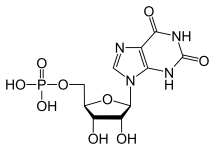
Maksa on tärkein elin, joka syntetisoi puriini- ja pyramidiininukleotideja. Puriininukleotidit (GTP ja ATP) syntetisoidaan luomalla ensin inosiinimonofosfaattia ATP:stä, glutamiinista, glysiinistä, CO2:sta, aspartaatista ja formiaatista. IMP
voidaan sen jälkeen muuttaa siten, että saadaan jompikumpi molekyyleistä.
GTP:n muodostumisen tapauksessa IMP:n muuttaa ensin IMP-dehydrogenaasi XMP:ksi. Syntynyt kemiallinen ja rakenteellinen muutos mahdollistaa GTP-syntaasin toiminnan, joka muuttaa XMP:n nopeasti GMP:ksi. GMP ei kuitenkaan ole korkeaenerginen molekyyli, koska sillä ei ole trifosfaattia, joten nukleosidifosfaattikinaasit fosforyloitavat sen ensin difosfaatiksi ja lopulta trifosfaatiksi.
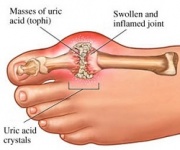
GTP kataboloituu normaalisti liukenemattomaksi virtsahapoksi, joka voi sitten esiintyä virtsassa natriumuraattikiteinä. Tätä prosessia pidetään epänormaalina, jos se tapahtuu synoviaalinivelissä, jolloin syntyy virtsahappoa, joka sitten muuttuu haitalliseksi mononatriumuraatiksi tai kalsiumpyrofosfaattidihydraatiksi. Tällaisten kemikaalien läsnäolo mahdollistaa tulehduksen ja niveltulehduksen kehittymisen, ja yhdistetyt oireet johtavat taudin luokitteluun kihdiksi. Toinen esimerkki asianmukaisen puriininukleotidikatabolian merkityksestä on vaikea yhdistetty immuunipuutostauti, joka johtaa välttämättömien B- ja T-lymfosyyttien tuhoutumiseen
Yksi monista RNA:n emästen esiasteista
RNA:n ja DNA:n välillä on useita eroja, mutta ensisijainen ero on kumpaakin polymeeriä rakentavien nukleoaasien rakenteessa. RNA-nukleobaasit sisältävät riboosisokerissaan 2’OH-ryhmän, jonka ansiosta ne ovat kemiallisesti huomattavasti reaktiivisempia, katalyyttisempiä ja epävakaampia. On tärkeää huomata, että guanosiinitrifosfaatti liittyy ainoastaan RNA:n guaniiniemästen tuotantoon. GTP:n analogi DNA:n guaniiniemästä muodostettaessa on deoksiguanosiinitrifosfaatti. Tämä trifosfaatti sisältää deoksiriboosisokerin ilman
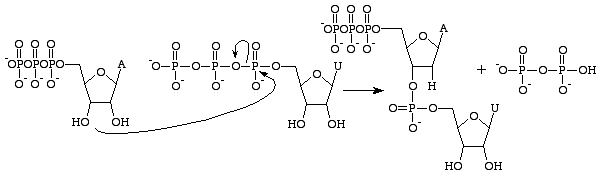
2’OH-ryhmää, mikä tekee siitä huomattavasti vakaamman – se estää nukleofiiliset hyökkäykset, jotka pilkkoisivat nukleobaasien väliset fosfodiesterisidokset. Tämä on ihanteellista, koska RNA:n pitäisi hajota sen jälkeen, kun se on käännetty proteiiniksi, kun taas DNA:n on pysyttävä ehjänä geneettisen informaation siirtämiseksi tytärsoluun.
Guanosiinitrifosfaatti johtaa guaniiniemästä muodostumiseen anhydridisidoksen pilkkoutumisen seurauksena ja vapauttaa alfa- ja gammafosfaatteja vapaina fosfaatteina. GMP muodostaa sitten fosfodiesterisidoksen läheisen 3’OH-ryhmää sisältävän emäksen kanssa ja antaa 3’OH-ryhmän seuraavaa RNA-emästä varten. Tämä reaktio tapahtuu vain, jos GMP:n vastakkainen emäs on sytosiini, jonka kanssa se voi muodostaa vetysidoksia, ja RNA-polymeraasi lisää sen nopeutta. RNA-polymeraasi ei kohdista trifosfaatteja. Se ainoastaan katalysoi reaktiota, joka tapahtuu sen jälkeen, kun tämä on tehty itsenäisesti. Katalyysin jälkeen molekyyli on osa polynukleotidiketjua, eikä sitä enää kutsuta GTP:ksi vaan emäksiseksi guaniiniksi.
GTP; universaalin ATP:n serkku
Perusmekanismi, jolla anhydridisidoksen pilkkoutumisesta saadaan energiaa, on sama kaikissa trifosfaateissa. Trifosfaattien korkea energiataso saavutetaan kolmella eri mekanismilla. Ensimmäinen johtuu kumpaankin fosfaattiryhmään kohdistuvista
hylkivistä voimista. Tämä vaikuttaa osaltaan sidoksissa olevien trifosfaattien suureen epävakauteen ja suureen ”haluun” saavuttaa alhaisempi energiatila. Toinen johtuu resonanssistabilisaatiosta. Kun GTP
muunnetaan GDP:ksi, olemassa olevien elektroniparien mahdollisten asentojen määrä kasvaa, mikä lisää vakautta. Tämä väite pitää paikkansa myös muunnettaessa BKT GMP:ksi. Kolmas väite johtuu epäsuotuisasta entrooppisesta vaikutuksesta, joka lisääntyneellä fosfaattien määrällä on molekyyliä ympäröivien vesimolekyylien konformaatioon.
Koska GTP:n pitoisuus sytoplasmassa on huomattavasti pienempi kuin ATP:n, sitä käytetään erityisiin tehtäviin solun aineenvaihdunnassa.
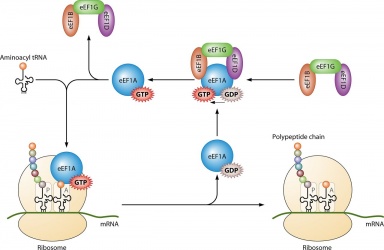
Sen pääasiallinen käyttö on proteiinisynteesissä, kun se kytkeytyy IF2:n kanssa ribosomaalisen initiaation aikana, Ef-Tu:n ja Ef-G:n kanssa elongaation aikana ja ;RF3:n kanssa terminaation aikana. Kaikki GTP-molekyylit, jotka sitoutuvat mainittujen proteiinien kanssa, defosforyloidaan, jolloin syntyy GDP:tä ja vapaata fosfaattia
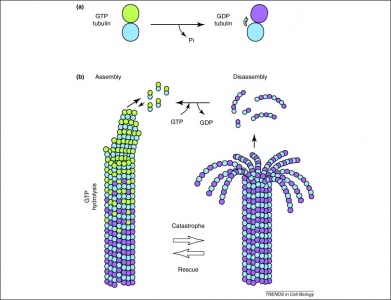
Tubuliinidimeerit hyödyntävät GTP:tä myös mikrotubulusten muodostamisessa. Tubuliinidimeerit koostuvat alfa- ja beetatuubuliinista, joilla kummallakin on GTP:n sitoutumiskohdat. Koska beeta-tubuliini on filamentin plus-päässä, GTP hydrolysoituu aina täällä, kun toinen dimeeri lisätään pidentyvään polymeeriin. On tärkeää, että GTP:n hydrolyysi heikentää tubuliinidimeerien välisiä ei-kovalenttisia vuorovaikutuksia, mikä helpottaa mikrotubulusten liukenemista tarvittaessa. Huomattakoon, että alfa-tubuliiniproteiinin GTP:tä ei defosforyloida, joten sen voidaan katsoa olevan johdonmukainen koko mikrotubuluksen rakenteen läpi.
Signaalien välittämisen voimavara
GTP:n spesifisen kemian ja spatiaalisen konformaation käyttö osoitetaan tehokkaasti, kun sitä käytetään signaalien välittämiseen. Ensisijaisesti se pystyy sitomaan ja säätelemään erilaisten signaalireitin proteiinien toimintaa, jotka luokitellaan kahteen eri ryhmään. Ensimmäiseen ryhmään kuuluvat heterotrimeeriset GTP:tä sitovat proteiinit (tunnetaan myös nimellä heterotrimeeriset G-proteiinit), jotka hyödyntävät GTP:tä G-proteiinikytkentäisten reseptorien aktivoituessa muuttaakseen muiden reitillä olevien proteiinien toimintaa. Toiset ovat monomeerisia GTP:tä sitovia proteiineja (tunnetaan myös nimellä monomeeriset G-proteiinit). Nämä reagoivat muihin reseptoreihin kuin G-proteiinikytkentäisiin reseptoreihin. Tyypillinen esimerkki, joka mainitaan heidän selityksessään, on Ras-proteiini. Huomaa, että ne pystyvät sitomaan GTP b:tä selektiivisesti paitsi sen spesifisen kemian myös indusoidun fit-ilmiön ansiosta. Sitoutunut GTP hydrolysoituu tietyn ajan kuluttua, mikä johtaa proteiinin autoinaktivoitumiseen ja estää signaalireitin liiallisen stimulaation. GTP:n hydrolysoitumisen jälkeen BKT pysyy sidottuna, koska konformaatiomuutos johtaa affiniteetin siirtymiseen GTP-molekyyliä ja BKT-molekyyliä kohti. Tämä on kuitenkin impernamenttimuutos, ja se voidaan kumota G-proteiinikytkentäisen reseptorin myöhemmällä aktivoinnilla.
GTP:tä voidaan käyttää myös reaktanttina tuottamaan cGMP:tä, joka on suhteellisen yleinen toissijainen signaalimolekyyli. Katalyysi käynnistyy NO:n vapautumisella, joka aktivoi guanylaattisyklaasia, entsyymiä, joka tuottaa cGMP:tä GTP:stä. cGMP voi sitten toimia efektorina proteiinikinaaseille, jotka fosforyloivat ja muuttavat tiettyjen proteiinien toimintaa.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell ja P A Weil. Harper’s Illustrated Biokemia. 28. painos. Peking, Kiina. 2009.
- J Dow, G Lindsay ja J Morrison, Biochemistry: Molecules, Cells and the Body. 1. painos. Wokingham, Englanti. Addison-Wesley. 1996.
- J Dow, G Lindsay ja J Morrison, Biochemistry: Molecules, Cells and the Body. 1. painos. Wokingham, Englanti. Addison-Wesley. 1996.
- J Dow, G Lindsay ja J Morrison, Biochemistry: Molecules, Cells and the Body. 1. painos. Wokingham, Englanti. Addison-Wesley. 1996.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- M W King. Lääketieteellisen biokemian sivu. Syyskuu 2016. Viitattu: 11:31. 03.12.2016. Saatavissa: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- R K Murray, D A Bender, K M Botham, P J Kennelly, V W Rodwell ja P A Weil. Harper’s Illustrated Biokemia. 28. painos. Peking, Kiina. 2009.
- M W King. Lääketieteellisen biokemian sivu. Syyskuu 2016. Viitattu: 11:31. 03.12.2016. Saatavissa: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Lääketieteellisen biokemian sivu. Syyskuu 2016. Viitattu: 11:31. 03.12.2016. Saatavissa: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. Lääketieteellisen biokemian sivu. Syyskuu 2016. Viitattu: 11:31. 03.12.2016. Saatavissa: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- M W King. The Medical Biochemistry Page. Syyskuu 2016. Viitattu: 11:31. 03.12.2016. Saatavissa: http://themedicalbiochemistrypage.org/nucleotide-metabolism.php#purine
- J Dow, G Lindsay ja J Morrison, Biochemistry: Molecules, Cells and the Body. 1. painos. Wokingham, Englanti. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1. painos. Wokingham, Englanti. Addison-Wesley. 1996.
- J Dow, G Lindsay and J Morrison, Biochemistry: Molecules, Cells and the Body. 1. painos. Wokingham, Englanti. Addison-Wesley. 1996.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- J M Berg, J L Tymoczko, G J Gatto ja R Stryer. Biochemistry. Kahdeksas painos. Kaupunki ja maa tuntematon. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto ja R Stryer. Biochemistry. Kahdeksas painos. Kaupunki ja maa tuntematon. Freeman and Co. 2015.
- J M Berg, J L Tymoczko, G J Gatto ja R Stryer. Biochemistry. Kahdeksas painos. Kaupunki ja maa tuntematon. Freeman and Co. 2015.
- T E Dever ja R Green. Elongaatio-, terminaatio- ja kierrätysvaiheet Eukaryooteissa. CSHPB. Heinäkuu 2012. 4:7:1-16
- B Alberts et al. Molecular Biology of The Cell. Kuudes painos. New York, Yhdysvallat. Garland Science. 2015.
- B Alberts. Molecular Biology of The Cell. 6. painos. New York, Yhdysvallat. Garland Science. 2015.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
- J Koolman ja KH Roehm, Color Atlas of Biochemistry, 3. painos, Stuttgart, Saksa. Thieme 2013.
”.